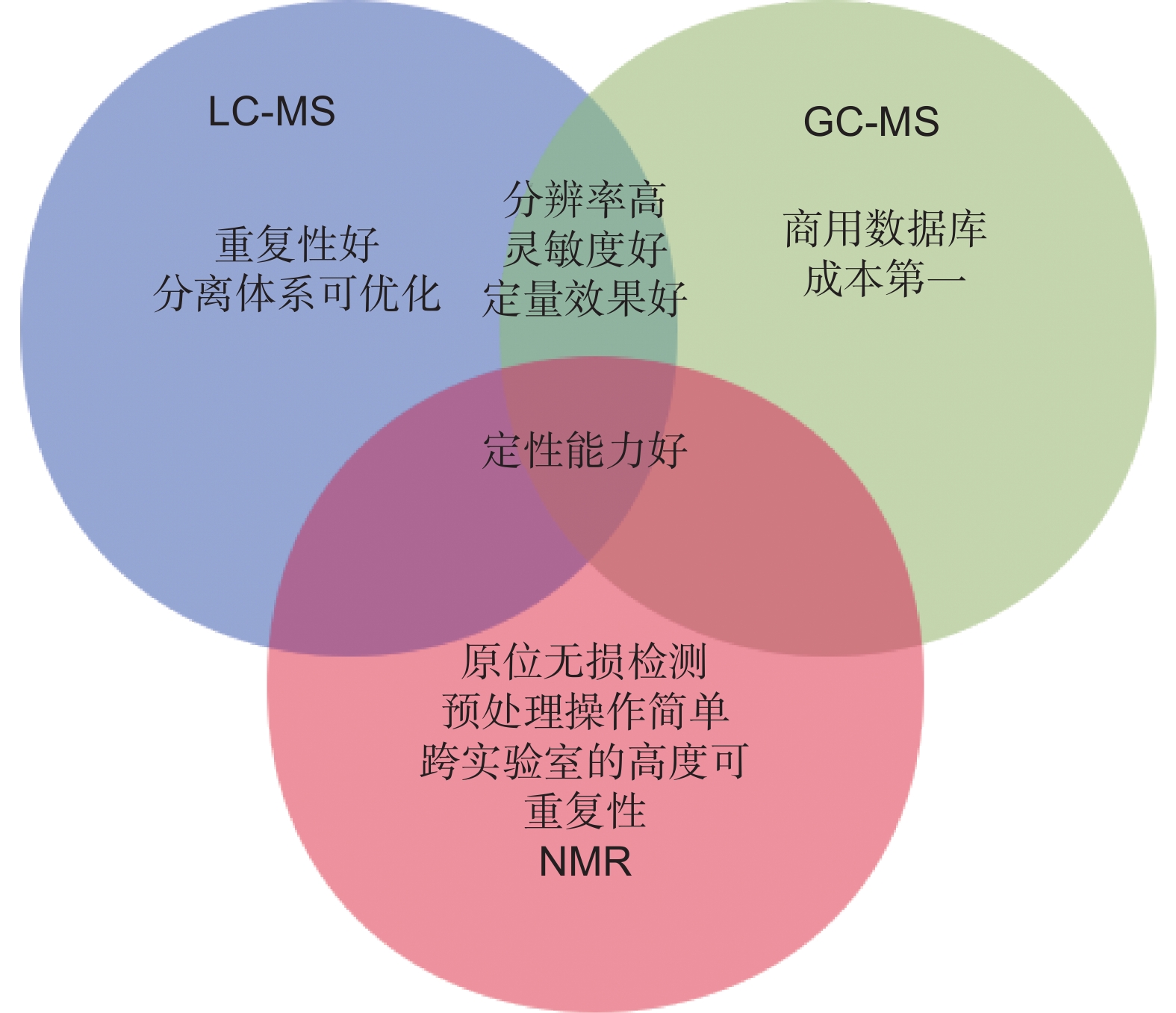
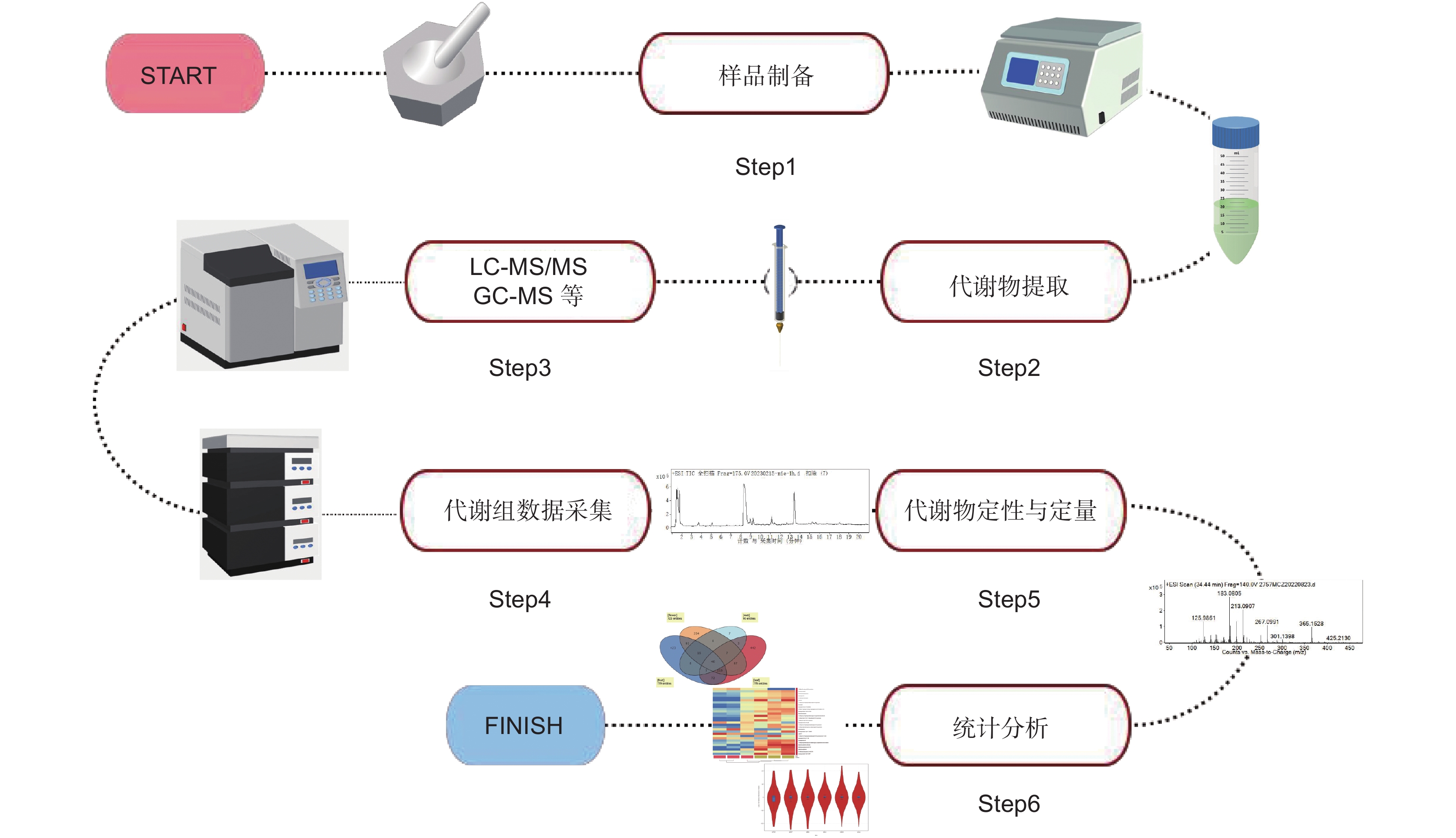
Application of metabonomics in regulation study of plant secondary metabolites
-
摘要:
代谢组学是继蛋白质组学和基因组学之后发展起来的新型学科,主要研究生物样本和器官小分子代谢产物,目前广泛应用于生物医学、食品科学、农业动植物学等领域。本文总结了代谢组学技术在植物次生代谢调控研究中的应用,对近5年代谢组学技术在植物热门领域的应用情况进行概括,以期为代谢组学在植物研究领域方面的进一步发展提供理论依据。
Abstract:Metabonomics is a new discipline that has emerged after proteomics and genomics, and is mainly applied to study biological samples and small molecule metabolites in organs. Currently, it is widely used in biomedicine, food science, agricultural zoology, botany, and other fields. This paper summarizes the application of metabolomics technology in the regulation of plant secondary metabolism as well as the research status of metabolomics in popular fields of plant research in the past five years to provide a theoretical basis for the further development of metabolomics research.
-
Keywords:
- Metabolomics /
- Botany /
- Secondary Metabolism /
- Difference
-
青藏高原是生物多样性热点地区。高寒草甸是青藏高原典型的草地类型,生态脆弱并且对环境变化敏感[1, 2]。气候和人类干扰引起了高寒草甸“斑块状”退化以及植物多样性降低,而不同植物功能群所受影响往往并不一致[3, 4]。研究表明,高寒草甸退化整体表现为由禾状草优势向豆科和杂类草优势转变[5],禾状草中莎草科和禾本科之间土壤资源竞争激烈,而豆科和杂类草生态位重叠较多[6]。
相比植物物种,以植物功能群为单位研究植物多样性对生态系统过程和功能的影响具有一定的优势。不同植物功能群基于生理、形态、生活史或对环境的响应进行区分,差异较为明显[7]。例如,禾状草植株高大、具有发达的根系和分蘖能力,因此具有较强的光照、土壤养分资源的竞争能力和定殖能力[8];而大多数杂类草比禾状草根浅[9]。豆科植物与根瘤菌共生,其氮含量显著高于禾状草和杂类草,具有较高的氮元素吸收利用能力[10]。与直接采样调查[11, 12]或人工建群[13, 14]的研究方法相比,植物功能群移除实验更易人为控制,植物群落组成更接近自然环境。因此,植物功能群移除实验有助于了解高寒草甸退化过程中植物特定功能群损失对土壤生态系统功能的影响。
土壤真菌作为分解者在土壤养分循环和物质流动过程中有重要作用。植物-土壤-真菌群落相互作用与反馈是维持高寒草甸生态系统功能与服务的重要纽带[15]。地上植被可以通过凋落物或根系分泌物形式向土壤输入有机质,改变土壤养分条件,从而影响土壤真菌群落的组成结构与功能[16, 17]。因此,探究植物功能群移除对土壤真菌群落的影响对掌握高寒草甸植物群落对土壤生态系统生态功能的贡献具有重要意义。
过去草地生态系统中植物功能群对土壤真菌群落的影响多在温带地区开展研究[18-21],青藏高原高寒草甸植物对气候变化敏感而研究较少。有研究表明植物特定功能群对土壤微生物[22, 23]或真菌群落[24]有影响,却未进一步分析其对真菌群落结构、各组成类群和多样性的具体影响。部分研究局限于植物功能群对特定的真菌类群的影响,如菌根真菌[25, 26]。青藏高原土壤真菌群落对植物特定功能群损失的响应缺乏明确和系统性了解。以往的移除实验多采用移除单一功能群的方法,以观测此植物功能群在生态系统中的贡献,本研究尝试保留单一植物功能群与不进行移除处理的对照、移除所有植物功能群的处理相比较,以明确植物特定功能群对土壤真菌群落结构和多样性的影响。
因此,本研究将青藏高原高寒草甸的植被划分为禾状草、豆科和杂类草3个不同的植物功能群,采用高通量测序技术对不同植物功能群移除处理后的土壤真菌群落结构和组成进行测定,探究植物特定功能群损失对土壤真菌群落和调控土壤真菌群落特征变化的重要环境因子的影响,以期明确高寒草甸植物特定功能群物种损失对土壤真菌群落的影响,为土壤生态系统功能的维持机制提供科学依据。
1. 材料与方法
1.1 研究区概况
研究地点位于青藏高原东部甘肃省甘南草原生态系统国家野外科学观测研究站(33°58′N,101°53′E),海拔3 550 m。该地区年平均气温1.8 ℃,年均降水量约593 mm[27]。每年日照约为2 580 h,一年中霜期超过270 d。土壤类型为亚高山草甸土,属湿润寒冷的高原气候[28]。高寒草甸样地中线叶嵩草(Carex capillifolia (Decne.) S. R. Zhang)占据优势。将样地植物划分为以下3个功能群:禾状草(包含禾本科和莎草科)、豆科和杂类草。禾状草以垂穗披碱草(Elymus nutans Griseb)和异针茅(Stipa aliena Keng)为主;杂类草以小花草玉梅(Anemone rivularis Buch.-Ham.)、钝苞雪莲(Saussurea nigrescens Maxim.)、重冠紫菀(Aster diplostephioides (DC.) CB Clarke)为主;豆科植物以披针叶黄华(Thermopsis lanceolata R. Br.)、青海苜蓿(Medicago archiducis-nicolai Sirj.)为主[27]。
实验样地建立于2018年,采用拉丁方设计。实验共设5个不同的植物功能群移除处理:对照,不移除任何植物功能群的处理(CK)、移除豆科和杂类草而保留禾状草(Graminoids)、移除禾状草和杂类草而保留豆科(Legumes)、移除禾状草和豆科而保留杂类草(Forbs)以及移除所有植物功能群(None)。每个处理5个重复,共设置25个1.5 m × 1.5 m样方(图1)。样方之间间隔1 m作为缓冲带。由于样地所在位置有一定的坡度,因此将同一高度上5个处理作为一个区组,视作一个重复。2018年8月开始进行移除处理后,其后每年生长季都对样地进行多次移除处理,以达到较好的移除效果。每次移除处理都按照不同功能群类别将目标植物齐地剪除并移出。
1.2 样品采集
2021年9月采集土壤样品,每个样方划分为9个小样方,选取其中一个小样方的4个角和中心点钻取0~10 cm土层,混合为1个样品。土壤样品带回实验室后过 2 mm筛收集土壤中植物根系并去除石子,分为3部分。取其中10 g鲜土烘干用于土壤含水率的测定;40 g鲜土用于铵态氮、硝态氮、可溶性有机碳的测定和土壤真菌测序分析;剩余土壤在室温下风干,用于土壤总碳、总氮和有机碳的测定。
1.3 土壤理化性质和根碳、氮含量的测定
采用烘干法(105 ℃,24 h)测定土壤含水率(Soil water content,SWC)。采用水杨酸-次氯酸盐分光光度法测定铵态氮(Ammonium nitrogen,
NH+4 -N),硫酸肼还原法测定硝态氮(Nitrate nitrogen,NO−3 -N)。可溶性有机碳(Dissolved organic carbon,DOC)采用0.5 mol/L 的K2SO4浸提后,180 r/min离心1 h,上清液用0.45 μm的微孔滤膜过滤,得到的滤液用TOC分析仪测定。植物根系先80 ℃烘干,后45 ℃烘干至恒重,用于根系生物量的测定以及根总碳、根总氮的测定。土壤总碳(Total carbon,TC)、总氮(Total nitrogen,TN)、土壤有机碳(Soil organic carbon,SOC)、根总碳(Root total carbon,Root TC)、根总氮(Root total nitrogen,Root TN)含量均用全自动有机元素分析仪(Vario macro cube,Elementar)测定。1.4 土壤真菌总DNA提取、PCR扩增、测序、OTUs和功能类群的划分
使用CTAB/SDS方法从土壤样品中提取真菌总基因组 DNA。在1%琼脂糖凝胶上检测 DNA 浓度和纯度。所有PCR反应均使用Phusion® High-Fidelity PCR Master Mix(New England Biolabs)预混液进行,对目标片段进行PCR扩增。采用真菌通用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')/ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对真菌ITS1区进行扩增。PCR产物用2% 琼脂糖凝胶电泳检测,胶回收试剂盒(Qiagen,Germany)回收。使用 TruSeq® DNA PCR-Free Sample Preparation Kit(Illumina,USA)生成测序文库,基于 Illumina NovaSeq 平台进行测序。土壤真菌测序由北京诺禾致源科技股份有限公司完成。对测序序列Reads 拼接过滤后得到的有效序列用Usearch软件在97%相似度水平下聚类生成OTUs(Operational taxonomic units)。以UNITE为参考数据库对特征序列进行分类学注释后进行后续分析。利用 FUNGuild 数据库对土壤真菌群落进行功能注释,根据宿主种类和营养方式大体上分为13个功能类群。
1.5 数据处理及分析
采用R v4.1.3软件进行数据分析及可视化。真菌群落Alpha多样性指数等基于OTUs结果计算。不同处理间真菌群落结构的差异采用基于Bray-Curtis 距离的非度量多维尺度分析(NMDS)和相似性分析(ANOSIM)进行分析。对不同植物功能群移除处理下根系性质、土壤理化性质、土壤真菌群落结构组成、功能类群组成的差异采用线性混合模型进行分析。线性混合模型中以试验处理为固定因素,样方所在的区组为随机因素。土壤真菌群落与环境因子(根系性质和土壤理化性质)的相关性通过Spearman相关系数和Mantel test进行分析。Mantel test分析中真菌群落结构基于OTUs水平衡量,真菌群落功能基于FUNGuild注释结果的相对丰度衡量。土壤真菌多样性指数与环境因子的相关性采用Spearman相关分析。图表中数据为平均值 ± 标准误。
2. 结果与分析
2.1 植物根系性质和土壤理化性质
研究结果显示,样地植物根总碳的平均含量分布在271.2~332.0 g/kg。根总氮的平均含量分布在8.1~9.5 g/kg。根系碳氮比的平均值分布在30.1~34.6。平均根系生物量分布在0.5~0.9 kg/m2。不同植物功能群移除处理的根系性质(根总碳、根总氮、根系碳氮比、根系生物量)差异不显著(表1)。
表 1 不同植物功能群移除下根系性质Table 1. Root properties under removal of different plant functional groups指标Index CK Forbs Graminoids Legumes None 根总碳 / g/kg 332.0 ± 6.0a 275.6 ± 7.8a 279.1 ± 31.1a 271.2 ± 29.4a 300.3 ± 27.0a 根总氮 / g/kg 8.91 ± 0.85a 8.63 ± 0.74a 8.14 ± 0.25a 9.04 ± 0.65a 9.43 ± 0.49a 根系碳氮比 34.04 ± 5.44a 32.85 ± 2.76a 34.59 ± 4.35a 30.13 ± 2.81a 31.80 ± 2.13a 根系生物量 / kg/m2 0.68 ± 0.23a 0.85 ± 0.20a 0.77 ± 0.12a 0.72 ± 0.16a 0.54 ± 0.15a 注:同行不同小写字母表示在0.05水平上差异显著。CK:不移除;Forbs:移除禾状草和豆科而保留杂类草;Graminoids:移除豆科和杂类草而保留禾状草;Legumes:移除禾状草和杂类草而保留豆科;None:移除所有植物功能群。下同。 Notes: Different lowercase letters in the same row indicate significant differences at the 0.05 level. CK: No removals; Forbs: Removal of graminoids and legumes; Graminoids: Removal of legumes and forbs; Legumes: Removal of graminoids and forbs; None: Removal of all. Same below. 不同植物功能群移除处理下,SWC、TC、TN、C/N、SOC、DOC和
NH+4 -N、NO−3 -N含量均无显著差异(表2)。表 2 不同植物功能群移除下土壤理化性质Table 2. Soil properties under removal of different plant functional groups指标Index CK Forbs Graminoids Legumes None 土壤含水率 / % 54.72 ± 2.18a 55.10 ± 5.30a 54.91 ± 3.92a 50.80 ± 5.10a 51.86 ± 4.87a 总碳 / g/kg 65.05 ± 3.50a 67.44 ± 5.89a 60.38 ± 4.65a 64.97 ± 6.68a 61.19 ± 5.66a 总氮 / g/kg 5.85 ± 0.25a 6.08 ± 0.45a 5.53 ± 0.36a 5.82 ± 0.48a 5.56 ± 0.43a 碳氮比 11.09 ± 0.14a 11.06 ± 0.16a 10.89 ± 0.19a 11.09 ± 0.24a 10.96 ± 0.18a 土壤有机碳 / g/kg 67.72 ± 3.34a 67.15 ± 5.43a 60.60 ± 4.97a 63.01 ± 5.60a 62.43 ± 5.92a 可溶性有机碳 / mg/kg 309.4 ± 19.8a 309.1 ± 25.4a 263.9 ± 15.0a 286.2 ± 14.5a 269.3 ± 11.3a 铵态氮 / mg/kg 8.79 ± 1.16a 9.33 ± 0.45a 9.80 ± 1.88a 8.45 ± 1.58a 9.55 ± 1.23a 硝态氮 / mg/kg 6.10 ± 0.94a 5.22 ± 0.68a 4.76 ± 0.32a 4.14 ± 0.60a 6.62 ± 0.99a 2.2 土壤真菌群落结构组成、多样性和功能类群
从样地土壤样品中共获得814个OTUs(图2),隶属于12个门、27个纲、62个目、99个科和 177个属。其中,735个OTUs 为5种处理的样地所共有,对照处理中特有40个 OTUs(图2:A)。在门级水平上,除未分类的真菌类群,所有处理中都以子囊菌门、被孢霉门、担子菌门为优势门(相对丰度 > 10%),其相对丰度分别为51.0%~57.0%、19.5%~23.2%、16.4%~24.8%(图2:B)。基于Bray-Curtis距离的NMDS分析结果表明(图2:C),在门级水平上,不同植物功能群移除处理的土壤真菌群落结构相似。模型应力函数(Stress)值小于0.05,说明结果较为可靠。采用ANOSIM分析进一步验证,结果一致(P = 0.997)。
![]() 图 2 不同植物功能群移除下土壤真菌群落结构组成A:不同处理土壤真菌OTUs的Venn图;B:不同样品的门水平土壤真菌群落结构组成;C:不同处理下门水平的土壤真菌群落NMDS图。CK:不移除;Forbs:移除禾状草和豆科而保留杂类草;Graminoids:移除豆科和杂类草而保留禾状草;Legumes:移除禾状草和杂类草而保留豆科;None:移除所有植物功能群。Figure 2. Soil fungal community composition under removal of different plant functional groupsA: Venn diagram of soil fungal OTUs in different treatments; B: Phylum-level soil fungal community composition in different samples; C: NMDS diagram of phylum-level soil fungal community in different treatments. CK: No removals; Forbs: Removal of graminoids and legumes; Graminoids: Removal of legumes and forbs; Legumes: Removal of graminoids and forbs; None: Removal of all.
图 2 不同植物功能群移除下土壤真菌群落结构组成A:不同处理土壤真菌OTUs的Venn图;B:不同样品的门水平土壤真菌群落结构组成;C:不同处理下门水平的土壤真菌群落NMDS图。CK:不移除;Forbs:移除禾状草和豆科而保留杂类草;Graminoids:移除豆科和杂类草而保留禾状草;Legumes:移除禾状草和杂类草而保留豆科;None:移除所有植物功能群。Figure 2. Soil fungal community composition under removal of different plant functional groupsA: Venn diagram of soil fungal OTUs in different treatments; B: Phylum-level soil fungal community composition in different samples; C: NMDS diagram of phylum-level soil fungal community in different treatments. CK: No removals; Forbs: Removal of graminoids and legumes; Graminoids: Removal of legumes and forbs; Legumes: Removal of graminoids and forbs; None: Removal of all.土壤真菌群落以子囊菌门、被孢霉门、担子菌门为优势门。球囊菌门的相对丰度在保留杂类草、保留豆科的处理中显著高于对照。捕虫霉门的相对丰度在保留豆科处理中显著高于其他处理(表3)。
表 3 不同植物功能群移除下门水平土壤真菌相对丰度 / %Table 3. Relative abundance of soil fungi at the phylum level under removal of different plant functional groups / %门Phylum CK Forbs Graminoids Legumes None 子囊菌门 55.49 ± 5.04a 51.01 ± 4.37a 55.78 ± 6.89a 55.97 ± 3.79a 56.97 ± 4.11a 被孢霉门 22.98 ± 2.07a 21.58 ± 1.88a 19.53 ± 2.27a 20.97 ± 1.83a 23.17 ± 3.61a 担子菌门 18.67 ± 5.55a 24.84 ± 4.32a 20.27 ± 6.52a 18.51 ± 4.59a 16.38 ± 4.66a 壶菌门 0.39 ± 0.06a 0.24 ± 0.06a 1.54 ± 0.52a 1.35 ± 0.69a 0.78 ± 0.26a 根肿黑粉菌门 0.53 ± 0.28a 0.65 ± 0.23a 0.83 ± 0.40a 1.27 ± 0.37a 0.43 ± 0.07a 罗兹菌门 0.16 ± 0.06a 0.18 ± 0.01a 0.28 ± 0.14a 0.30 ± 0.04a 0.27 ± 0.06a 球囊菌门 0.05 ± 0.02b 0.19 ± 0.04a 0.17 ± 0.02ab 0.18 ± 0.05a 0.11 ± 0.02ab 油壶菌门 0.15 ± 0.05a 0.08 ± 0.02a 0.08 ± 0.02a 0.06 ± 0.01a 0.12 ± 0.02a 毛霉门 0.06 ± 0.01a 0.03 ± 0.01a 0.03 ± 0.01a 0.10 ± 0.04a 0.02 ± 0.00a 捕虫霉门 0.01 ± 0.00b 0.01 ± 0.00b 0.01 ± 0.00b 0.03 ± 0.01a 0.01 ± 0.00b 土壤真菌多样性分析结果表明,植物功能群移除对土壤真菌OTUs、香农指数、均匀度指数、辛普森指数、Chao1指数、Ace指数无显著影响(表4)。
表 4 不同植物功能群移除下土壤真菌多样性Table 4. Soil fungal diversity under removal of different plant functional groups指数Index CK Forbs Graminoids Legumes None OTUs 585.2 ± 47.2a 633 ± 39.7a 664.8 ± 7.2a 660 ± 11.7a 671.6 ± 6.1a H 4.19 ± 0.20a 4.13 ± 0.11a 4.10 ± 0.12a 4.18 ± 0.10a 4.26 ± 0.07a Pielou 0.66 ± 0.03a 0.64 ± 0.01a 0.63 ± 0.02a 0.64 ± 0.01a 0.66 ± 0.01a D 0.96 ± 0.01a 0.95 ± 0.01a 0.94 ± 0.01a 0.95 ± 0.01a 0.95 ± 0.01a Chao1 617.57 ± 45.20a 672.76 ± 34.79a 699.08 ± 9.69a 698.73 ± 8.42a 699.74 ± 3.97a Ace 613.88 ± 44.54a 661.72 ± 37.37a 697.51 ± 8.34a 693.77 ± 8.52a 696.92 ± 4.74a 注:OTUs,操作分类单位;Ace,样本中物种组成的丰富度和均匀度;Chao1,描述样品中所含OTUs数目的指数;D,辛普森指数;Pielou,均匀度指数; H,香农指数。 Notes: OTUs, operational taxonomic units; Ace index, species composition richness and evenness in a sample; Chao1 index, number of OTUs in a sample; D, Simpson index; Pielou, Pielou’s evenness index; H, Shannon-Wiener index. 由表5可知,所有处理中,土壤腐生营养型真菌相对丰度在土壤真菌群落中占比最高,约为36%~44%。丛枝菌根真菌相对丰度在保留禾状草、保留豆科处理中显著高于对照,保留杂类草、保留禾状草、保留豆科较对照处理分别增加210%、220%、230%。地衣寄生菌/腐生菌的相对丰度在保留杂类草处理中显著高于移除所有植物功能群处理,移除所有植物功能群处理较保留杂类草处理降低82%。
表 5 不同植物功能群移除下土壤真菌功能类群相对丰度 / %Table 5. Relative abundance of soil fungal functional groups under removal of different plant functional groups / %功能类群 Functional group CK Forbs Graminoids Legumes None 动物寄生真菌/病原菌 6.75 ± 3.09a 7.97 ± 3.28a 3.19 ± 0.46a 3.48 ± 0.60a 5.73 ± 2.23a 丛枝菌根真菌 0.10 ± 0.03b 0.31 ± 0.07ab 0.32 ± 0.03a 0.33 ± 0.09a 0.22 ± 0.04ab 粪腐生真菌 7.25 ± 1.12a 3.11 ± 1.38a 4.19 ± 1.38a 5.32 ± 4.02a 4.26 ± 0.61a 外生菌根真菌 6.75 ± 5.17a 0.10 ± 0.03a 0.12 ± 0.05a 0.13 ± 0.03a 0.23 ± 0.13a 内生真菌 0.36 ± 0.06a 0.49 ± 0.21a 0.42 ± 0.07a 0.39 ± 0.08a 0.78 ± 0.11a 真菌寄生菌 1.61 ± 0.62a 0.44 ± 0.05a 0.99 ± 0.25a 0.92 ± 0.39a 1.15 ± 0.45a 叶腐生菌 5.15 ± 0.67a 3.44 ± 0.42a 9.50 ± 3.62a 5.72 ± 1.83a 7.00 ± 1.15a 地衣寄生菌/腐生菌 1.15 ± 0.40ab 1.53 ± 0.49a 0.47 ± 0.10ab 0.81 ± 0.24ab 0.28 ± 0.06b 兰花菌根真菌 0.08 ± 0.04a 0.09 ± 0.05a 0.22 ± 0.07a 0.17 ± 0.09a 0.10 ± 0.06a 植物病原菌/腐生菌 8.15 ± 2.10a 5.24 ± 0.48a 5.87 ± 0.74a 9.37 ± 1.65a 8.76 ± 1.80a 土壤腐生菌 35.64 ± 2.13a 36.85 ± 4.02a 44.49 ± 5.56a 41.82 ± 5.81a 37.26 ± 4.39a 木质腐生菌 2.34 ± 0.23a 2.30 ± 0.27a 3.33 ± 0.80a 3.53 ± 0.69a 3.81 ± 0.69a 未定义腐生菌 24.67 ± 4.47a 38.14 ± 5.48a 26.90 ± 8.90a 28.01 ± 5.38a 30.42 ± 6.67a 2.3 环境因子对土壤真菌群落影响
Mantel test检验结果表明(图3),环境因子与土壤真菌群落结构和功能变化的相关性不显著。
![]() 图 3 环境因子对土壤真菌群落结构和功能的影响(Mantel test)SWC:土壤含水率;TC:总碳;TN:总氮;C:N:碳氮比;SOC:土壤有机碳;DOC:可溶性有机碳;NH+4-N:铵态氮;NO−3-N:硝态氮;Root TC:根总碳;Root TN:根总氮;Root C:N:根系碳氮比;Root biomass:根系生物量。下同。Figure 3. Effects of environmental factors on soil fungal community composition and functionSWC: Soil water content; TC: Total carbon; TN: Total nitrogen; C:N: Carbon-to-nitrogen ratio; SOC: Soil organic carbon; DOC: Dissolved organic carbon; NH+4-N: Ammonium nitrogen; NO−3-N: Nitrate nitrogen. Root TC: Root total carbon; Root TN: Root total nitrogen; Root C:N: Root carbon-to-nitrogen ratio. Same below.
图 3 环境因子对土壤真菌群落结构和功能的影响(Mantel test)SWC:土壤含水率;TC:总碳;TN:总氮;C:N:碳氮比;SOC:土壤有机碳;DOC:可溶性有机碳;NH+4-N:铵态氮;NO−3-N:硝态氮;Root TC:根总碳;Root TN:根总氮;Root C:N:根系碳氮比;Root biomass:根系生物量。下同。Figure 3. Effects of environmental factors on soil fungal community composition and functionSWC: Soil water content; TC: Total carbon; TN: Total nitrogen; C:N: Carbon-to-nitrogen ratio; SOC: Soil organic carbon; DOC: Dissolved organic carbon; NH+4-N: Ammonium nitrogen; NO−3-N: Nitrate nitrogen. Root TC: Root total carbon; Root TN: Root total nitrogen; Root C:N: Root carbon-to-nitrogen ratio. Same below.土壤真菌多样性指数与环境因子的相关分析结果表明(图4),土壤真菌群落OTUs、Chao1、Ace指数均与根系生物量呈极显著负相关(P < 0.01)。此3个指数均与根系碳氮比、土壤可溶性有机碳含量呈显著负相关(P < 0.05)。
![]() 图 4 土壤真菌多样性与环境因子相关性分析OTUs:操作分类单位;Shannon:香农指数;Pielou:均匀度指数; D:辛普森指数;Chao1:描述样品中所含OTUs数目的指数;Ace:样本中物种组成的丰富度和均匀度。Figure 4. Correlation of soil fungal diversity and environmental factorsOTUs: Operational taxonomic units; Shannon: Shannon-Wiener index; Pielou: Pielou’s evenness index; D: Simpson index; Chao1: An index describing the number of OTUs contained in a sample; Ace: An index describing the richness and evenness of species composition in a sample.
图 4 土壤真菌多样性与环境因子相关性分析OTUs:操作分类单位;Shannon:香农指数;Pielou:均匀度指数; D:辛普森指数;Chao1:描述样品中所含OTUs数目的指数;Ace:样本中物种组成的丰富度和均匀度。Figure 4. Correlation of soil fungal diversity and environmental factorsOTUs: Operational taxonomic units; Shannon: Shannon-Wiener index; Pielou: Pielou’s evenness index; D: Simpson index; Chao1: An index describing the number of OTUs contained in a sample; Ace: An index describing the richness and evenness of species composition in a sample.3. 讨论
3.1 植物功能群移除对植物根系和土壤性质的影响
通过连续3年对不同植物功能群移除,发现不同处理间的根系性质差异不显著。在高寒草甸的研究表明,豆科比禾状草、杂类草功能群的氮含量高、C:N低;禾状草具有低氮含量和高C:N的特征[29]。本研究中根系碳氮变化不显著,可能是因为草地植物根系完全分解周期以年为单位[30],高寒草甸低温环境抑制根凋落物的分解导致样地中残存较多其他功能群的根。也可能因为碳氮是植物维持代谢所需的基础元素,其内稳性较高,变异小[31]。姜林等[3]研究表明单一植物功能群移除处理对根系生物量、根系碳氮比的影响不明显。本研究进一步发现,根系生物量和根系碳氮比在同时移除多个植物功能群处理下变化仍不明显。但两项研究均表明,相比其他处理,根系生物量在移除所有植物功能群处理中最低。这说明根系生物量对高寒草甸不同植物功能群损失的响应在短期内较为稳定,但连续高强度的植物地上部分损失会造成根系生物量的降低。
本研究中土壤理化性质在各处理中差异不显著,可能主要有以下两点原因。一是,植物功能群移除对SOC的影响可能存在一个阈值,当影响低于这一阈值时SOC变化不明显。二是,植物功能群移除可能存在滞后效应。Li等[32]在青藏高原4年的移除实验结果表明,多数土壤理化性质变化不显著,其中SOC和TN含量因低温环境抑制了微生物和酶的活性而无明显变化。加拿大北部草原为期5年的研究发现,不同植物功能群移除下SWC、SOC、TN、
NH+4 -N和其他土壤理化性质变化不显著[33]。Chen等[22]在高寒草甸9年的研究表明,移除禾状草可降低TN、NH+4 -N和NO−3 -N的含量,移除豆科可降低DOC的含量,移除杂类草可降低SOC、TN和NO−3 -N的含量。3.2 植物功能群移除对土壤真菌群落结构与功能的影响
本研究中土壤真菌群落以子囊菌门、被孢霉门、担子菌门为优势门,与前人研究结果一致[15]。这可能是由于高寒草甸土壤中有机质和木质素含量较高[34, 35],子囊菌门中包含许多腐生真菌,能促进有机质的矿化[36],担子菌门包含的真菌能促进木质素分解[37]。
球囊菌门的相对丰度在未做植物移除的对照处理低于其他处理。可能是由于移除处理中植物功能群种类的降低使得植物对地上资源竞争降低,植物营养物质更多分配给地下部分而非地上部分,导致含有多种共生型真菌的球囊菌门相对丰度升高[38]。球囊菌门中含有约300种丛枝菌根真菌,是植物根系重要的共生菌[39],其相对丰度受根系质量、生物量调节。相比其他3种进行了植物移除的处理,球囊菌门真菌的相对丰度在移除所有植物功能群的处理中较低,可能与根系生物量的降低有关。前人的研究表明,球囊菌门受植物功能群移除影响显著,与本研究一致[14]。这可能说明青藏高原土壤真菌群落中球囊菌门真菌对植物群落变化敏感。
与移除所有植物功能群处理相比,捕虫霉门的相对丰度在保留豆科处理中显著增加,在保留杂类草和保留禾状草两种处理中无显著变化。说明豆科植物可能有益于捕虫霉门真菌的增加,禾状草与杂类草对其影响不显著;而对照处理中捕虫霉门的相对丰度相较移除所有植物功能群的处理无显著增加,说明禾状草或杂类草可能抑制豆科对捕虫霉门的正面影响。捕虫霉门中多数为微型无脊椎动物(如线虫等)的寄生菌[40]。植物是否通过影响食物来源如植食性线虫等对捕虫霉门真菌相对丰度产生影响还有待探究。
本研究中,土壤腐生营养型真菌相对丰度在各处理中占比均最高,与Yang等[41]的研究结果一致。保留杂类草、保留禾状草和保留豆科处理中丛枝菌根真菌相对丰度较对照处理高,可能是因为植物功能群移除后,植物根系通过增强与丛枝菌根真菌的共生来吸收土壤养分和水分进行植物的补偿生长[42]。地衣寄生菌/腐生菌的相对丰度在保留杂类草处理中显著高于移除所有植物功能群处理,说明杂类草提高了地衣寄生菌/腐生菌的相对丰度。
3.3 植物功能群移除对土壤真菌群落影响机制
本研究中土壤真菌丰富度指数(Chao1、Ace指数)与根系生物量、根系碳氮比呈负相关。这可能是因为根系生物量的增加,会增加土壤资源输入(如根系分泌物),促进共生营养型真菌定殖,扩大了共生营养型真菌在群落中的优势,从而改变了土壤真菌的多样性,降低了其他土壤真菌的丰富度[14]。根系碳氮比影响根系分泌物的增加、根系凋落物的分解速率。根系凋落物碳氮比低,有利于分解,可能为真菌提供了较高的食物资源多样性,有利于缓解土壤真菌群落内的竞争关系,进而提高土壤真菌的丰富度[43]。本研究中土壤真菌丰富度指数与土壤可溶性有机碳呈负相关。Yang等[41]的研究同样表明,青藏高原可溶性有机碳对土壤真菌多样性、丰富度有重要影响。相比简单的化合物,真菌更倾向于利用结构复杂的DOC作为碳源[44],DOC含量的变化可能影响不同真菌类群间的协同竞争关系,改变土壤真菌多样性。影响土壤真菌多样性的研究结果往往并不一致。姜鑫等[14]在高寒草地的移除实验表明,整体而言,植物功能群和土壤理化性质对土壤微生物多样性影响不显著,植物移除对土壤真菌香农指数无显著影响。本研究进一步验证了植物移除对土壤真菌群落香农指数、均匀度指数、辛普森指数均无显著影响。研究发现,根系碳氮含量与土壤真菌多样性不相关[45]。相反,Francioli等[21]的研究表明植物功能群对腐生真菌群落结构有显著影响,这种影响与根系碳氮比的差异密切相关。赵兴鸽等[36]研究发现土壤真菌丰富度与TN正相关,与SOC和土壤C:N负相关。Kang等[46]的研究表明高寒草甸土壤真菌多样性不仅与TN、SOC、C:N相关,还与TC 、SWC显著相关。其他高寒草甸研究表明,土壤真菌群落结构变化与SWC、SOC、TN、
NH+4 -N正相关,与植物根系生物量负相关[15]。本研究中土壤真菌群落结构和功能与环境因子相关性不显著,可能是因为植物移除处理3年后植物根系和土壤理化性质变化不显著。土壤真菌多样性和群落结构在不同植物功能群移除处理间无显著差异,可能是由于土壤真菌多样性与群落结构主要受空间、气候、土壤理化性质影响,受植物多样性影响较小[41]。赵文等[15]的研究结果显示土壤真菌群落结构受植物地上部分的影响小于植物-土壤相互作用。本研究中不同植物功能群移除处理下土壤真菌群落结构发生变化,但真菌多样性、根系性质和土壤理化性质变化不显著。为减少对土壤的扰动,植物移除实验一般剪除植物地上部分,而将地下根系保留在土壤中,进一步探索植物功能群移除对土壤真菌群落的影响还需要从更长的时间尺度上进行研究,并进一步分析移除植物的根系存留在土壤中的影响。
致谢:感谢陈鹏老师在真菌高通量测定以及万文结老师在文章写作过程中给予的帮助,感谢南京农业大学资源与环境科学学院郭辉教授与胡水金教授提供实验平台。感谢兰州大学和甘南草原生态系统国家野外科学观测研究站为采样提供的条件。
1 1)如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 植物生物胁迫代谢组研究列表
Table 1 List of metabolomics studies related to plant disease control
物种
Species侵染病害
Infectious disease相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference核桃
Juglans regia L.胶孢炭疽菌 花青素B1/2/3、咖啡酸、没食子酸、柚皮素等 探讨了炭疽菌的发生机制 [16] 红枣
Ziziphus jujuba Mill.链格孢菌、细极链格孢菌 链格孢酚、细交链孢菌酮酸;天冬氨酸、甲硫氨酸和赖氨酸 阐释了黑斑病变过程中链格孢毒素的产生机理 [17] 柑橘
Citrus reticulata Blanco柑橘绿霉菌 糖类、脂质、有机酸 揭示柑橘采后绿脓杆菌的侵染机制 [18] 藜麦
Chenopodium quinoa Willd.霜霉病菌 蔗糖、生物胺、天冬氨酸、ɣ-氨基丁酸等氨基酸 揭示了毒素产生机理 [20] 小麦
Triticum aestivum L.禾谷镰刀菌 氨基酸 优化代谢物提取方法,探究染菌发生机制 [21] 小麦
Triticum aestivum L.腥黑粉菌 葫芦酸、十八碳三烯酸 揭示了籽粒腥黑穗病菌侵染前后代谢谱差异 [22] 柑橘
Citrus reticulata Blanco黄龙病 氨基酸、植物激素、嘌呤、水杨酸 证明了耐黄龙病品种的抗性策略 [19] 人参
Panax ginseng C. A. Meyer人参锈根症状 木质素、脂质、生物碱 揭示了病害的潜在分子机制 [23] 葡萄
Vitis vinifera L.中华蚱蜢、灰葡萄孢菌 脯氨酸等氨基酸、天冬氨酰-L、谷胱甘肽和一些脂肪酸 揭示了代谢组水平的复杂网络调控 [24] 表 2 植物非生物胁迫代谢组研究列表
Table 2 List of metabolomics studies related to plant abiotic stress
物种
Species非生物胁迫因素
Abiotic stress factors相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference蓝莓 Vaccinium spp. 盐 甘氨酸、苹果酸、十八烷酸、L-苏糖酸等 耐盐性机理 [26] 水稻 Oryza sativa L. 铅 脂质、类二十烷酸 根际微环境与重金属胁迫耐受性 [25] 白刺 Nitraria tangutorum Bobr. 盐 氨基酸、糖、脂肪酸 白刺对盐胁迫的代谢响应 [27] 党参 Codonopsis pilosula (Franch.) Nannf. 干旱 脂类、糖类 干旱胁迫后产物 [29] 黑麦草 Lolium perenne L. 盐 糖类、氨基酸及其中间代谢物 耐盐代谢通路 [28] 早熟禾 Poa annua L. 低温 糖和糖醇、氨基酸、有机酸 适应低温的主要机制 [30] 橡胶树 Hevea brasiliensis (Willd. ex A. Juss.)Muell. 低温 糖类、氨基酸、脂质类 低温胁迫代谢物响应机制 [31] -
[1] Nicholson JK,Lindon JC,Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica,1999,29 (11):1181−1189. doi: 10.1080/004982599238047
[2] Fiehn O. Combining genomics,metabolome analysis,and biochemical modelling to understand metabolic networks[J]. Int J Genom,2001,2 (3):155−168.
[3] Fiehn O,Kopka J,Dormann P,Altmann T,Trethewey RN,Willmitzer L. Metabolite profiling for plant functional genomics[J]. Nat Biotechnol,2000,18 (11):1157−1161. doi: 10.1038/81137
[4] 姚玲玲,柯昌强,刘佳,唐春萍,叶阳. 不同炮制程度中药饮片蜜炙甘草的次生代谢化学成分组学研究[J]. 药学学报,2021,56(5):1444−1452. Yao LL,Ke CQ,Liu J,Tang CP,Ye Y. Metabolomic investigation of secondary metabolites of prepared slices of Glycyrrhiza uralensis with different degrees of honey processing[J]. Acta Pharmaceutica Sinica,2021,56 (5):1444−1452.
[5] 王鑫梦,唐小涵,李盈瑶,普雪雪,周燕. 基于代谢组学与网络药理学分析牛筋果叶中潜在药用活性成分及机制研究[J]. 中国中药杂志,2021,46(14):3625−3632. Wang XM,Tang XH,Li YY,Pu XX,Zhou Y. An integrative metabolomics and network pharmacology method for exploring bioactive components and preliminary pharmacodynamics in medicinal parts of Harrisonia perforata[J]. China Journal of Chinese Materia Medica,2021,46 (14):3625−3632.
[6] 杨靖,许振鹏,刘艳,康立欣,杨炳友,匡海学. 基于代谢组学的补阴药药性研究[J]. 中草药,2021,52(10):2987−2995. Yang J,Xu ZP,Liu Y,Kang LX,Yang BY,Kuang HX. Research on property of Yin-tonifying herbs based on metabolomics[J]. Chinese Traditional and Herbal Drugs,2021,52 (10):2987−2995.
[7] Jang C,Chen L,Rabinowitz JD. Metabolomics and isotope tracing[J]. Cell,2018,173 (4):822−837. doi: 10.1016/j.cell.2018.03.055
[8] Van de Velde B,Guillarme D,Kohler I. Supercritical fluid chromatography - Mass spectrometry in metabolomics:past,present,and future perspectives[J]. J Chromatogr B,2020,1161:122444. doi: 10.1016/j.jchromb.2020.122444
[9] 戴宇樵,吕才有. 代谢组学技术在茶学中的应用研究进展[J]. 江苏农业科学,2019,47(2):24−28. Dai YQ,Lü YC. Research progress of application of metabolomics technology in tea science[J]. Jiangsu Agricultural Sciences,2019,47 (2):24−28.
[10] Sengupta A,Weljie AM. NMR Spectroscopy-Based metabolic profiling of biospecimens[J]. Curr Protoc Protein Sci,2019,98 (1):e98.
[11] Rinschen MM,Ivanisevic J,Giera M,Siuzdak G. Identification of bioactive metabolites using activity metabolomics[J]. Nat Rev Mol Cell Biol,2019,20 (6):353−367. doi: 10.1038/s41580-019-0108-4
[12] 张丽媛,代安娜,于润众,阮长青,李志江,张东杰. 基于代谢组学的黑龙江省不同产地大豆的代谢产物分析[J]. 现代食品科技,2021,37(6):287−295. Zhang LY,Dai AN,Yu RZ,Ruan CQ,Li ZJ,Zhang DJ. Analysis of metabolites of soybeans from different producing origins in Heilongjiang Province Based on metabonomics[J]. Modern Food Science and Technology,2021,37 (6):287−295.
[13] 周曼丽,俞赟丰,罗晓欣,兰晓栋,金梦雨,简维雄. 基于代谢组学技术的冠心病血瘀证不同进展阶段大鼠潜在生物标志物及代谢通路研究[J]. 中国中医药信息杂志,2022,29(1):73−79. Zhou ML,Yu YF,Luo XX,Lan XD,Jin MY,Jian WX. Study on potential biomarkers and metabolic pathways of rats in different progressive stages of coronary heart disease with blood stasis syndrome based on metabonomics technology[J]. Chinese Journal of Information on Traditional Chinese Medicine,2022,29 (1):73−79.
[14] Abdelhafez OH,Othman EM,Fahim JR,Desoukey SY,Pimentel-Elardo SM,et al. Metabolomics analysis and biological investigation of three Malvaceae plants[J]. Phytochem Anal,2020,31 (2):204−214. doi: 10.1002/pca.2883
[15] 赵利,钞建宾,郭捷,田海娇,高芬. 基于代谢组学技术的植物抗病相关代谢物研究进展[J]. 西北植物学报,2021,41(6):1071−1078. Zhao L,Chao JB,Guo J,Tian HJ,Gao F. Study on plant Resistance-related metabolites against pathogenic fungi based on metabolomics[J]. Acta Botanica Boreali-Occidentalia Sinica,2021,41 (6):1071−1078.
[16] 陈新,王敏,傅茂润,王贵芳,相昆,等. 核桃炭疽病发生相关的酚类物质代谢分析[J]. 林业科学,2021,57(10):71−80. Chen X,Wang M,Fu MR,Wang GF,Xiang K,et al. Metabolic analysis of phenolic compounds associated with walnut anthracnose[J]. Scientia Silvae Sinicae,2021,57 (10):71−80.
[17] 范盈盈,胡东强,张锐利,李晓龙,何伟忠,等. 黑斑病对新疆红枣营养成分的影响[J]. 食品科学,2020,41(8):303−307. Fan YY,Hu DQ,Zhang RL,Li XL,He WZ,et al. Effects of black spot disease on nutritional composition of red jujubes grown in Xinjiang[J]. Food Science,2020,41 (8):303−307.
[18] Yang QY,Qian X,Routledge MN,Wu XY,Shi Y,et al. Metabonomics analysis of postharvest citrus response to Penicillium digitatum infection[J]. LWT-Food Sci Technol,2021,152:112371. doi: 10.1016/j.lwt.2021.112371
[19] Suh JH,Tang XX,Zhang Y,Gmitter FG Jr,Wang Y. Metabolomic analysis provides new insight into tolerance of Huanglongbing in citrus[J]. Front Plant Sci,2021,12:710598. doi: 10.3389/fpls.2021.710598
[20] 赵丽娟,闫素月,史晓晶,尉俊海,张洪. 霜霉病菌侵染对藜麦叶片代谢的影响[J]. 植物病理学报,2021,51(3):334−339. Zhao LJ,Yan SY,Shi XJ,Wei JH,Zhang H. Downy mildew-infection changes the metabolism of quinoa leaves[J]. Acta Phytopathologica Sinica,2021,51 (3):334−339.
[21] Zhao PY,Gu SB,Han C,Lu YR,Ma CY,et al. Targeted and untargeted metabolomics profiling of wheat reveals amino acids increase resistance to Fusarium head blight[J]. Front Plant Sci,2021,12:762605. doi: 10.3389/fpls.2021.762605
[22] Ren ZY,Fang MK,Muhae-Ud-Din G,Gao HF,Yang YZ,et al. Metabolomics analysis of grains of wheat infected and noninfected with Tilletia controversa Kühn[J]. Sci Rep,2021,11 (1):18876−18876. doi: 10.1038/s41598-021-98283-3
[23] Bian XB,Zhao Y,Xiao SY,Yang H,Han YZ,Zhang LX. Metabolome and transcriptome analysis reveals the molecular profiles underlying the ginseng response to rusty root symptoms[J]. BMC Plant Biol,2021,21 (1):215. doi: 10.1186/s12870-021-03001-w
[24] Jia HR,Li T,Haider MS,Sadeghnezhad E,Pang QQ,et al. Comparative transcriptomic and metabolomic profiling of grapevine leaves (cv. Kyoho) upon infestation of grasshopper and Botrytis cinerea[J]. Plant Mol Biol Rep,2022,40 (3):539−555. doi: 10.1007/s11105-022-01336-8
[25] Tan B,Tan X,Liu C,Zeng Y,Li YH. Effects of lead stress on rice (Oryza sativa L. ) growth and metabolism in the rhizosphere microenvironment:the role of eicosanoid compounds[J]. Plant Growth Regul,2022,96 (3):483−495. doi: 10.1007/s10725-022-00802-3
[26] 高龙飞,贾斌,张卫华,李爱,李天杰,等. 盐胁迫下蓝莓叶片生理特性与代谢组学分析[J]. 植物生理学报,2022,58(1):155−164. Gao LF,Jia B,Zhang WH,Li A,Li TJ,et al. Physiological characteristics and metabonomics analysis of blueberry leaves under salt stress[J]. Plant Physiology Journal,2022,58 (1):155−164.
[27] 闫海冰,张慧芳,冯帆,于兆友,杨秀清. 2种白刺对盐胁迫的代谢响应机制[J]. 林业科学,2021,57(1):20−29. Yan HB,Zhang HF,Feng F,Yu ZY,Yang XQ. Metabolic response mechanism of two Nitraria species to salt stress[J]. Scientia Silvae Sinicae,2021,57 (1):20−29.
[28] 张彩峡,吴洪新,毕玉芬. NaCl胁迫下多年生黑麦草的代谢组学分析[J]. 中国草地学报,2020,42(4):62−72. Zhang CX,Wu HX,Bi YF. Metabonomics analysis of Lolium perenne under NaCl stress[J]. Chinese Journal of Grassland,2020,42 (4):62−72.
[29] 赵春旭,张然,牛奎举,朱瑞婷,王勇,等. 青海野生草地早熟禾响应低温胁迫的代谢组学研究[J]. 草地学报,2020,28(4):904−914. Zhao CX,Zhang R,Niu KJ,Zhu RT,Wang Y,et al. Metabonomics study of Qinghai wild Poa pratensis in response to low temperature stress[J]. Acta Agrestia Sinica,2020,28 (4):904−914.
[30] 毛常丽, 李玲, 杨湉, 李小琴, 张凤良, 等. 橡胶树‘云研77-4’无性系幼苗低温胁迫后的代谢组学分析[J/OL]. 分子植物育种, 2022: 1−16. (2022-03-24). http: //kns.cnki.net/kcms/detail/46.1068.S.20220322.2041.012.html. Mao CL, Li L, Yang T, Li XQ, Zhang FL, et al. The metabolomics analysis of the clone cultivar 'Yunyan 77-4' clone seedlings under low temperature stress[J/OL]. Molecular Plant Breeding, 2022: 1−16. (2022-03-24). http: //kns.cnki.net/kcms/detail/46.1068.S.20220322.2041.012.html.
[31] 原静静,孙晓琛,栗锦鹏,杜弢,王惠珍. 基于LC-MS的干旱胁迫下党参代谢组学分析[J]. 中国实验方剂学杂志,2021,27(23):145−152. Yuan JJ,Sun XC,Li JP,Du T,Wang HZ. Metabolomics analysis of Codonopsis pilosula under drought stress based on LC-MS[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27 (23):145−152.
[32] Xie HM,Wang HD,Chen BX,Lou J,Wang HM,et al. Untargeted metabolomics analysis to unveil the chemical markers for the differentiation among three Gleditsia sinensis-derived herbal medicines by ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Arabian J Chem,2022,15 (5):103762. doi: 10.1016/j.arabjc.2022.103762
[33] Liu RY,Deng J,Lin XL,Li YM,Lin Y,et al. Metabolomics reveals distinct metabolites between Lonicera japonica and Lonicera macranthoides based on GC-MS[J]. J Chem,2020,2020:6738571.
[34] Tang YC,Liu YJ,He GR,Cao YW,Bi MM,et al. Comprehensive analysis of secondary metabolites in the extracts from different lily bulbs and their antioxidant ability[J]. Antioxidants,2021,10 (10):1634. doi: 10.3390/antiox10101634
[35] Xia ZD,Liu X,Tong LG,Wang H,Feng ML,et al. Comparison of chemical constituents of Bupleurum marginatum var. stenophyllum and Bupleurum chinense DC. using UHPLC-Q-TOF-MS based on a metabonomics approach[J]. Biomed Chromatogr,2021,35 (9):e5133.
[36] Wang SQ,Li WN,Zhang XF,Li G,Li XD,et al. Metabolomics study of different germplasm resources for three polygonatum species using UPLC-Q-TOF-MS/MS[J]. Front Plant Sci,2022,13:826902. doi: 10.3389/fpls.2022.826902
[37] He YF,Cai HQ,Zhang HM,Ren ZH,Tang H,et al. A metabolomic study of Asian and American ginseng based on RRLC-QTOF/MS methods[J]. J Liq Chromatogr Relat Technol,2019,42 (13-14):452−458. doi: 10.1080/10826076.2019.1625371
[38] Jiang NH,Zhu HL,Liu W,Fan C,Jin F,Xiang X. Metabolite differences of polyphenols in different litchi cultivars (Litchi chinensis Sonn.) based on extensive targeted metabonomics[J]. Molecules,2021,26 (4):1181. doi: 10.3390/molecules26041181
[39] 高晨曦,郭义红,孙威江,陈志丹. 基于DNA条形码和代谢组学技术的闽南乌龙茶产品鉴别[J]. 应用与环境生物学报,2021,27(6):1645−1652. Gao CX,Guo YH,Sun WJ,Chen ZD. Identification of oolong tea in southern Fujian,based on DNA barcoding and metabonomics[J]. Chinese Journal of Applied and Environmental Biology,2021,27 (6):1645−1652.
[40] Zhou BX,Wang ZH,Yin P,Ma BS,Ma CQ,et al. Impact of prolonged withering on phenolic compounds and antioxidant capability in white tea using LC-MS-based metabolomics and HPLC analysis:comparison with green tea[J]. Food Chem,2022,368:130855. doi: 10.1016/j.foodchem.2021.130855
[41] Liang LJ,Li WB,Tian M,Pan JJ,Feng ZY. Metabolomic profiling of five hulless barley (Hordeum vulgare L. ) with different:study on the metabolite difference of five hulless barley with different colors based on metabonomics approach[J]. Genet Resour Crop Evol,2022,69 (5):1843−1853. doi: 10.1007/s10722-022-01345-2
[42] 钱广涛,李祥羽,周静雯,张蘅,李立新. 三种不同颜色藜麦籽粒中氨基酸及其衍生物的代谢组学分析[J]. 植物生理学报,2021,57(11):2192−2202. Qian GT,Li XY,Zhou JW,Zhang H,Li LX. Metabonomic analysis of amino acids and derivatives in three types of quinoa grains with different colors[J]. Plant Physiology Journal,2021,57 (11):2192−2202.
[43] 于润众,宗恩祥,张丽媛,张东杰. 基于GC-MS分析不同品种小米代谢产物及代谢途径[J]. 食品科学,2021,42(24):199−205. Yu RZ,Zong EX,Zhang LY,Zhang DJ. Analysis of metabolites and metabolic pathways in different varieties of foxtail millets (Setaria italica L.) based on Gas Chromatography-Mass spectrometry[J]. Food Science,2021,42 (24):199−205.
[44] 张丽媛,于英博,赵子莹,于润众,李志江,张东杰. 不同品种绿豆中代谢产物的分离鉴定及代谢机制分析[J]. 食品科学,2021,42(16):169−175. Zhang LY,Yu YB,Zhao ZY,Yu RZ,Li ZJ,Zhang DJ. Separation and identification of metabolites and metabolic mechanism in two cultivars of mung bean[J]. Food Science,2021,42 (16):169−175.
[45] Espichán F,Rojas R,Quispe F,Cabanac G,Marti G. Metabolomic characterization of 5 native Peruvian chili peppers (Capsicum spp. ) as a tool for species discrimination[J]. Food Chem,2022,386:132704. doi: 10.1016/j.foodchem.2022.132704
[46] Chen JY,Wang WT,Kong JQ,Yue YD,Dong YY,et al. Application of UHPLC-Q-TOF MS based untargeted metabolomics reveals variation and correlation amongst different tissues of Eucommia ulmoides Oliver[J]. Microchem J,2022,172:106919. doi: 10.1016/j.microc.2021.106919
[47] Li MX,Liu MY,Wang BY,Shi L. Metabonomics analysis of stem extracts from Dalbergia sissoo[J]. Molecules,2022,27 (6):1982. doi: 10.3390/molecules27061982
[48] 魏海燕. 喀斯特山区不同环境因子对兰科植物分布的影响研究 — 以花江大峡谷为例[J]. 农村经济与科技,2020,31(1):68−70. [49] 贲蓓倍,徐维红,邹德玉,牟美睿,杨仁杰,刘海学. 不同施肥条件下的小麦籽粒代谢组学研究[J]. 麦类作物学报,2021,41(2):212−219. Ben BB,Xu WH,Zou DY,Mou MR,Yang RJ,Liu HX. Study on metabonomics of wheat grain under different fertilization conditions[J]. Journal of Triticeae Crops,2021,41 (2):212−219.
[50] 宋吉玲,周祖法,闫静,陆娜,程俊文,等. 基于UPLC-MS/MS技术的代谢组学方法研究麸皮对杨树桑黄代谢的影响[J]. 菌物学报,2021,40(3):641−655. Song JL,Zhou ZF,Yan J,Lu N,Cheng JW,et al. Study of effects of bran on the metabolism of Sanghuangporus vaninii based on metabolomics of UPLC-MS/MS[J]. Mycosystema,2021,40 (3):641−655.
[51] Liu HJ,Gu HR,Ye C,Guo CW,Zhu YF,et al. Planting density affects Panax notoginseng growth and ginsenoside accumulation by balancing primary and secondary metabolism[J]. Front Plant Sci,2021,12:628294. doi: 10.3389/fpls.2021.628294
[52] 刘龙桀,吴可心,刁云飞,李中跃,穆立蔷. 基于GC-MS分析东北红豆杉野生种与栽培种的代谢差异[J]. 植物研究,2021,41(5):798−806. Liu LJ,Wu KX,Diao YF,Li ZY,Mu LQ. Metabolic differences between wild and cultivated species of Taxus cuspidata based on GC-MS[J]. Bulletin of Botanical Research,2021,41 (5):798−806.
[53] Huang HZ,Tan P,Li MQ,Tan QC,Gao JH,et al. Quality analysis combined with mass spectrometry imaging reveal the difference between wild and cultivated Phyllanthus emblica Linn.: from chemical composition to molecular mechanism[J]. Arabian J Chem,2022,15 (6):103790. doi: 10.1016/j.arabjc.2022.103790
[54] Wu X,Liu Y,Guo JQ,Wang JX,Li MZ,et al. Differentiating Pu-erh raw tea from different geographical origins by 1H-NMR and U-HPLC/Q-TOF-MS combined with chemometrics[J]. J Food Sci,2021,86 (3):779−791. doi: 10.1111/1750-3841.15624
[55] 张舒,王长远,冯玉超,盛亚男,富天昕,等. 气相色谱-质谱联用代谢组学技术分析不同产地稻米代谢物[J]. 食品科学,2021,42(8):206−213. Zhang S,Wang CY,Feng YC,Sheng YN,Fu TX,et al. Analysis of metabolites in rice produced in different regions by GC-MS-based metabonomics[J]. Food Science,2021,42 (8):206−213.
[56] Bi WW,Zhao GX,Zhou YT,Xia XY,Wang JS,et al. Metabonomics analysis of flavonoids in seeds and sprouts of two Chinese soybean cultivars[J]. Sci Rep,2022,12 (1):5541. doi: 10.1038/s41598-022-09408-1
[57] 李富恒,张晓雯,张永芳,于萍,张宏发. 不同发育阶段老山芹种子多组学联合分析[J]. 东北农业大学学报,2021,52(10):32−46. Li FH,Zhang XW,Zhang YF,Yu P,Zhang HF. Integration analysis on multiple omics of Heracleum moellendorffii Hance seeds at different developmental stages[J]. Journal of Northeast Agricultural University,2021,52 (10):32−46.
[58] Wu XY,Wang YL,Tang HR. Quantitative metabonomic analysis reveals the germination associated dynamic and systemic biochemical changes for Mung-Bean (Vigna radiata) seeds[J]. J Proteome Res,2020,19 (6):2457−2470. doi: 10.1021/acs.jproteome.0c00181
[59] 肖金玲,沈蒙,葛云飞,康子悦,王娟,等. 萌发绿豆中多酚类物质动态变化规律及其抗氧化活性的研究[J]. 中国粮油学报,2020,35(7):28−35. Xiao JL,Shen M,Ge YF,Kang ZY,Wang J,et al. Dynamic changes and antioxidant activity of polyphenols in germinated mung bean[J]. Journal of the Chinese Cereals and Oils Association,2020,35 (7):28−35.
[60] Li Y,Wang JH,Wang KT,Lyu S,Ren LY,et al. Comparison analysis of widely-targeted metabolomics revealed the variation of potential astringent ingredients and their dynamic accumulation in the seed coats of both Carya cathayensis and Carya illinoinensis[J]. Food Chem,2022,374:131688. doi: 10.1016/j.foodchem.2021.131688
[61] 潘媛,赵晓,陈大霞. 灰毡毛忍冬花不同发育阶段的转录组学与代谢组学研究[J]. 中国中药杂志,2021,46(11):2798−2805. Pan Y,Zhao X,Chen DX. Different development phase of transcription proteomics and metabolomics of flower of Lonicera macranthoides[J]. China Journal of Chinese Materia Medica,2021,46 (11):2798−2805.
[62] 吴晓婷,张泽超,王红霞,张志华. 不同发育时期核桃内果皮的差异代谢物分析[J]. 河北农业大学学报,2021,44(4):44−50. Wu XT,Zhang ZC,Wang HX,Zhang ZH. Analysis of different metabolites in the endocarp of walnut at different developmental stages[J]. Journal of Hebei Agricultural University,2021,44 (4):44−50.
[63] Lee MY,Seo HS,Singh D,Lee SJ,Lee CH. Unraveling dynamic metabolomes underlying different maturation stages of berries harvested from Panax ginseng[J]. J Ginseng Res,2020,44 (3):413−423. doi: 10.1016/j.jgr.2019.02.002
[64] Liu JG,Liu YQ,Jia M,Kang XD,Wang SM,et al. Association of enriched metabolites profile with the corresponding volatile characteristics induced by rice yellowing process[J]. Food Chem,2021,349:129173. doi: 10.1016/j.foodchem.2021.129173
[65] Pan Y,Zhao X,Wang Y,Tan J,Chen DX. Metabolomics integrated with transcriptomics reveals the distribution of iridoid and crocin metabolic flux in Gardenia jasminoides Ellis[J]. PLoS One,2021,16 (9):e0256802. doi: 10.1371/journal.pone.0256802
-
期刊类型引用(12)
1. 张琦,蒲婷婷,王艺儒,胡银凤,李华威,韩卫娟,索玉静,傅建敏. 不同柿种质果实品质多样性评价. 中国农业大学学报. 2025(02): 61-71 .  百度学术
百度学术
2. 罗赛男,张文. 我国猕猴桃质量安全标准体系现状及建议. 食品安全质量检测学报. 2025(01): 243-249 .  百度学术
百度学术
3. 王宝趁. 不同猕猴桃品种果实品质比较研究. 现代农业科技. 2024(02): 140-143+164 .  百度学术
百度学术
4. 张慧艺,汪丽霞,吴伊静,毕旭灿,王刚,赵四清,徐昌杰,陈昆松. 18份胡柚种质果实品质分析与综合评价. 果树学报. 2024(06): 1033-1043 .  百度学术
百度学术
5. 李艺潇,陈建华,闫芳芳,焦子源,李纪军,马培芳. 韭菜种质资源营养与感官品质评价. 中国瓜菜. 2024(08): 109-116 .  百度学术
百度学术
6. 孔令硕,樊丁宇,靳娟,杨磊,郝庆,田嘉. 灰枣及其芽变品种果实品质评价. 现代农业科技. 2024(16): 119-123+131 .  百度学术
百度学术
7. 傅一凡,王周倩,邱栋梁,黄文俊,钟彩虹. 防雹网对‘东红’猕猴桃果实耐贮性和品质的影响. 植物科学学报. 2024(04): 533-542 .  本站查看
本站查看
8. 黄文俊,王周倩,杨洁,张琦,钟彩虹. 不同干物质含量对金艳猕猴桃果实品质和感官评价的影响. 落叶果树. 2024(05): 20-25 .  百度学术
百度学术
9. 汪梦诗,祁雅楠,赵沁雨,兰天,鲍诗晗,孙翔宇,马婷婷. 五种陕西主栽猕猴桃品种营养品质与香气特征解析. 食品工业科技. 2024(23): 272-281 .  百度学术
百度学术
10. 贺迪,钟彩虹,朱佳慧,潘慧,李文艺,杨洁,黄跃,刘普,李黎. 山梨与中华猕猴桃种间杂交群体的抗病性评价及抗病机制的研究. 果树学报. 2024(11): 2235-2249 .  百度学术
百度学术
11. 唐玉凤,朱世银,蔡荣靖,胡志芳,田虹,张小龙,王世敏,蒙元燕,全勇. 威信县5个主要猕猴桃品种的果实品质比较. 云南农业科技. 2024(05): 1-5 .  百度学术
百度学术
12. 公旭晨,毛积鹏,高磊,林孟飞,卢玉鹏,王小玲,高柱. 6个猕猴桃品种果实发育期品质变化规律分析. 中国南方果树. 2024(06): 216-224+232 .  百度学术
百度学术
其他类型引用(6)
-
其他相关附件
-
DOCX格式
1 王梦迪 附表 1 点击下载(27KB)
-




 下载:
下载: