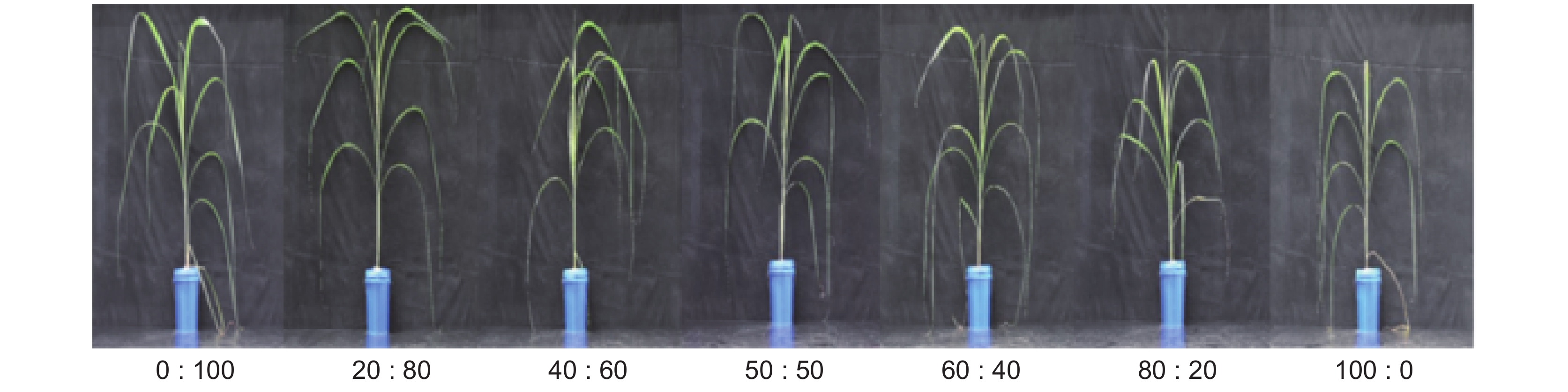
Effects of different ammonium-nitrate ratios on growth and nitrogen assimilation of Saccharum officinarum L. ‘Yunzhe05-51’ at the seedling stage
-
摘要:
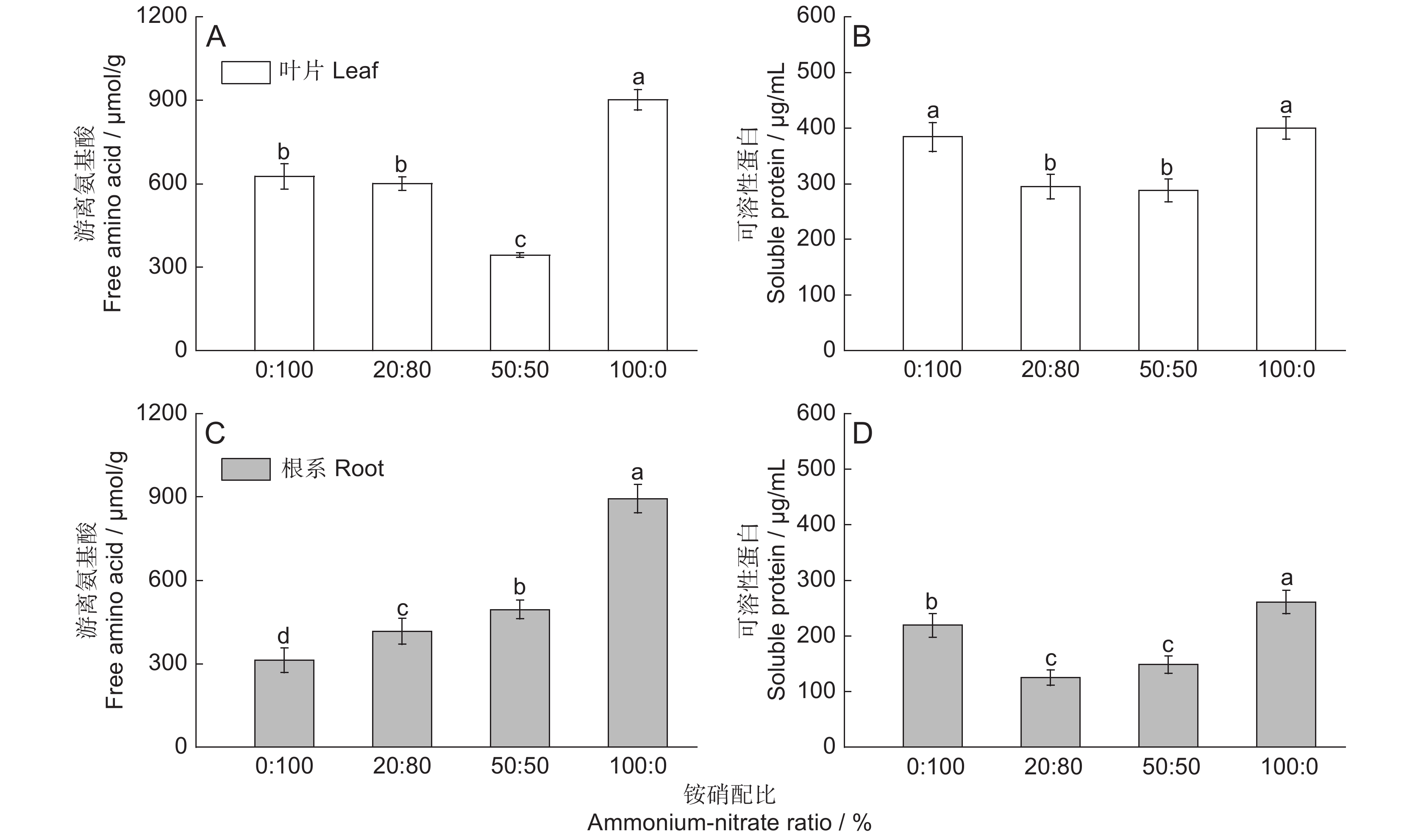
为揭示甘蔗(Saccharum officinarum L.)对氮形态的偏好与其最适铵硝配比,以‘云蔗05-51’为材料开展水培实验,在总供氮水平为10 mmol/L的条件下,设置0∶100、20∶80、40∶60、50∶50、60∶40、80∶20、100∶0共7种铵硝配比处理,分析供氮充足条件下不同铵硝配比处理对甘蔗苗期生长及氮同化利用的影响。结果显示,铵硝配比为20∶80时,甘蔗植株生物量最高,此时根系形态、氮同化关键酶活性最高,氮素的吸收及利用效率也较高。铵硝配比达40∶60时,根系生长开始受限;铵硝配比增加到80∶20时,地上部生长也明显受限。在单独供铵态氮时,植株具有最高的氮含量、单位根长吸氮量、游离氨基酸与可溶性蛋白含量,但氮同化关键酶活性整体较低,氮生理利用效率最低,植株生长和根系形态均为最差。研究结果说明,铵硝同时供应对植株生长和氮同化利用的效果优于单独供硝态氮或铵态氮,本实验条件下‘云蔗05-51’生长所需的适宜铵硝配比为20∶80。
Abstract:The aim of this study was to reveal nitrogen (N) preference and optimal ammonium-nitrate ratio for growth of sugarcane (Saccharum officinarum L.). A hydroponic experiment was conducted with cultivar ‘Yunzhe05-51’ grown under a total N supply of 10 mmol/L, with seven ammonium-nitrate ratios, i.e., 0∶100, 20∶80, 40∶60, 50∶50, 60∶40, 80∶20, and 100∶0. Plant growth and physiological responses in relation to N assimilation were characterized. Results showed that the plant biomass of ‘Yunzhe05-51’ peaked at an ammonium-nitrate ratio of 20∶80. Under this treatment, plants showed the best root morphology, highest N assimilation-related enzyme activity, and relatively higher N uptake and utilization efficiency. Root growth began to display depression when the ammonium-nitrate ratio reached 40∶60, while shoot growth was significantly limited when the ammonium-nitrate ratio increased to 80∶20. Plants under single ammonium supply had the highest levels of N concentration, N uptake per unit root length, free amino acid content, and soluble protein content, but showed lower N assimilation-related enzyme activity and the lowest N utilization efficiency, as well as the most stunted plant growth and root morphology. In conclusion, exploring the combined effects of ammonium and nitrate on plant growth, N assimilation and utilization were better than single administration of either ammonium or nitrate, and the optimal ammonium-nitrate ratio for ‘Yunzhe05-51’ was 20∶80.
-
1. 沉水植物及其重要性
沉水植物是水体生态系统中不可或缺的一部分,在关键界面上扮演着重要角色,对湖泊的生产力和关键生源要素产生显著影响[1],对维持生态系统的结构和功能具有重要作用[2, 3]。氮(N)素对植物的生长和繁殖至关重要[4],植物可以从周围环境中吸收大量的氮素,并利用其进行氨基酸、蛋白质、DNA和其他含氮化合物的生物合成[5]。近年来,营养物质对水域生态系统健康的影响受到人们的广泛关注[6-8]。研究表明,高浓度的氮不仅会改变水域生态系统的结构,还会加速水体从清澈的稳定状态转变为浑浊的稳定状态[5, 7, 9, 10],进而对生态系统的功能产生不利影响。氮是植物生长发育所需的矿质元素,沉水植物能够通过多种方式(如直接吸收、通过构建稳定的植物-微生物自净系统等)有效降低水体的氮浓度,改善水体的营养水平,使湖泊生态系统维持稳定的健康状态[11, 12]。
2. 无机氮
氮对植物的生长发育具有重要作用,在植物生命周期中至关重要[13]。陆生植物不仅能够通过根从土壤中吸收氮,其叶片也具有氮吸收能力[14]。但由于大气中的氮主要以N2分子的形式存在,氮原子间的共价键具有较高的键能,很难被破坏[15]。自然界中只有部分微生物(如固氮微生物)和大气放电作用才能将空气中的氮气转化为植物可利用的氮[13, 15]。因此,传统观念认为陆生植物主要通过根部从土壤中吸收氮,氮进入植物细胞后,一部分被运输到地上部进行生物合成,剩余部分直接在根部被合成小分子氨基酸或储存在液泡中[16]。
硝态氮(NO3−-N)是环境中无机氮的主要形态之一,由于其很难与土壤形成表面复合物,因此在环境中容易流失[17]。土壤中的NO3−-N浓度波动较大,为了适应其浓度变化,植物形成了两种转运吸收系统:高亲和力转运系统(HATS)和低亲和力转运系统(LATS)[18]。NO3−-N在两种转运系统的作用下通过主动运输进入植物体,其中一部分会在细胞质中被还原,并同化为氨基酸,而另一部分可储备在细胞的液泡中[19]。根系吸收的氮素可通过木质部在蒸腾作用的拉力下向上运输,然后在地上部分的细胞中通过各种方式被植物同化[20]。
与NO3−-N相比,环境中的铵态氮(NH4+-N)更容易被植物吸收。植物吸收的NO3−-N可在酶促反应下还原为NH4+-N,植物也可以直接从环境中吸收NH4+-N,在此基础上进行同化等生理过程。因此,在植物体中,NH4+-N的同化比NO3−-N更加节能[20, 21]。然而,NH4+-N是一把双刃剑,其在低浓度时能促进植物的正常生理代谢,有效提高植物的生长繁殖能力。但当其浓度过高时,也会对植物产生严重的胁迫作用[22],且NH4+-N对植物的胁迫效应和毒性高于NO3−-N [8, 23, 24]。
3. 沉水植物对无机氮的吸收与运输
对于无机氮的吸收与运输,在陆生植物中的研究已经深入到分子机理层面。研究表明,对于NO3−-N的吸收与运输,目前在拟南芥(Arabidopsis thaliana (L.) Heynh.)中已发现NRT1和NRT2两大基因家族[19, 20, 23]。当环境中的NO3−处于较高浓度时,植物体内氮的吸收及运输主要受NRT1基因家族的主导,通过对LATS的调控,降低对环境中氮的吸收,以避免高氮对植物的抑制作用。研究表明,NRT1.1不仅参与植物对环境中NO3−-N吸收转运的调控,还能调控气孔的开放[21]、种子的休眠[25]、生长素的分泌[26]等代谢过程。与NRT1不同的是,NRT2的表达不受NO3−-N的诱导,当环境中NO3−的浓度较低,植物处于缺氮条件时,NRT2家族主要对HATS进行调控。在拟南芥中,NRT2.1和NRT2.2在HATS中起主要作用[27]。NRT2.4的表达受NO3−-N浓度的调控,对NO3−-N的响应浓度较广。当环境中NO3−-N不足时,植物NRT2.4在根及嫩枝中均能起到NO3−-N的转运作用[28]。
尽管环境中铵态氮的浓度通常低于硝态氮,但植物更偏向于吸收铵态氮 [21, 29]。为了进入植物细胞,植物根部的铵态氮需要依靠细胞膜上的特异性转运蛋白[30]。研究发现,当环境中NH4+-N的浓度低于0.5 mmol/L时,植物主要通过HATS进行铵的吸收和转运;当浓度超过0.5 mmol/L时,植物则改变策略,通过LATS对铵进行吸收及转运[31]。在拟南芥中发现,AMT1.1、AMT1.2、AMT1.3等基因主要负责根部NH4+-N的吸收[32, 33]。其中,AMT1.2在根部皮质层和内皮层中高表达,而AMT1.3主要在表皮层和皮质层中大量表达[32, 34]。AMT1.3的表达与外界NH4+-N的浓度密切相关[35],且受光照强度的影响,因此被认为参与植物C-N平衡的调节[35]。此外,在毛果杨(Populus trichocarpa Torr. & A. Gray ex Hook)和水稻(Oryza sativa L.)的基因组中分别发现14个和10个AMT相关基因[36, 37]。NH4+-N的吸收受多个AMT基因的协同调控,且这种调控受植物自身及其生存环境的影响[4]。沉水植物作为湖泊生态系统中重要的生物类群,不仅是湖泊生态系统多样性的基础,也是其健康运转的关键,在决定水生态系统的健康和功能上具有重要作用[34, 38, 39]。
关于沉水植物对氮的吸收,现有报道多从吸收动力学的角度展开研究。Xiong[40]发现伊乐藻(Elodea nuttallii Michx.)和苦草(Vallisneria natans (Lour.) H. Hara)对氮的吸收与水体中的磷浓度密切相关,随磷浓度的增加,两种沉水植物对NH4+-N和NO3−-N的最大吸收速率均呈下降趋势,但对NH4+-N吸收的Km值均呈上升趋势;两种植物对NO3−-N吸收的Km值趋势相反,在伊乐藻中为下降趋势,而在苦草中则呈上升趋势。Olesen等[41]研究了4种沉水植物(穿叶眼子菜(Potamogeton perfoliatus L.)、钝叶眼子菜(P. obtusifolius Mert. & W. D. J. Koch)、加拿大伊乐藻(E. canadensis Michx.)和小水毛茛(Ranunculus aquatilis L.))对不同氮素的吸收动力学。结果发现,钝叶眼子菜的Vmax最大,穿叶眼子菜和加拿大伊乐藻的较低。对苦草和黑藻(Hydrilla verticillata (L. f.) Royle)铵态氮吸收动力学的研究发现,苦草对铵态氮具有更高的吸收效率[42]。研究表明,吸收效率与外界水环境浓度密切相关,当NH4+-N的浓度为3 mg/L左右时,圆叶节节菜(Rotala rotundifolia (Buch.-Ham. ex Roxb.) Koehne)对其具有最高的吸收效率[43]。然而,也有研究指出,沉水植物对铵态氮的吸收速率随外界NH4+-N浓度的升高呈先上升后下降的趋势[44]。
目前,对沉水植物氮吸收的研究主要集中在吸收动力学,少量报道开始利用转录组分析从分子水平对其调控机理开展探讨。沉水植物通过铵转运蛋白家族(AMTs)实现水体铵态氮的吸收和转运,在NH4+-N浓度较低的环境条件下,粉绿狐尾藻(Myriophyllum aquaticum (Vell.) Verdc.)编码铵转运蛋白的基因AMT1.2和AMT3.1的表达显著上调,而当环境中NH4+-N的浓度增加时,基因的表达显著下调[45]。
沉水植物既可以通过根部从环境中吸收氮,也可以通过叶片等部位直接吸收水体中游离的氮。而陆生植物所需要的氮源主要通过根部的吸收、转运和同化[14],叶片仅能通过固氮菌实现极少量的氮固定,叶片中的氮主要来自根的向上运输过程。因此,沉水植物与陆生植物的叶片在氮的利用上可能存在显著差异,且氮在沉水植物体内的运输也可能与陆生植物不同[46]。陆生植物通常以自下而上的单向运输为主,当根部接收到高浓度氮源时,可以通过低亲和力转运系统减少根部对外源氮的吸收,或者将根部吸收的氮转移至地上部分,以降低高浓度氮对植物根系的毒害作用。当处于氮限制环境条件时,可以通过高亲和力转运系统增加根部氮的吸收,并向上运输,以满足地上部分的氮需求[47, 48]。沉水植物由于地下和地上部分均能获取环境中的氮[49-51],为了适应水环境中氮含量的变化,其对氮的运输存在向上及向下的双向运输。为了减轻高浓度氮对自身的毒害,沉水植物对氮的利用在地上部分(叶等器官)和地下部分(根或根茎)存在一定的权衡关系。我们近期的研究表明,沉水植物对外源铵的转运存在明显的双向运输(图1)。当环境中的氮含量受限时,沉水植物主要通过地下部分从沉积物中吸收氮,并向上运输至地上部分;而当环境中的铵浓度过高时,沉水植物的双向运输依然存在,其地上部分能够通过迅速的氮合成显著降低植物体中游离氮的积累,从而避免毒害作用的产生[42]。
![]() 图 1 沉水植物在不同铵氮浓度条件下的吸收及运输过程(改自Xian等[46])箭头宽度代表植物地上及地下部分对外源铵态氮吸收及转运相对量的大小。GS:谷氨酰胺合成酶,GDH:谷氨酸脱氢酶,Glu:谷氨酸,Gln:谷氨酰胺。红色代谢途径为当前环境条件下植物铵同化的主要途径。Figure 1. Ammonium uptake and transportation in submerged plants under different ammonium concentrations (modified from Xian et al.[46])Arrow width represents relative amount of external ammonium uptake and transport by aboveground and underground parts of submerged macrophytes. GS: glutamine synthetase, GDH: glutamate dehydrogenase, Glu: glutamate, Gln: glutamine. Red metabolic pathways indicate primary route for ammonium assimilation under current environmental conditions.
图 1 沉水植物在不同铵氮浓度条件下的吸收及运输过程(改自Xian等[46])箭头宽度代表植物地上及地下部分对外源铵态氮吸收及转运相对量的大小。GS:谷氨酰胺合成酶,GDH:谷氨酸脱氢酶,Glu:谷氨酸,Gln:谷氨酰胺。红色代谢途径为当前环境条件下植物铵同化的主要途径。Figure 1. Ammonium uptake and transportation in submerged plants under different ammonium concentrations (modified from Xian et al.[46])Arrow width represents relative amount of external ammonium uptake and transport by aboveground and underground parts of submerged macrophytes. GS: glutamine synthetase, GDH: glutamate dehydrogenase, Glu: glutamate, Gln: glutamine. Red metabolic pathways indicate primary route for ammonium assimilation under current environmental conditions.4. 沉水植物对无机氮的同化
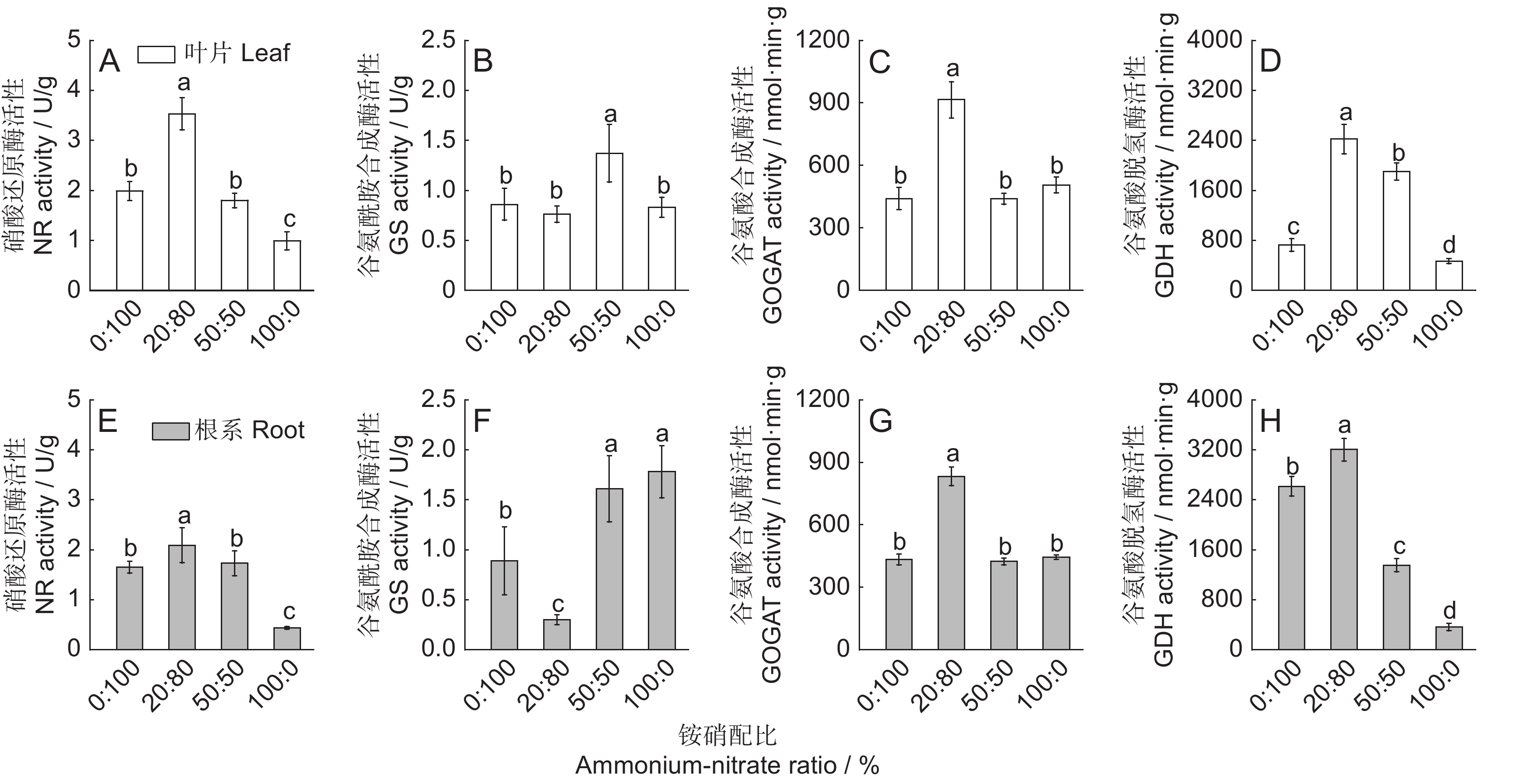
植物氮同化是合成含氮有机化合物的关键步骤,一般而言,该步骤涉及多种酶的参与,包括硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)和谷氨酸脱氢酶(GDH)等。植物吸收硝态氮后,一部分储存在木质部,或者芽和根等器官的液泡中;另一部分在细胞质中被NR还原为NO2–,后者被植物细胞迅速运输至质体中还原,最终以NH4+的形式被植物同化[33, 52]。植物体内的NH4+-N主要通过GS-GOGAT(GS/GOGAT循环途径)被同化(图2)。其中,GS对NH4+有较高的亲和力,作为氮代谢过程的关键酶,能够将铵转化为谷氨酰胺,后者在GOGAT的作用下结合一分子的谷氨酸,与α-酮戊二酸(2-OG)结合,产生两分子的谷氨酸[53-55]。植物体中的GOGAT有两种亚型:Fd-GOGAT和NADH-GOGAT,前者主要从还原性铁中获取电子[56],而后者则主要依赖呼吸作用产生的NADH提供电子[57]。除了GS-GOGAT循环, GDH催化的代谢途径也被认为是植物铵同化的一条途径。GDH在植物体内广泛存在,是一种分子量为208~300 kDa的蛋白质[58],通常形成六聚体[59]。它能催化NH4+和α-酮戊二酸结合生成谷氨酸,同时也能催化谷氨酸的分解(图2)。在高等植物中,GDH分为两种类型:以NADPH为电子供体的NADPH-GDH存在于叶绿体中,而以NADH为电子供体的NADH-GDH则存在于线粒体中[59]。尽管早期研究普遍认为GDH催化的代谢途径是植物进行铵同化的主要途径,但到了1976年,由于GOGAT的发现,GS-GOGAT循环才被认为是高等植物同化铵的主要途径[60]。目前,通过对GS-GOGAT循环和GDH途径的深入探讨,研究者更深入地比较了植物中铵同化途经的特征。如,在铵胁迫条件下,黄瓜(Cucumis sativus L.)叶片主要通过GS-GOGAT循环途经同化铵,而根部则主要通过GDH途经来同化[61]
![]() 图 2 植物无机氮同化路径GS:谷氨酰胺合成酶;GDH:谷氨酸脱氢酶;GOGAT:谷氨酸合成酶;Glu:谷氨酸;Gln:谷氨酰胺;2-OG:α-酮戊二酸。红色和黑色分别代表两条无机氮同化途径:黑色为GS/GOGAT循环途径,红色为GDH途径。Figure 2. Inorganic nitrogen assimilation pathways in plantsGS: Glutamine synthetase; GDH: Glutamate dehydrogenase; GOGAT: Glutamate synthase; Glu: Glutamate; Gln: Glutamine; 2-OG: α-ketoglutarate. Red and black represent two pathways to inorganic nitrogen assimilation: black denotes GS/GOGAT cycle pathway, red denotes GDH pathway.
图 2 植物无机氮同化路径GS:谷氨酰胺合成酶;GDH:谷氨酸脱氢酶;GOGAT:谷氨酸合成酶;Glu:谷氨酸;Gln:谷氨酰胺;2-OG:α-酮戊二酸。红色和黑色分别代表两条无机氮同化途径:黑色为GS/GOGAT循环途径,红色为GDH途径。Figure 2. Inorganic nitrogen assimilation pathways in plantsGS: Glutamine synthetase; GDH: Glutamate dehydrogenase; GOGAT: Glutamate synthase; Glu: Glutamate; Gln: Glutamine; 2-OG: α-ketoglutarate. Red and black represent two pathways to inorganic nitrogen assimilation: black denotes GS/GOGAT cycle pathway, red denotes GDH pathway.对于沉水植物而言,由于水体中的无机氮主要以NO3−-N和NH4+-N的形式存在,植物更倾向于利用NH4+-N,因为消耗的能量更少[62, 63]。沉水植物的氮同化过程与陆生植物类似,但在同化部位、同化路径的选择等方面有较大差异。由于直接受水体氮浓度波动的影响,沉水植物主要通过叶片进行氮素的同化和利用[42]。从环境中吸收氮后,沉水植物通常会将其合成含氮有机物储存在体内,以避免氮在体内积累导致的毒害[64, 65]。目前,相对于陆生植物,对沉水植物氮同化的机制研究还不够深入,其氮同化途径的特征仍不明确。仅有少量报道比较了胁迫条件下水生植物铵同化过程中关键酶的活性。譬如,水体中NH4+-N的浓度和pH值显著影响金鱼藻(Ceratophyllum demersum L.)GS的活性,在pH值为9的溶液中,GS活性显著下降;同样,在高浓度NH4+-N条件下,GS活性随着胁迫时间的增加也呈显著下降趋势[66]。粉绿狐尾藻也表现出类似的趋势,当环境中NH4+-N浓度过高时,其叶片中GS的活性被显著抑制,但当NH4+-N浓度为120 mg/L时,叶片中NR的活性迅速上升[67]。转录组分析发现,随着水体NH4+-N浓度的升高,粉绿狐尾藻叶片中编码GS的关键基因的表达量显著下降,而多个GDH和GOGAT的编码基因的表达则显著上调[61]。
最近研究发现,沉水植物对铵的同化特征受物种及生长时期的影响。在高浓度铵态氮条件下,铵耐受型物种穗花狐尾藻(M. spicatum L.)主要通过GDH途径进行铵的同化作用[46, 68],而铵敏感型物种光叶眼子菜(P. lucen L.)主要通过GS-GOGAT途径对铵进行同化(图3:A、B)[69]。针对同一物种不同生长时期的研究发现,沉水植物幼叶主要通过GDH途径同化水体中的铵态氮,而成熟叶在正常浓度条件下主要通过GS-GOGAT途径实现铵态氮的同化(图3:C、D)[69]。此外,比较转录组分析结果进一步表明,沉水植物光叶眼子菜谷氨酸脱氢酶基因GDH2在不同浓度铵态氮条件下的表达量存在显著差异。
![]() A:高浓度铵态氮条件下,耐受型物种穗花狐尾藻铵同化以GDH途径为主导;B:敏感型物种光叶眼子菜铵同化以GS/GOGAT途径为主导; C:光叶眼子菜幼叶主要通过GDH途径进行铵的同化;D:成熟叶主要通过GS/GOGAT循环进行铵的同化。缩写同图2。Figure 3. Inorganic nitrogen assimilation pathways in submerged macrophytes with different adaptive capacities and developmental stages (modified from Xian et al.[46, 68] and Ochieng et al.[69])A: Ammonium assimilation in ammonium-tolerant species M. spicatum is dominated by GDH pathway under high ammonium concentration. B: Ammonium assimilation in ammonium-sensitive species P. lucens is dominated by GS/GOGAT pathway. C: In young leaves of P. lucens, ammonium assimilation is primarily mediated through the GDH pathway. D: In mature leaves of P. lucens, ammonium assimilation is mainly mediated through the GS/GOGAT cycle. Abbreviations are as in Fig. 2.
A:高浓度铵态氮条件下,耐受型物种穗花狐尾藻铵同化以GDH途径为主导;B:敏感型物种光叶眼子菜铵同化以GS/GOGAT途径为主导; C:光叶眼子菜幼叶主要通过GDH途径进行铵的同化;D:成熟叶主要通过GS/GOGAT循环进行铵的同化。缩写同图2。Figure 3. Inorganic nitrogen assimilation pathways in submerged macrophytes with different adaptive capacities and developmental stages (modified from Xian et al.[46, 68] and Ochieng et al.[69])A: Ammonium assimilation in ammonium-tolerant species M. spicatum is dominated by GDH pathway under high ammonium concentration. B: Ammonium assimilation in ammonium-sensitive species P. lucens is dominated by GS/GOGAT pathway. C: In young leaves of P. lucens, ammonium assimilation is primarily mediated through the GDH pathway. D: In mature leaves of P. lucens, ammonium assimilation is mainly mediated through the GS/GOGAT cycle. Abbreviations are as in Fig. 2.5. 展望
近年来,尽管沉水植物氮的吸收与利用受到了广泛关注,但仍需在不同物种(广度)及不同研究层次(深度)上开展细致的研究。
沉水植物的叶片能够利用水体的无机氮,并在细胞内通过一系列酶促反应最终形成谷氨酰胺和谷氨酸。我们近期通过代谢通路关联性分析发现,产生的谷氨酸能够在植物体内参与多种代谢过程,进而被植物高效利用,在众多代谢通路中,关系最紧密的是植物的光合碳同化(图4):(1)沉水植物铵同化过程中产生的谷氨酰胺能与α-酮戊二酸结合,在谷氨酸合成酶的催化作用下生成谷氨酸;(2)谷氨酸脱氢酶能够直接催化2-OG与铵结合,并生成谷氨酸;(3)谷氨酸和草酰乙酸(OAA)能够在谷草转氨酶(GOT)的作用下生成天冬氨酸和α-酮戊二酸。在此过程中,沉水植物主要通过α-酮戊二酸和草酰乙酸将碳氮代谢进行关联。然而,在不同氮素浓度条件下,沉水植物通过何种途径实现2-OG 和OAA在碳氮联合利用过程中的调控还不清楚,相关机制还需要深入研究和发掘。
尽管对沉水植物氮的吸收、运输和同化过程等方面开展了相关探讨,但研究深度还远远不够。目前仅在生理响应层面,通过酶活性的变化,揭示了无机氮同化中的关键代谢途径[68, 69],但对这些关键酶的活性及其基因表达的调控方式还缺乏相应研究,目前仅有少量报道从转录组层面进行了分析[70]。研究难以深入的原因主要是沉水植物尚未构建成熟的遗传转化系统,且缺乏模式植物。此外,尽管沉水植物的基因组总体较小,但仅有少量物种的全基因组序列被发表[20]。因此,还需进一步探索研究方法,构建合适的遗传转化体系,同时采取最新的基因编辑等分子技术,从而实现对沉水植物功能基因的验证,以及对关键蛋白质结构和功能的深入研究。
-
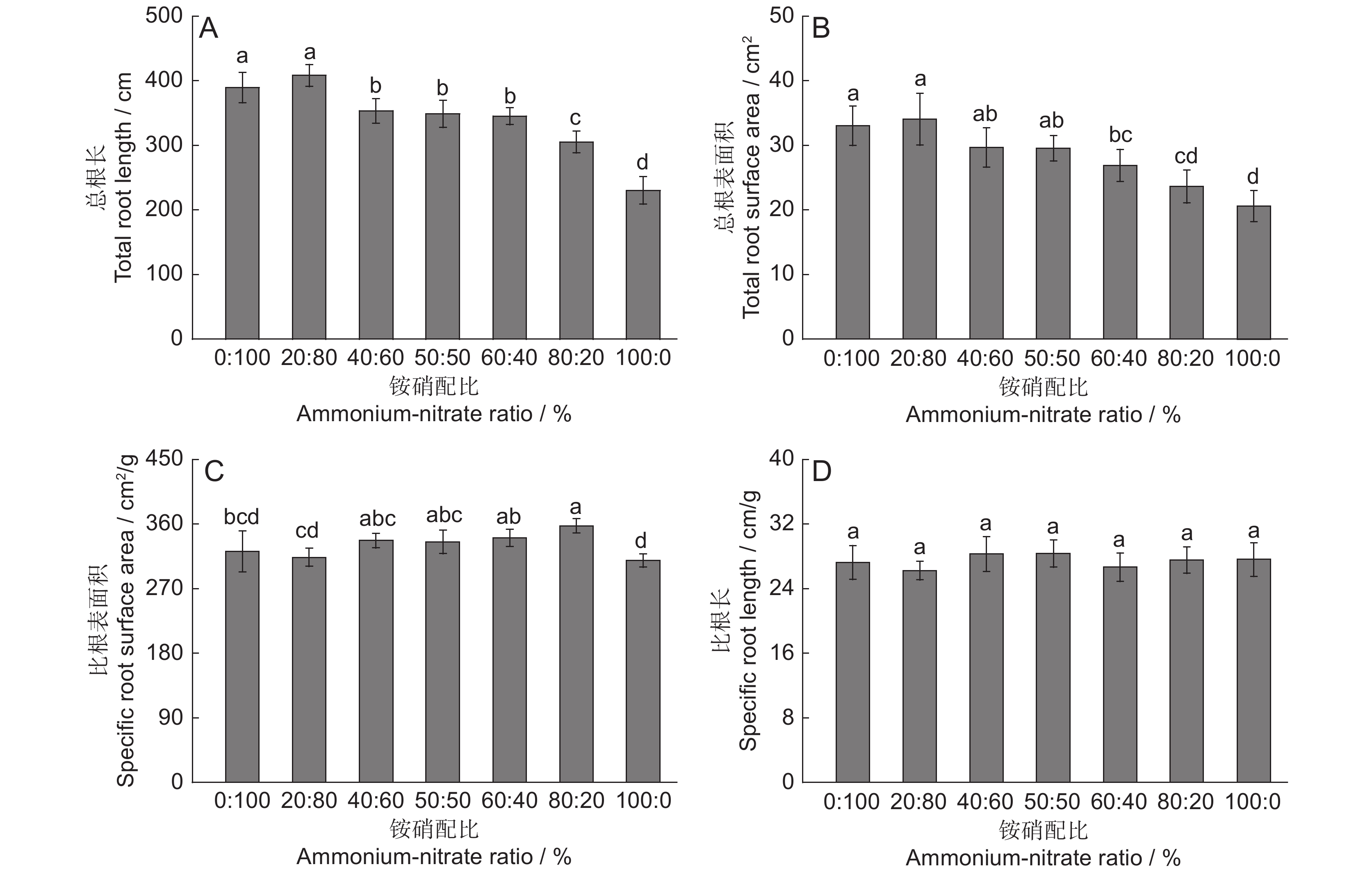
图 2 不同铵硝配比下‘云蔗05-51’的总根长(A)、总根表面积(B)、比根表面积(C)和比根长(D)
误差线为标准差;不同小写字母表示处理间差异显著(P < 0.05)。下同。
Figure 2. Total root length (A), total root surface area (B), specific root surface area (C), and specific root length (D) of ‘Yunzhe05-51’ under different ammonium-nitrate ratios
Error line represents standard deviation. Different lowercase letters indicate significant differences between treatments (P < 0.05). Same below.
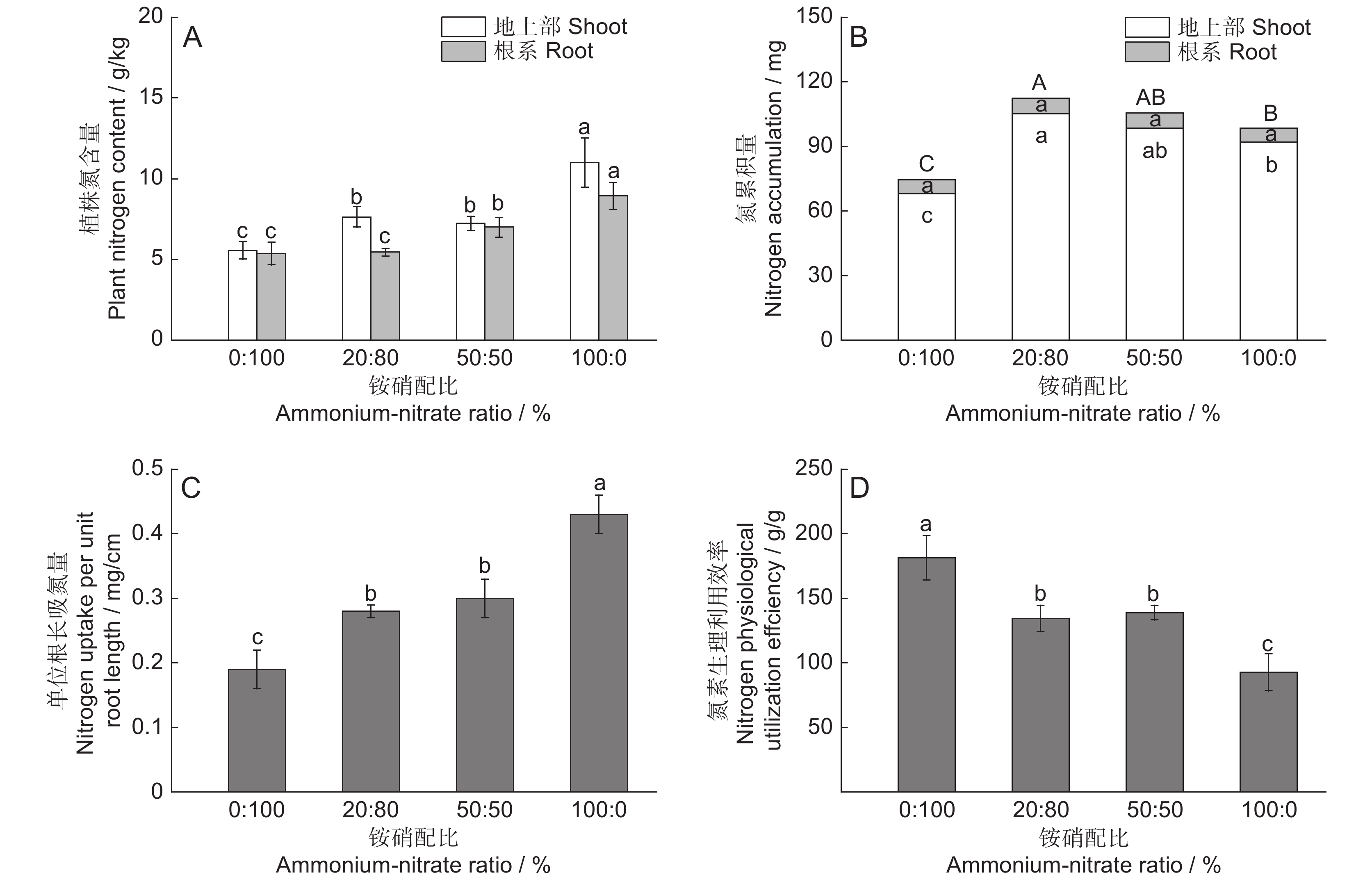
图 3 不同铵硝配比下‘云蔗05-51’植株氮含量(A)、氮累积量(B)、单位根长吸氮量(C)和氮素生理利用效率(D)
不同小写或大写字母表示处理间差异显著(P < 0.05)。
Figure 3. Plant N content (A), N accumulation (B), N uptake per unit root length (C), and N physiological utilization efficiency (D) of ‘Yunzhe05-51’ under different ammonium-nitrate ratios
Different lowercase/capital letters indicate significant differences between treatments (P < 0.05).
表 1 不同铵硝配比的营养液养分浓度
Table 1 Nutrient concentrations under different ammonium-nitrate ratios
营养液浓度
Nutrient solution content / mmol/L铵硝配比 Ammonium-nitrate ratio / % 0∶100 20∶80 40∶60 50∶50 60∶40 80∶20 100∶0 (NH4)2SO4 0 1 2 2.5 3 4 5 Ca(NO3)2·4H2O 5 4 3 2.5 2 1 0 CaCl2 0 1 2 2.5 3 4 5 KCl 5 5 5 5 5 5 5 MgSO4·7H2O 2 2 2 2 2 2 2 KH2PO4 + K2HPO4 1 1 1 1 1 1 1 MnSO4·H2O 0.01 0.01 0.01 0.01 0.01 0.01 0.01 H3BO3 0.01 0.01 0.01 0.01 0.01 0.01 0.01 CuSO4·5H2O 0.001 0.001 0.001 0.001 0.001 0.001 0.001 ZnSO4·7H2O 0.002 5 0.002 5 0.002 5 0.002 5 0.002 5 0.002 5 0.002 5 Na2MoO4 0.000 35 0.000 35 0.000 35 0.000 35 0.000 35 0.000 35 0.000 35 EDTA-Fe 0.2 0.2 0.2 0.2 0.2 0.2 0.2 DCD 0.007 0.007 0.007 0.007 0.007 0.007 0.007 表 2 不同铵硝配比下‘云蔗05-51’的生物量
Table 2 Biomass of ‘Yunzhe05-51’ under different ammonium-nitrate ratios
铵硝配比
Ammonium-
nitrate ratio /
%地上部鲜重
Shoot
fresh weight /
g根系鲜重
Root
fresh weight /
g整株鲜重
Whole plant
fresh weight /
g地上部干重
Shoot
dry weight /
g根系干重
Root
dry weight /
g整株干重
Whole plant
dry weight /
g根冠比
Root-shoot
ratio0∶100 83.84 ± 9.88b 19.85 ± 2.81ab 103.68 ± 12.59bc 12.18 ± .22ab 1.24 ± 0.20a 13.42 ± 1.40ab 0.10 ± 0.01a 20∶80 104.93 ± 3.49a 22.12 ± 2.19a 127.04 ± 15.13a 13.80 ± 1.20a 1.31 ± 0.09a 15.10 ± 1.28a 0.09 ± 0.01a 40∶60 94.37 ± 9.26a 18.16 ± 2.39bc 112.53 ± 10.41b 13.60 ± 1.64a 1.06 ± 0.09b 14.65 ± 1.69a 0.08 ± 0.01b 50∶50 97.37 ± 5.36a 17.55 ± 2.86bc 114.92 ± 8.05b 13.60 ± 1.32a 1.05 ± 0.10bc 14.65 ± 0.35a 0.08 ± 0.01b 60∶40 98.93 ± 4.95a 16.63 ± 1.92bc 115.56 ± 3.76b 13.40 ± 1.90a 1.03 ± 0.14bc 14.42 ± 0.96a 0.08 ± 0.01b 80∶20 83.94 ± 6.63b 15.30 ± 2.75cd 99.24 ± 8.24c 11.68 ± 1.10b 0.86 ± 0.09cd 12.54 ± 1.17b 0.07 ± 0.01b 100∶0 57.52 ± 3.51c 12.82 ± 2.12d 70.34 ± 3.88d 8.31 ± 0.74c 0.75 ± 0.09d 9.06 ± 0.74c 0.09 ± 0.01a 注:数据表示为平均值 ± SD(n = 4);同列不同小写字母表示处理间差异显著(P < 0.05)。下同。 Notes: Data are presented as means ± SD (n = 4); Different lowercase letters in the same column indicate significant differences between treatments (P < 0.05). Same below. 表 3 不同铵硝配比下‘云蔗05-51’根直径及不同等级下的根系长度
Table 3 Root diameter and root length in different diameter ranges of ‘Yunzhe05-51’ under different ammonium-nitrate ratios
铵硝配比
Ammonium-
nitrate ratio / %根平均直径
Average root
diameter / mm≤ 0.5 mm直径总根长
Total root length in diameter
range of ≤ 0.5 mm / cm>0.5 mm直径总根长
Total root length in diameter
range of >0.5 mm / cm0∶100 0.57 ± 0.13a 217.84 ± 10.12a 171.81 ± 11.23b 20∶80 0.56 ± 0.10a 216.68 ± 13.15a 191.73 ± 10.31a 40∶60 0.42 ± 0.10b 204.02 ± 10.63a 149.52 ± 11.96c 50∶50 0.33 ± 0.08bc 208.82 ± 17.03a 140.20 ± 10.01c 60∶40 0.29 ± 0.03c 213.49 ± 13.97a 131.51 ± 11.65c 80∶20 0.24 ± 0.02c 207.47 ± 10.65a 97.95 ± 7.69d 100∶0 0.20 ± 0.01c 163.15 ± 12.71b 66.99 ± 8.91e -
[1] 杨云川,张会娅,程禹灏,廖丽萍,杨家祯,等. 基于DSSAT-Canegro模型的广西来宾市甘蔗生长对气象干旱的响应[J]. 农业工程学报,2022,38(2):119−130. Yang YC,Zhang HY,Cheng YH,Liao LP,Yang JZ,et al. Effects of meteorological drought on sugarcane growth using DSSAT-Canegro model in Laibin,Guangxi of China[J]. Transactions of the Chinese Society of Agricultural Engineering,2022,38 (2):119−130.
[2] 许霞,苟永刚,罗莎莎,王宇姝,余玲玲,王建武. 减量施氮对甘蔗-大豆间作系统产量稳定性的影响[J]. 热带作物学报,2020,41(7):1354−1365. Xu X,Gou YG,Luo SS,Wang YS,Yu LL,Wang JW. Effect of nitrogen reduction on yield stability of sugarcane-soybean intercropping system[J]. Chinese Journal of Tropical Crops,2020,41 (7):1354−1365.
[3] Hajari E,Snyman SJ,Watt MP. The effect of form and level of inorganic N on nitrogen use efficiency of sugarcane grown in pots[J]. J Plant Nutr,2017,40 (2):248−257. doi: 10.1080/01904167.2016.1237648
[4] 李进,段婷婷,邓凯,景占鑫,蔺中,等. 不同品种甘蔗生长对氮肥的响应与利用[J]. 热带作物学报,2019,40(4):649−656. Li J,Duan TT,Deng K,Jing ZX,Lin Z,et al. Responses of sugarcane varieties growth to nitrogen fertilizer application and related use efficiency[J]. Chinese Journal of Tropical Crops,2019,40 (4):649−656.
[5] 宗桦. 中澳甘蔗产业中氮肥利用率(FNUE)的研究现状与比较分析[J]. 世界农业,2017(1):185−193. [6] 王继华,商贺阳,杨少海. 我国甘蔗养分高效利用的研究进展[J]. 中国糖料,2018,40(6):66−68,72. Wang JH,Shang HY,Yang SH. Research progress on nutrient efficient utilization of sugarcane in China[J]. Sugar Crops of China,2018,40 (6):66−68,72.
[7] 唐伟杰,官春云,林良斌,李丽萍,张振华,等. 不同硝铵比对油菜生长、生理与产量的影响[J]. 植物营养与肥料学报,2018,24(5):1338−1348. Tang WJ,Guan CY,Lin LB,Li LP,Zhang ZH,et al. Effects of nitrate and ammonium supply ratios on growth,physiology and yield of oilseed rape (Brassica napus L. )[J]. Plant Nutrition and Fertilizer Science,2018,24 (5):1338−1348.
[8] Li SX,Wang ZH,Stewart BA. Responses of crop plants to ammonium and nitrate N[J]. Adv Agron,2013,118:205−397.
[9] 程谊,张金波,蔡祖聪. 气候-土壤-作物之间氮形态契合在氮肥管理中的关键作用[J]. 土壤学报,2019,56(3):507−515. Cheng Y,Zhang JB,Cai ZC. Key role of matching of crop-specific N preference,soil N transformation and climate conditions in soil N nutrient management[J]. Acta Pedologica Sinica,2019,56 (3):507−515.
[10] Che J,Zhao XQ,Zhou X,Jia ZJ,Shen RF. High pH-enhanced soil nitrification was associated with ammonia-oxidizing bacteria rather than archaea in acidic soils[J]. Appl Soil Ecol,2015,85:21−29. doi: 10.1016/j.apsoil.2014.09.003
[11] Robinson N,Brackin R,Vinall K,Soper F,Holst J,et al. Nitrate paradigm does not hold up for sugarcane[J]. PLoS One,2011,6:e19045. doi: 10.1371/journal.pone.0019045
[12] Boschiero BN,Mariano E,Azevedo RA,Trivelin PCO. Influence of nitrate-ammonium ratio on the growth,nutrition,and metabolism of sugarcane[J]. Plant Physiol Biochem,2019,139:246−255. doi: 10.1016/j.plaphy.2019.03.024
[13] Pissolato MD,Silveira NM,Machado EC,Zambrosi FCB,Sodek L,Ribeiro RV. Photosynthesis and biomass accumulation in young sugarcane plants grown under increasing ammonium supply in nutrient solution[J]. Theor Exp Plant Physiol,2019,31 (3):401−411. doi: 10.1007/s40626-019-00154-w
[14] Hajari E,Snyman SJ,Watt MP. Nitrogen use efficiency of sugarcane (Saccharum spp. ) varieties under in vitro conditions with varied N supply[J]. Plant Cell Tiss Org Cult,2015,122 (1):21−29. doi: 10.1007/s11240-015-0746-y
[15] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 264−267. [16] De Armas R,Valadier MH,Champigny ML,Lamaze T. Influence of ammonium and nitrate on the growth and photosynthesis of sugarcane[J]. J Plant Physiol,1992,140 (5):531−535. doi: 10.1016/S0176-1617(11)80783-2
[17] 韩庆芬,陈海飞,张振华. 不同生态型拟南芥耐铵毒害差异的生理机制[J]. 植物营养与肥料学报,2019,25(7):1185−1193. Han QF,Chen HF,Zhang ZH. Physiological mechanisms of tolerance to ammonium toxicity in different ecotypes of Arabidopsis thaliana[J]. Plant Nutrition and Fertilizer Science,2019,25 (7):1185−1193.
[18] Brackin R,Näsholm T,Robinson N,Guillou S,Vinall K,et al. Nitrogen fluxes at the root-soil interface show a mismatch of nitrogen fertilizer supply and sugarcane root uptake capacity[J]. Sci Rep,2015,5:15727. doi: 10.1038/srep15727
[19] Boschiero BN,Mariano E,Trivelin PCO. “Preferential” ammonium uptake by sugarcane does not increase the 15N recovery of fertilizer sources[J]. Plant Soil,2018,429 (1):253−269.
[20] 宋文静,宋科,董建新,李永亮,况帅,等. 铵硝混合营养对烟草苗期氮代谢酶及内源生长素的影响[J]. 江苏农业科学,2019,47(8):100−104. doi: 10.15889/j.issn.1002-1302.2019.08.023 [21] 屈亚潭,高欣,冯晓东. 不同铵硝配比对番茄苗期生长和光合特性的影响[J]. 延安大学学报(自然科学版),2021,40(3):16−20. Qu YT,Gao X,Feng XD. Effects of different ammonium-nitrate ratios on growth and photosynthesis of tomato seedlings[J]. Journal of Yan’an University (Natural Science Edition)
,2021,40 (3):16−20. [22] Van Bueren LET,Struik PC. Diverse concepts of breeding for nitrogen use efficiency[J]. Agron Sustain Dev,2017,37 (5):50. doi: 10.1007/s13593-017-0457-3
[23] Ortigosa F,Valderrama-Martín JM,Urbano-Gámez JA,García-Martín ML,Ávila C,et al. Inorganic nitrogen form determines nutrient allocation and metabolic responses in Maritime Pine seedlings[J]. Plants (Basel)
,2020,9 (4):481. doi: 10.3390/plants9040481 [24] 孙敏红,吴炼,谢深喜. 铵硝营养对枳橙幼苗谷氨酰胺合成酶活性及相关基因表达的影响[J]. 植物生理学报,2018,54(11):1703−1710. doi: 10.13592/j.cnki.ppj.2018.0232 Sun MH,Wu L,Xie SX. Effect of nitrate and ammonium nutrition on glutamine synthetase activities and relative genes for citrange[J]. Plant Physiology Journal,2018,54 (11):1703−1710. doi: 10.13592/j.cnki.ppj.2018.0232




 下载:
下载: