Spatial variation in saponin content and climatic response characteristics
-
摘要:
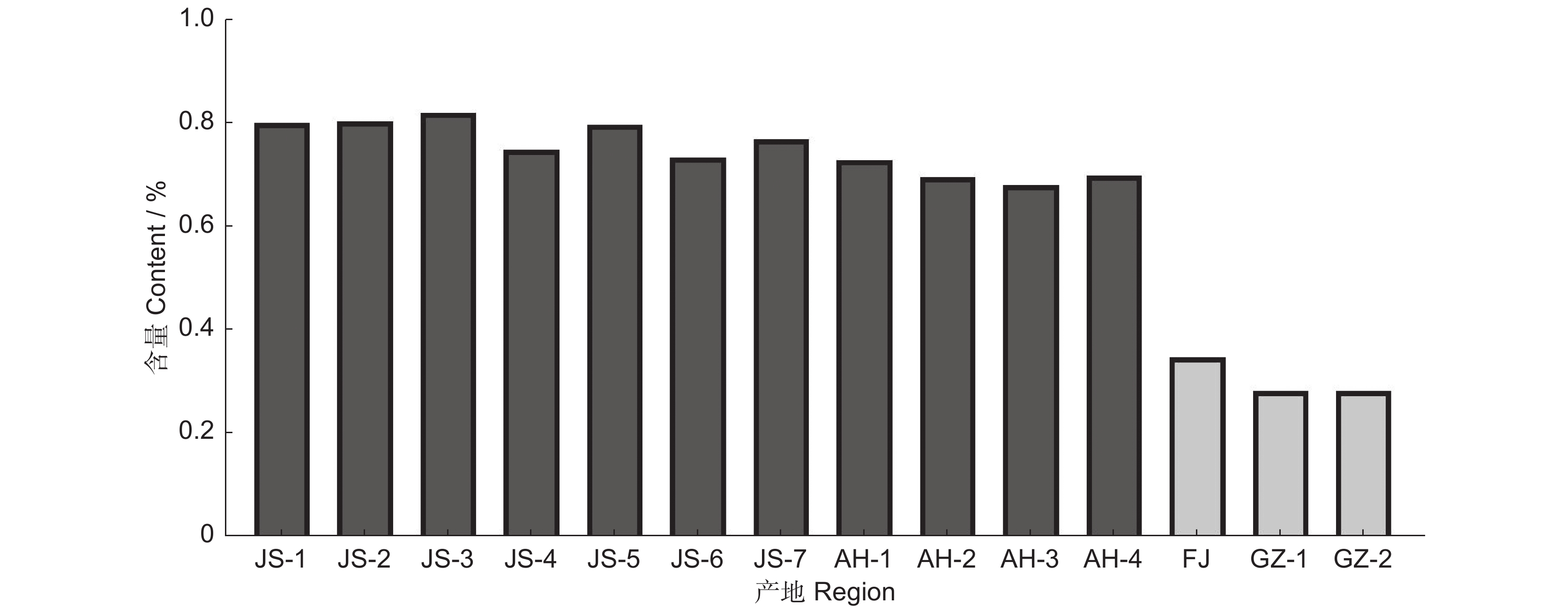
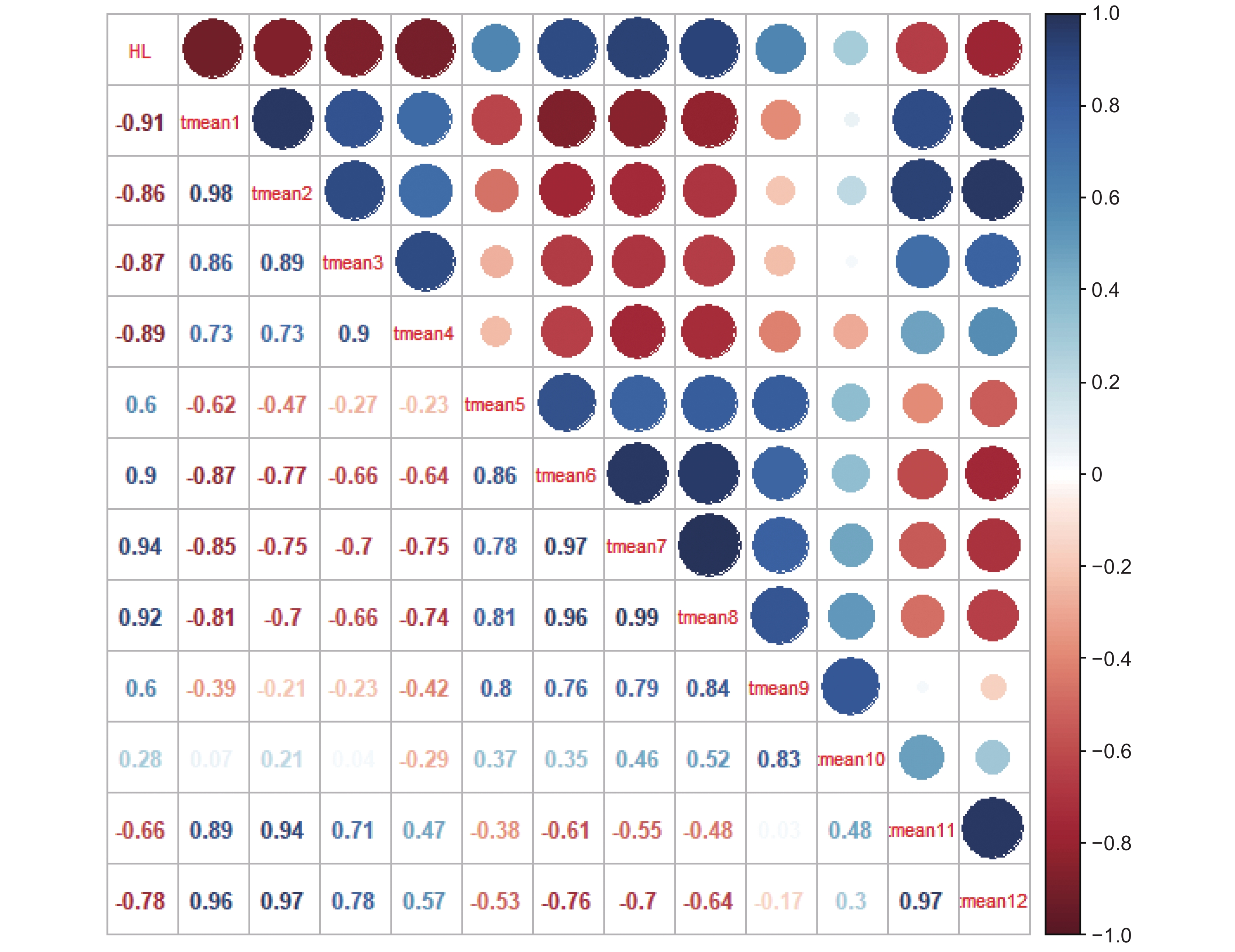
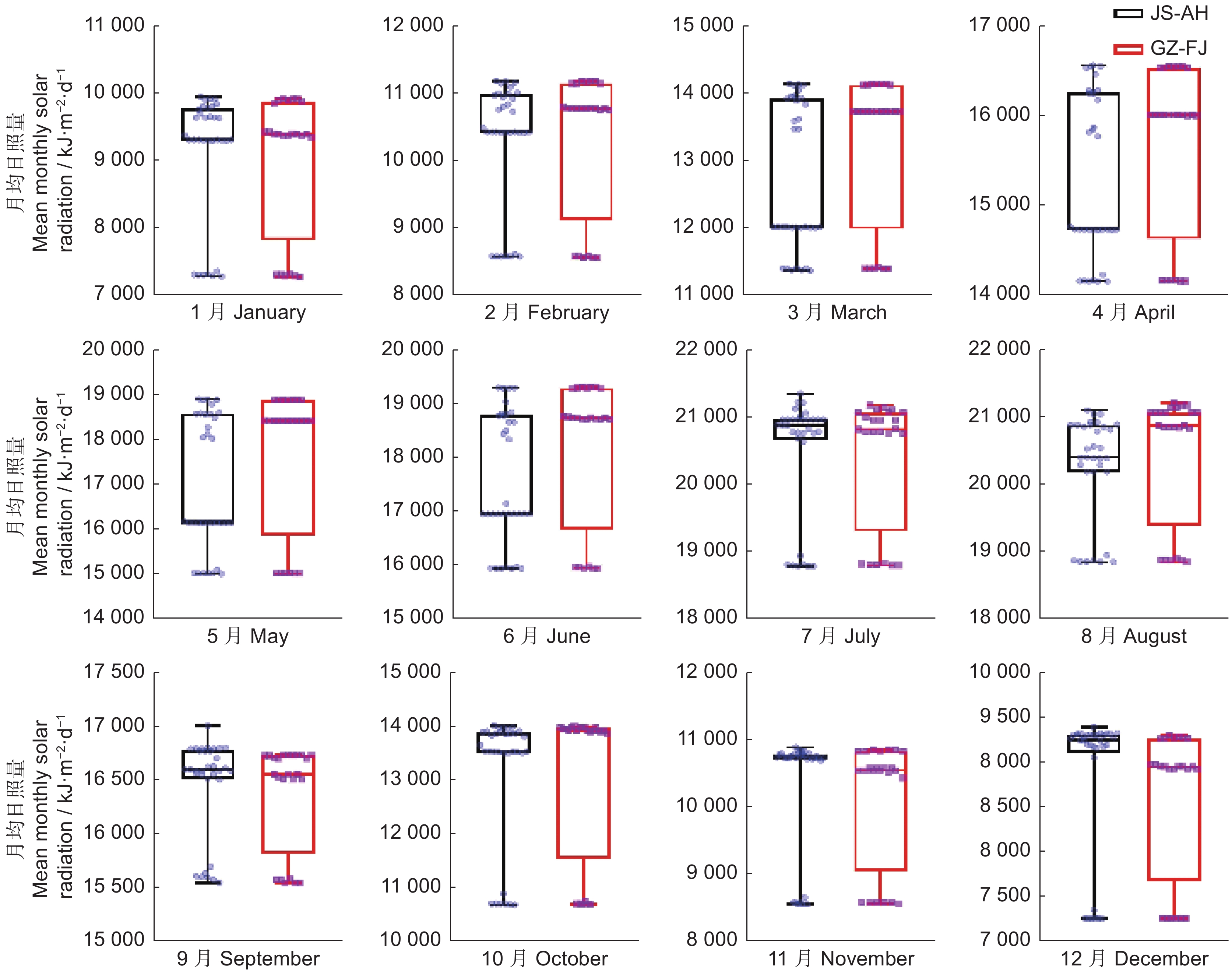
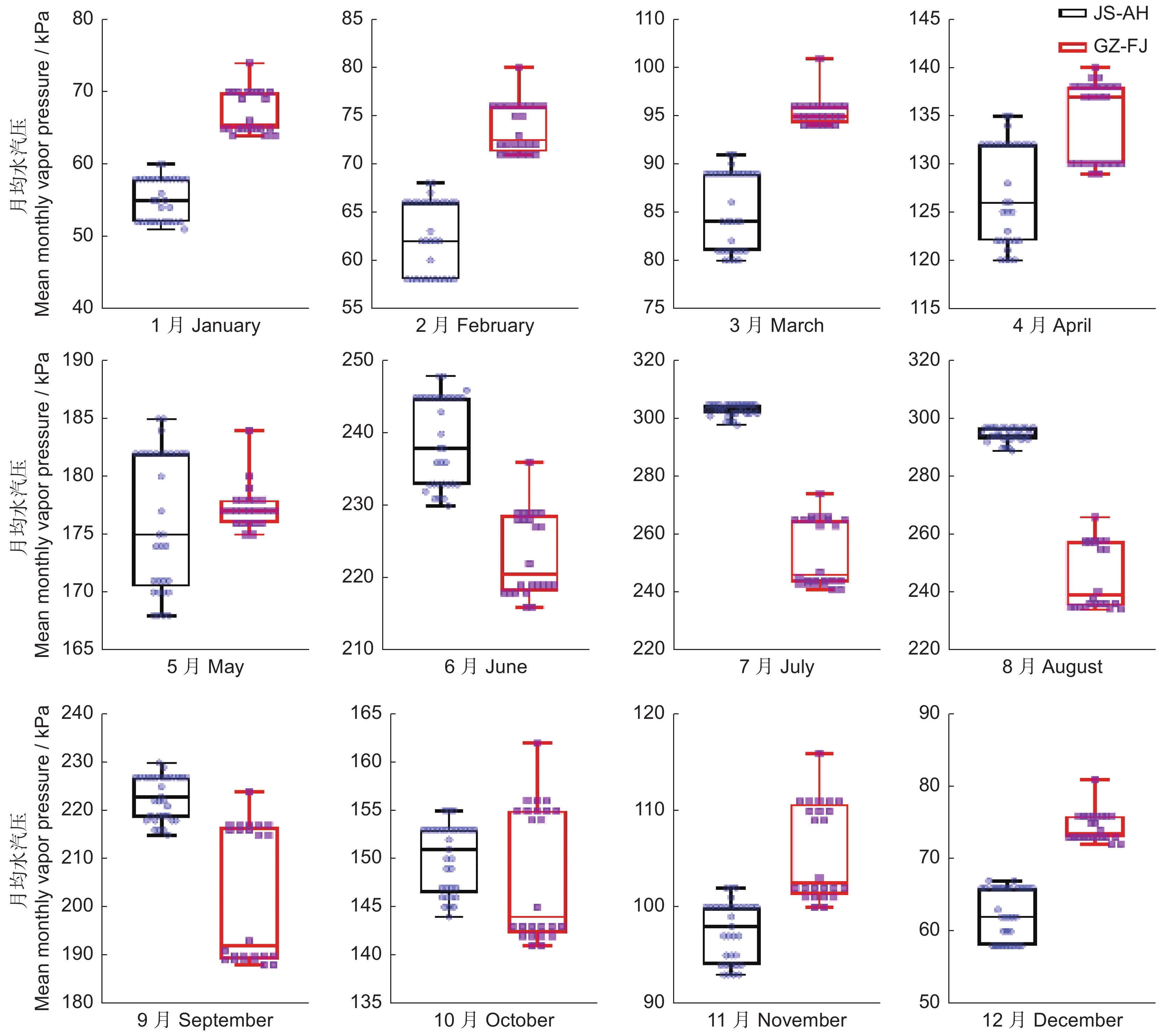
运用紫外-可见分光光度法测定4个产区药用植物太子参(Pseudostellaria heterophylla (Miq.)Pax ex Pax et Hoffm.)中的太子参皂苷含量,并分析太子参皂苷含量的地理变异规律,及其与气候因子在不同时间尺度上的响应关系。结果显示,太子参皂苷含量可分为江苏-安徽高含量区和贵州-福建低含量区。太子参皂苷含量与年均日照量呈极显著正相关,与年均相对湿度和年均降水呈负相关;与最热月份最高温呈显著正相关,与最冷季度平均温呈显著负相关。月均日照量和月均温对太子参皂苷含量影响较大,其中1-12月的月均日照量与太子参皂苷含量呈显著正相关;1-4月和11-12月的月均温与太子参皂苷含量呈负相关;5-9月的月均温与太子参皂苷含量呈正相关。产区间日照量差异可能是造成太子参皂苷含量地理变异的主要气候因素,日照量高、季度间温度差异大且相对少雨、低湿的地区有助于太子参皂苷的形成和积累。
Abstract:Ultra-violet-visible spectrophotometry (UV-VIS) was applied to determine saponin content in Pseudostellaria heterophylla in four main producing areas to analyze their spatial variation rules. Pearson correlation was used to analyze the response relationship between multi-scale climatic factors and saponin content. Results showed significant spatial variation in saponin content, with high-content regions in Jiangsu and Anhui provinces and low-content regions in Guizhou and Fujian provinces. Saponin content was strongly positively correlated with annual average solar radiation, while negatively correlated with annual average humidity and annual precipitation. Furthermore, saponin content was positively correlated with maximum temperature of the warmest month, while negatively correlated with mean temperature in the coldest quarter. Monthly mean solar radiation and monthly mean temperature were key factors for saponin content in P. heterophylla. Saponin content was strongly positively correlated with monthly average solar radiation from January to December and positively correlated with monthly mean temperature from May to September, but negatively correlated with monthly mean temperature from January to April and November to December. Results indicated that solar radiation is a vital climate factor for the spatial variation of saponin content. High-solar radiation, high temperature differences, and low precipitation and humidity were conducive to saponin accumulation in P. heterophylla.
-
朱红大杜鹃(Rhododendron griersonianum Balf. f. et Forrest)是杜鹃花属(Rhododendron)朱红大杜鹃亚族的唯一物种,也是中国特有物种。全世界杜鹃花品种中超过10%的亲本都与其有着直接或间接的关系,是名副其实的明星物种。然而,该物种自 1924 年被发表后,在野外几乎销声匿迹,直到 1964 年再次被发现[1]。由于人类活动频繁,其生境遭到严重破坏。2020 年,经本课题组多次实地调查发现,其仅残存 322 株于云南腾冲市,为典型的极小种群野生植物[2]。该物种已被列入 The Red List of Rhododendrons[3]和中国高等植物受威胁物种名录[4]中,均被评为极度濒危(CR)等级。朱红大杜鹃具有株形优美、花色鲜艳、花期长且易驯化等优点,研究其花器官分化具有重要意义,而目前与其相关的研究仅限于全基因组测序与组装等方面,对其花发育方面的研究尚未见报道。通常,花器官的分化主要由 MADS-box 基因家族控制,且该基因家族在果实发育中也发挥作用,但迄今为止,尚未见朱红大杜鹃 MADS-box 基因家族的相关报道。
MADS-box 基因家族最初被鉴定为同源异型基因,是植物中研究最广泛的转录因子家族之一[5, 6],同时也广泛存在于动物和真菌中[7],其命名来自酵母(Saccharomyces cerevisiae)MCMI 基因、拟南芥(Arabidopsis thaliana (L.) Heynh.)AGAMOUS 基因、金鱼草 (Antirrhinum majus L.)DEFTCI 基因及人类 SRF基因的首字母缩写[8]。MADS-box 转录因子的主要特征为具有 58~60 个氨基酸的 DNA 结合结构域,位于蛋白质的 N-端区域,称为 MADS 结构域[9]。根据其蛋白的结构域特征和系统发育关系,可将植物 MADS-box 家族划分成两大类,即 Type-Ⅰ型和 Type-Ⅱ型[10]。基于 SRF-like 结构域的差异,Type-Ⅰ型可进一步划分成 Mα、Mβ 和 Mγ 等 3 个亚族[11],这些基因的 N 端都包含一个约180 bp的MADS-box保守区域,且明确缺少 K-box 结构域(Keratin-like domain);Type-Ⅱ型不仅含 MEF2-like MADS 结构域,还含有约 70 个氨基酸的 K-box 结构域、约 30 个氨基酸的 I 结构域(Intervening domain)和长度可变的 C 结构域(Carboxy-terminal domain),故又被称为 MIKC 型 MADS-box 基因[12];基于Ⅱ型结构域所对应的基因结构以及K-box结构域的不同,可将MIKC划分为 MIKC* 型和 MIKCC型[13-15]。此外,K 结构域介导 MADS-box 蛋白的二聚化,并已被证明参与高级复合物的形成;I 结构域在 DNA 结合二聚体的形成中提供特异性;C 结构域是一个高度多样的区域,但已有研究证实 C 结构域在 MADS-box 蛋白相互作用和转录激活中具有关键作用[16]。多项研究发现,大多数植物中的Ⅰ型 MADS-box 基因比Ⅱ型基因更快地经历了基因复制过程,这可能是由于节段基因复制的频率更高和纯化选择更弱所致[9]。
MADS-box 基因家族在植物生长发育过程中承担多种功能,在参与调控植物非生物胁迫响应、开花时间控制、分生组织和花器官确定、果实成熟、胚发育以及根和叶等营养器官发育中具有突出功能[17-21],且在植物生长发育过程中,Ⅰ型基因作用一般弱于Ⅱ型[22]。在植物中发现的第一个MADS-box 基因是参与花发育的Ⅱ型基因,Ⅱ型基因还控制开花时间[23]。目前,许多物种的全基因组测序已完成,对 MADS-box 基因功能的理解已更加深刻。在拟南芥[11]、茄子(Solanum melongena L.) [24]、小麦(Triticum aestivum L.)[25]、水稻(Oryza sativa L.)[26]、毛果杨 (Populus trichocarpa Torr. & Gray)[27]和菠萝(Ananas comosus (L.) Merr.)[28]等植物中,MADS-box基因已得到广泛研究,如 Ruelens 等[29]研究发现,二穗短柄草(Brachypodium distachyum (L.) Beauv.)的 MADS-box在调控花发育的“ABCDE 模型”中扮演着非常重要的角色,E 类基因 (SEP1/2、SEP3 和 SEP4)可以形成所有花器官发育所必需的 MADS-box 蛋白复合物;Ferrario 等[30]在圆叶牵牛(Pharbitis purpurea (L.) Voisgt)的研究中发现,FBP2 基因能调控开花时间,且可以调控花萼片的转化。拟南芥 FLC 亚族基因不仅可以调节其开花时间,还可以改变或消除不同生态型的春化作用[23];高玮林等[31]在对枣(Ziziphus jujuba Mill.)E 类 MADS-box 基因的研究中发现,SEP1/2、SEP3 和 SEP4 同源基因在花发育的整个过程中均有表达,但不同基因在功能和调控模式上均有略微差异,表现出一定的功能分化。在拟南芥中,MADS-box 家族的 AGAMOUS-LIKE6(AGL6)基因在调控其侧生器官发育和开花时间中起关键作用,且在花发育过程中,在所有花器官的近端区域和发育的胚珠中均能检测到 AGL6[20]。孙福辉等[32]对马银花(Rhododendron ovatum (Lindl.) Planch. ex Maxim.)MADS-box 基因家族的研究结果表明,AP1、AP3/PI、AG、SEP 和 MIKC*分支基因均在花器官中特异表达,并构建了花的发育模型。
本研究基于课题组前期获得的朱红大杜鹃全基因组数据[2],使用生物信息学方法,对其 MADS-box 基因的理化性质、基因结构、染色体定位、共线性和系统进化关系等进行分析,研究结果旨在为 MADS-box 基因家族成员的生物学功能分析奠定基础。同时,理解朱红大杜鹃 MADS-box 基因分子的进化特点,为杜鹃花科植物的花型遗传改良和育种工作提供参考。
1. 材料与方法
1.1 朱红大杜鹃 MADS-box 基因的鉴定及理化性质分析
利用 BLAST和HMMER search 方法鉴定 MADS-box 基因。朱红大杜鹃基因组数据来源于本课题组的全基因组测序数据[2],拟南芥基因组数据下载自 TAIR 网站(https://www.arabidopsis.org/)。从 Pfam 网站(http://pfam.xfam.org/)下载与 MADS 结构域(PF00319)对应的隐马尔可夫模型(Hidden Markov model,HMM)文件,用 HMMER search 方法在朱红大杜鹃的蛋白序列中检索 MADS-box 蛋白序列,得出一次结果,然后以拟南芥的 MADS-box 蛋白序列为索引,利用 TBtools[33] 软件进行本地 BLAST 比对。将两种方法鉴定的结果合并取交集,将比对后的MADS-box基因家族蛋白序列,利用NCBI的CDD 数据库(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和SMART数据库(https://www.ncbi.nlm.nih.gov/Structure/),对其保守结构域进行逐个鉴定分析,剔除结构域不完整、重复的序列,最终获得81个MADS-box转录因子序列。通过在线软件 ExPasy(https://web.expasy.org/protparam/)分析其编码蛋白序列的相对分子质量、理论等电点等基本理化性质。
1.2 系统进化树构建、蛋白基序及保守结构域分析
根据文献获得拟南芥 MADS-box 蛋白序列的登录号[11],在 TAIR 网站下载拟南芥 107 个MADS-box蛋白序列文件。利用 MAGE 11 软件中的 Clustal W 程序,对朱红大杜鹃和拟南芥的MADS-box蛋白序列进行多序列比对。采用邻近法(Neighbor-joining method,NJ)构建系统发育树,参数设置为:1 000 Bootstrap method、P-distance 模型和 Pairwise deletion,使用 Itol 在线工具(https://itol.embl.de/upload.cgi)对进化树进行美化。将朱红大杜鹃的 MADS-box基因家族全部进行提取,采用MEME在线工具(http://meme-suit.org/meme/tools/meme),分析其蛋白基序,基序的最大数目设置为10。利用 NCBI 数据库的 Batch CD-Search 工具,分析 MADS-box蛋白序列的保守结构域,最后使用 TBtools 软件的 Gene structure view(Advanced)插件对蛋白基序及保守结构域进行可视化。
1.3 MADS-box基因的结构分析
在朱红大杜鹃的 GFF3 文件中提取MADS-box基因序列的注释信息,使用 TBtools 的 Amazing optional gene viewer 模块分析内含子与外显子的组成情况,利用TBtools 软件的 Gene structure view(Advanced)插件进行可视化处理。
1.4 MADS-box基因的染色体分布
在全基因组文件中提取 MADS-box基因在染色体上的定位信息,利用 TBtools 软件的 Gene density profile 插件对染色体颜色进行填充,使用 Map Gene2 Chromosome v2(http://mg2c.iask.in/mg2c_v2.0/)在线工具绘制 MADS-box 基因在染色体上的位置。
1.5 MADS-box 启动子顺式作用元件分析
使用 TBtools 软件,在基因组文件中提取 MADS-box 基因转录起始位点上游2 000 bp的序列作为基因的启动子区,利用 Plant CARE在线工具(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行分析,预测启动子区中的顺式作用元件,并对分析结果进行统计,将整理后的数据利用 TBtools 软件进行可视化。
1.6 MADS-box的共线性分析
利用基因组数据库 TAIR 和植物数据库 Ensembl Plants 分别下载拟南芥和毛果杨的MADS-box基因组数据,使用TBtools软件的多重共线性扫描工具包(One step MCScanX)对3种植物进行全基因组共线性分析,获得 ctl、gff 和 collinearity 文件。使用TBtools软件获得朱红大杜鹃各染色体长度文件,找出 MADS-box基因中的高亮基因及所在染色体位置,利用Advanced Circos软件绘制其种内共线性关系图;根据朱红大杜鹃、拟南芥及毛果杨的MADS-box基因 ID,从共线性结果中筛选出 三 者间的共线性基因对,利用 TBtools 软件的Dual systeny plot程序绘制种间共线性图。
1.7 MADS-box的基因复制事件
根据 MADS-box 基因两两之间的 BLASTP 比对结果,获取基因复制的同源事件,利用 MCScanX 进行全基因组共线性分析,鉴定片段复制,然后利用 TBtools 软件计算复制基因的非同义替换率(Ka)和同义替换率(Ks),并进一步计算 Ka/Ks 的比值,分析环境选择压力。判断基因复制事件有两个条件:一是两个基因序列相似性大于 75%,二是相似序列长度大于较长序列的 75%[34]。
2. 结果与分析
2.1 MADS-box 的鉴定及理化性质分析
基于朱红大杜鹃的全基因组数据,进行初步筛选,获得 93 个 MADS-box 基因家族候选基因。利用 NCBI 的CDD 库和SMART对保守结构域进行进一步验证,剔除了 12 个不含 MADS-box 结构域或重复的基因,最终获得 81 个 MADS-box基因家族成员,将其命名为RhMADS1~RhMADS81(附表1
1 ))。对 81 个MADS-box的蛋白序列进行理化性质分析,发现不同序列之间差异较大(附表1)。MADS-box蛋白序列的长度为67~575 aa,最长的是RhMADS66,最短的是RhMADS30,平均为 225 aa。理论等电点在4.76~10.66,平均等电点为 8.12,等电点最大的为RhMADS35,最小的为 RhMADS49,其中58 个蛋白的等电点大于 7。蛋白分子量在 7 769.95~
64848.69 Da,最大的为 RhMADS66,最小的为 RhMADS30。在蛋白稳定性方面,不稳定系数小于40,则该蛋白具有稳定性。在 81 个 MADS-box 蛋白序列中,只有 11 个蛋白的不稳定系数小于 40,其余的均大于 40。脂肪系数最大的是RhMADS2,为118.08,最小的是RhMADS26,为56.50。在亲水性方面,平均亲水系数大于0,表示蛋白有一定的疏水性,小于0,则表示具有亲水性;本研究发现,除了3个蛋白序列的平均亲水性大于 0,其余MADS-box蛋白均小于 0,为亲水性蛋白。2.2 MADS-box 系统发育树的构建
对朱红大杜鹃和拟南芥的 MADS-box蛋白序列进行比对,采用邻接法,构建系统进化树,并用 Itol 工具进行美化。结果显示,81个基因中,有 24个是Ⅰ型基因,其中15个为Mα亚族,3个为Mβ 亚族,6个为 Mγ 亚族;Ⅱ型MADS-box 基因有57 个,其中MICK* 型亚族有5 个,而 MICKC型又可划分为13个亚族,除了OsMADS32、AGL15和FLC 外,其他亚族均含有 MADS-box基因,其中SVP亚族含有的成员最多,为13 个,AGL12和SEP 最少,均为 2 个(图1)。由于 OsMADS32 亚族为单子叶植物所特有,本研究在朱红大杜鹃中未发现。
2.3 MADS-box蛋白基序及保守结构域分析
本研究从朱红大杜鹃 MADS-box 蛋白共鉴定出 10 个保守基序(附图1
2 )),命名为 Motif 1~10。Motif 1 是 MADS 域最明显的特征,仅 RhMADS63不含该基序。Ⅱ型中仅 RhMADS11和RhMADS77 不含 Motif 2;Motif 3 和Motif 4是Ⅱ型 MADS-box的典型结构;而 Motif 5~7和 Motif 10 仅存在于Ⅱ型 MADS-box蛋白序列中,Motif 8和Motif 9仅存在于Ⅰ型蛋白序列中。同一亚族的MADS-box 具有相似的Motif结构,而Ⅱ型的结构组成更加多样化,且存在一些亚家族特异性的保守基序,如 SVP 蛋白序列特有的Motif 5(附图1)。对MADS-box蛋白的保守结构域进行分析发现,所有蛋白序列均含有MADS、MADS_SRF或 MADS_MEF2 结构域(附图1),而 K-box 结构域仅存在于Ⅱ型蛋白序列中。此外,朱红大杜鹃 MADS-box 蛋白还含有其他少数几个结构域。2.4 MADS-box基因结构分析
对朱红大杜鹃MADS-box基因的 CDS 序列和基因组 DNA 序列进行分析发现(附图2
3 )),不同基因的长度和外显子的数目及长度差异较大。外显子数目为 1~12 个,其中,RhMADS39 的外显子最多,为 12 个;Ⅰ型MADS-box 基因有 23 个不含内含子,仅 RhMADS14 含有 1 个内含子;Ⅱ型MADS-box 基因中有 21 个具有内含子,其中 RhMADS43 内含子最多,为11个;其余基因均没有内含子。2.5 MADS-box基因的染色体分布
染色体分布分析结果表明(附图3
4 )),朱红大杜鹃MADS-box 基因家族81 个成员不均匀地分布在 12 条染色体上。其中,第 7 号染色体上分布数量最多,为 14 个,而 2 号染色体上没有分布。染色体长度与 MADS-box 基因的分布没有相关性,最长的第 4 号染色体上仅分布有 5 个基因,而最短的第 12 号染色体上有 8 个。2.6 MADS-box启动子顺式作用元件分析
本研究提取MADS-box转录因子起始位点上游 2 000 bp 的序列作为基因的启动子区,共鉴定出48种顺式作用元件(附图4
4 ) 和附表24 ))。根据其功能注释,可分为:光响应作用元件(23 种)、激素反应作用元件(11 种)、胁迫响应作用元件(6 种)以及植物生长作用元件(8 种)。在MADS-box基因启动子中共鉴定出 876 个光响应元件,主要包括 G-box、Box4、3-AF1 binding site、Chs-Unit 1 m1 等元件,其中,G-box和 Box4 最多,且每个MADS-box至少含有161个与光响应相关的元件;同时,在MADS-box基因启动子中共鉴定出 637 个植物激素反应元件,包括赤霉素、脱落酸、茉莉酸甲酯和水杨酸等相关作用元件。此外,还鉴定出 403 个胁迫响应元件以及 98 个植物生长相关元件。2.7 MADS-box 的共线性分析
种内共线性分析结果表明,共线性 MADS-box 基因分布于3~8 和 11 号染色体上(图2),共检测出 6 对片段重复基因和 1 对串联重复基因 (RhMADS23 与 RhMADS51),这可能是基因重复事件所致,朱红大杜鹃 MADS-box基因在进化过程中可能发生了基因扩张事件。
物种间共线性分析发现, 朱红大杜鹃25个MADS-box基因与拟南芥的基因存在共线性关系(附图5
5 )),有69个基因与毛果杨的基因存在共线性关系。除了在 5~8、11和12号染色体与拟南芥存在共线性基因对外,其余染色体均与拟南芥 MADS-box基因不存在共线性基因对。与毛果杨的共线性分析中,在 3、5~8、11~13 号染色体上存在共线性基因对,其余染色体均无共线性基因对。2.8 MADS-box基因复制事件
Ka/Ks<1,表明基因在进化过程中受到纯化选择;Ka/Ks=1,表明基因受到中性选择;Ka/Ks>1,则表示基因受到正向选择。本研究结果显示,存在共线性基因对的 Ka/Ks 值均小于1(附表3
6 )),表明朱红大杜鹃 MADS-box 基因在进化过程中受到纯化选择作用,基因结构稳定保守,在其基因功能上并无较大差异的分化。3. 讨论
3.1 MADS-box基因家族的鉴定与特征
本研究基于朱红大杜鹃的全基因组测序数据,利用生物信息学方法鉴定出 81 个 MADS-box 基因。根据拟南芥中的分类方法,将其分为 Type-Ⅰ(24个)和 Type-Ⅱ 型(57个)两类。两种类型的成员数目显著差异,可能Ⅱ型基因较Ⅰ型功能复杂,且进化程度更高。目前,在拟南芥[11]、大豆(Glycine max (L.) Merr.)[35]、烟草(Nicotiana tabacum L.)[36]、番茄(Lycopersicon esculentum Mill.) [37]、马银花[32]、萝卜(Raphanus sativus L.) [38]、菊花(Dendranthema morifolium (Ramat.) Tzvel.)[39]、中华猕猴桃(Actinidia chinensis Planch.) [40]和芝麻(Sesamum indicum L.)[41]等植物中分别鉴定出了107、95、183、131、77、144、98、68 和 37 个MADS-box家族成员,各物种 MADS-box 基因的数量有差异,可能与其基因组大小及全基因组复制水平不同有关。理化性质分析结果显示,不同家族成员的蛋白序列长度、等电点、亲水性等差异均比较大,可能与其相对应的功能有关。本研究对朱红大杜鹃 MASD-box的理化性质、系统进化、基因结构、Motif、保守结构域及顺式作用元件等方面进行了分析,研究结果可为进一步探讨该基因家族的功能提供参考。
MADS-box是植物转录因子中研究最为广泛的家族之一,在植物生长发育、胁迫反应以及次生代谢调控等方面起着重要作用[42],尤其是在植物花序、花发育和果实成熟过程中表达最为明显。在植物花器官发育的“ABCDE”模型中,所涉及的基因多为MADS-box 基因家族,这一家族在调控花器官的形成与分化过程中扮演着至关重要的角色,其中不同花序中的特定表达过程受Ⅱ型基因调节[28]。譬如拟南芥的 SVP 亚族基因是花完整发育的网络调控中心,SOC1 亚族基因可以决定开花时间,SOC1 亚族中的 MADS-box 基因为植物开花信号通路的整合因子,AGL17亚族在调控花发育过程中也发挥重要作用,但拟南芥 SVP 亚族仅有两个成员[43]。本研究发现,朱红大杜鹃的 SVP亚族成员多达13个,AGL17和SOC1亚族成员分别为9个和5个。因此,朱红大杜鹃的SVP亚族可能涉及更加复杂的花发育调控,而AGL17和SOC1亚族则可能协同调控花发育和开花时间。拟南芥的AGL6亚族基因在其侧生器官发育和开花时间的调控中同样不可或缺,其在茎生叶原基的远轴和近端区域以及花苞片中均有表达[20]。朱红大杜鹃的AGL6亚族仅有3个成员,可能在进化过程中发生了基因丢失。由于 MADS-box 转录因子在控制植物开花过程中非常重要,研究该基因家族可能有助于理解朱红大杜鹃濒危的原因。此外,MADS-box基因启动子存在较多的光反应、激素反应及胁迫适应相关的顺式作用元件,进一步表明该家族基因在植物的整个生命周期中,特别是在其生长发育阶段以及面对各种环境胁迫时,发挥着不可或缺的关键作用。
3.2 MADS-box家族的基因结构及保守基序
内含子的数量越多、长度越大,基因剪接的方式就越多样化,因而更易影响基因表达,从而调控蛋白质的活性。同时,内含子丢失的基因具有较高的同义替换率,且丢失的内含子比现存的内含子具有更高的突变率[44, 45]。朱红大杜鹃Ⅰ型MADS-box的结构较为简单,其中23个成员没有内含子,仅有RhMADS14含有1个内含子,这可能是MADS-box基因家族多样化过程中经历了多个内含子的丢失所致;而Ⅱ型具有较多的内含子。蛋白基序分析结果表明,同一组中含有最保守的基序,且这些保守基序在群体特异性功能中发挥着重要作用。MADS-box基因均含有1个MADS保守结构域,而Ⅱ型成员还含有1个独有的 K-box 结构域,意味着Ⅱ型基因功能更复杂,与拟南芥[11]、茄子[24]和马铃薯(Solanum tuberosum L.)[46]中的研究结果相似,可为朱红大杜鹃MADS-box的进化关系提供更多的线索。顺式作用元件分析结果表明,启动子区主要的作用元件可分为4大类型:光响应元件、胁迫响应元件、激素反应和植物生长元件。
3.3 MADS-box基因家族的进化分析
在进化过程中,基因复制产生的新基因可能发挥着新的功能,同时也提高植物适应新环境的能力[47]。本研究中,片段重复(6 对)和串联重复(1 对)基因对均属于Ⅱ型和Mα亚家族,属于Ⅱ型亚家族的基因占 60%,这与浙江红山茶(Camellia chekiangoleosa Hu)[48]相似,Ⅱ型 MADS-box的片段重复比Ⅰ型频率高,可能是Ⅱ型基因出现和分化的时间更早,且Ⅱ型基因的结构也更加保守。MADS-box在7号染色体上分布最多,共有14个基因,这可能是由串联重复所致。基因间的共线性是理解两者亲缘关系的重要途径,朱红大杜鹃与拟南芥之间的共线性基因为 25 对,而与毛果杨间的共线性基因多达 69 对,表明朱红大杜鹃与毛果杨的共线性和同源性更高,亲缘关系可能更近。Ka/Ks 值被认为是研究蛋白质编码基因的选择压力或强度的重要指标[34]。本研究中,朱红大杜鹃中存在共线性基因对的MADS-box基因的Ka/Ks 值均小于 1,表明这些基因在进化过程中受到纯化选择作用。
4. 结论
本研究基于课题组前期建立的朱红大杜鹃全基因组数据库,对其 MADS-box 家族进行了全基因组鉴定,并对其理化性质、系统进化、基因结构、保守结构域、顺式作用元件以及种内与种间共线性等进行了分析,研究结果将有助于理解MADS-box家族在朱红大杜鹃花分化过程中的作用,并为其他植物的相关基因家族研究提供参考。
-
图 2 不同产地年均因子热图
JS:江苏;AH:安徽;GZ:贵州;FJ:福建。NJS:年降水;NJW:年均温;RZ:年均日照时数;SD:年均相对湿度。下同。
Figure 2. Heatmap of annual climate factors
JS: Jiangsu; AH: Anhui; GZ: Guizhou; FJ: Fujian. NJS: Average annual precipitation; NJW: Average annual temperature; RZ: Sunshine duration; SD: Average annual humidity. Same below.
表 1 样本地理信息
Table 1 Geographic information of sample
省市级
Province and municipality区/县级市
District/county-level city乡镇
Villages and towns编号
Classify and code江苏省镇江市 句容市 袁巷镇 JS-1 江苏省镇江市 句容市 茅山镇 JS-2 江苏省镇江市 句容市 天王镇 JS-3 江苏省镇江市 句容市 天王镇 JS-4 安徽省宣城市 宣州区 黄渡乡 AH-1 安徽省宣城市 宣州区 古泉镇 AH-2 福建省宁德市 柘荣县 富溪镇 FJ 江苏省镇江市 句容市 陈武乡 JS-5 贵州省黔东南州 施秉县 牛大场镇 GZ-1 安徽省宣城市 广德市 东亭乡 AH-3 江苏省常州市 溧阳市 上兴镇 JS-6 江苏省常州市 金坛区 薛埠镇 JS-7 安徽宣城市 宣州区 向阳镇 AH-4 贵州参黔东南州 黄平县 — GZ-2 表 2 太子参皂苷含量与季度气候因子间的Pearson系数
Table 2 Pearson correlation coefficients between seasonal climatic factors and saponin content
气候因子
Climate factor相关系数
Correlation coefficient显著性(双尾)
Sig.气候因子
Climate factor相关系数
Correlation coefficient显著性(双尾)
Sig.bio2 0.423 0.132 bio11 −0.863** 0.000 bio3 −0.923** 0.000 bio14 0.315 0.272 bio5 0.893** 0.000 bio15 −0.775** 0.001 bio7 0.961** 0.000 bio18 −0.475 0.086 bio8 0.853** 0.000 bio19 0.290 0.314 bio9 −0.146 0.619 注:** 表示0.01 级别(双尾)相关性显著。下同。 Note: ** indicates significant differences at P < 0.01 level. Same below. 表 3 太子参皂苷含量与月均降水的Pearson系数
Table 3 Pearson correlation coefficients between mean monthly precipitation and saponin content
综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.prec_1 0.339 0.235 prec_7 0.891** 0.000 prec_2 0.230 0.429 prec_8 −0.556* 0.039 prec_3 −0.044 0.880 prec_9 −0.461 0.097 prec_4 −0.576* 0.031 prec_10 −0.950** 0.000 prec_5 −0.906** 0.000 prec_11 −0.719** 0.004 prec_6 −0.630* 0.016 prec_12 0.315 0.272 注:* 表示 0.05 级别(双尾)相关性显著。下同。 Note: * indicates significant differences at P < 0.05 level. Same below. 表 5 太子参皂苷含量与月均水汽压的Pearson系数
Table 5 Pearson correlation coefficients between mean monthly vapor pressure and saponin content
综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.vapr_1 −0.864** 0.000 vapr_7 0.944** 0.000 vapr_2 −0.850** 0.000 vapr_8 0.942** 0.000 vapr_3 −0.860** 0.000 vapr_9 0.744** 0.002 vapr_4 −0.811** 0.000 vapr_10 0.194 0.506 vapr_5 −0.316 0.271 vapr_11 −0.618* 0.019 vapr_6 0.673** 0.008 vapr_12 −0.886** 0.000 表 4 太子参皂苷含量与月均日照量的Pearson系数
Table 4 Pearson correlation coefficients between mean monthly solar radiation and saponin content
综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.综合气候因子
Climate factor相关性
Correlation显著性(双尾)
Sig.srad_1 0.872** 0.000 srad_7 0.668** 0.009 srad_2 0.889** 0.000 srad_8 0.827** 0.000 srad_3 0.990** 0.000 srad_9 0.596* 0.024 srad_4 0.984** 0.000 srad_10 0.838** 0.000 srad_5 0.986** 0.000 srad_11 0.785** 0.001 srad_6 0.975** 0.000 srad_12 0.770** 0.001 -
[1] 国家药典委员会. 中华人民共和国药典. 一部[M]. 北京: 中国医药科技出版社, 2015: 248. [2] 沈祥春,陶玲,柏帅,甘惠仍,段金廒. 太子参对心肌梗死后慢性心衰大鼠氧化应激的干预作用[J]. 华西药学杂志,2008,23(4):413−416. doi: 10.3969/j.issn.1006-0103.2008.04.014 Shen XC,Tao L,Bo S,Gan HR,Duan JA. Ameliorated effects of Radix Pseudostellariae on oxidative stress in rat chronic heart failure induced by acute cardiac infarction[J]. West China Journal of Pharmaceutical Sciences,2008,23 (4):413−416. doi: 10.3969/j.issn.1006-0103.2008.04.014
[3] 沈祥春,彭佼,李淑芳,方泰惠,段金廒. 太子参正丁醇提取部位对大鼠急性心肌梗死诱发心肺损伤的保护作用[J]. 中华中医药杂志,2010,25(5):666−669. Shen XC,Peng J,Li SF,Fang TH,Duan JA. Protective effect of n-butanol extract from Radix Pseudostellariae(RP) on rat experimental cardiopulmonary Injury induced by acute myocardial infarction[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2010,25 (5):666−669.
[4] 傅兴圣,刘训红,许虎,周逸芝,陈菲. 太子参研究现状与研发趋势[J]. 中国新药杂志,2012,21(7):757−760. Fu XS,Liu XH,Xu H,Zhou YZ,Chen F. Research status and trends of Pseudostellariae Radix[J]. Chinese Journal of New Drugs,2012,21 (7):757−760.
[5] 汪剑飞. 太子参药理研究新进展[J]. 实用药物与临床,2013,16(4):333−334. doi: 10.3969/j.issn.1673-0070.2013.04.026 Wang JF. New progress of pharmacological research of prince ginseng[J]. Practical Pharmacy and Clinical Remedies,2013,16 (4):333−334. doi: 10.3969/j.issn.1673-0070.2013.04.026
[6] 宋叶,林东,梅全喜,杨德贵. 太子参化学成分及药理作用研究进展[J]. 中国药师,2019,22(8):1506−1510. doi: 10.3969/j.issn.1008-049X.2019.08.034 Song Y,Lin D,Mei QX,Yang DG. Study advances in chemical constituents and pharmacological activities of Radix Pseudostellariae[J]. China Pharmacist,2019,22 (8):1506−1510. doi: 10.3969/j.issn.1008-049X.2019.08.034
[7] 韩邦兴,朱志祥,姚勇,李媛媛,陈钧. 不同产地太子参多糖、氨基酸含量比较分析[J]. 中成药,2010,32(3):513−514. [8] 韩怡,巢建国,谷巍,张莹,孙亚昕. 不同产地太子参环肽B含量测定[J]. 现代中药研究与实践,2012,26(5):69−71. doi: 10.13728/j.1673-6427.2012.05.025 Han Y,Chao JG,Gu W,Zhang Y,Sun YX. Determination of the heterophyllin B of Pseudostellaria heterophylla from different produce area[J]. Research and Practice on Chinese Medicines,2012,26 (5):69−71. doi: 10.13728/j.1673-6427.2012.05.025
[9] 宋李桃,刘贵先,林洲,卓沛元,肖惠珍,廖华军. 不同产地太子参多糖含量测定和对小鼠抗应激作用研究[J]. 辽宁中医药大学学报,2014,16(3):25−27. Song LT,Liu GX,Lin Z,Zhuo PY,Xiao HZ,Liao HJ. Experimental study on anti-stress function and content determination of Radix Pseudostellariae from different habitats[J]. Journal of Liaoning University of TCM,2014,16 (3):25−27.
[10] 侯娅,马阳,邹立思,刘训红,罗益远,等. 基于UPLC-Triple TOF-MS/MS技术的不同产地太子参水提物化学组成分析[J]. 食品工业科技,2015,36(15):275−280. Hou Y,Ma Y,Zou LS,Liu XH,Luo YY,et al. Composition analysis of the chemical composition of water extract in Radix Pseudostellariae from different habitats by UPLC-Triple TOF-MS/MS[J]. Science and Technology of Food Industry,2015,36 (15):275−280.
[11] 郭锐,朱长乐,王育良. 太子参皂苷提取物对视网膜激光损伤的保护作用[J]. 眼科新进展,2013,33(12):1120−1123. doi: 10.13389/j.cnki.rao.2013.12.002 Guo R,Zhu CL,Wang YL. Protective effects of Radix Pseudostellariae extract on laser-induced retinal damage[J]. Recent Advances in Ophthalmology,2013,33 (12):1120−1123. doi: 10.13389/j.cnki.rao.2013.12.002
[12] 郭锐. 太子参皂苷提取物对视网膜激光损伤保护作用的研究[D]. 南京: 南京中医药大学, 2014: 10-12. [13] 林茂,郑炯,杨琳,陈娅娅,王沁,等. 不同产地太子参中化学成分分析[J]. 食品科学,2012,33(2):204−207. Lin M,Zheng J,Yang L,Chen YY,Wang Q,et al. Chemical compositions of Pseudostellaria heterophylla (Miq.) Pax cultivated in different regions[J]. Food Science,2012,33 (2):204−207.
[14] 林思妮. 太子参皂苷合成关键酶HMGR基因的克隆与转化烟草研究[D]. 福州: 福建农林大学, 2016: 6-7. [15] 王绍中,章练红,徐雪林,李运景,许晓萍,曹广才. 环境生态条件对小麦品质的影响研究进展[J]. 华北农学报,1994,9(S1):141−144. Wang SZ,Zhang LH,Xu XL,Li YJ,Xu XP,Cao GC. Effect studies of environment and ecological conditions on wheat quality[J]. Acta Agriculturae Boreali-Sinica,1994,9 (S1):141−144.
[16] 周涛,杨占南,江维克,艾强,郭培果. 民族药大果木姜子果实挥发油成分的变异及其规律[J]. 中国中药杂志,2010,35(7):852−856. Zhou T,Yang ZN,Jiang WK,Ai Q,Guo PG. Variation and regularity of volatile oil constituents in fruits of national medicine Cinnamomum migao[J]. China Journal of Chinese Materia Medica,2010,35 (7):852−856.
[17] 马卫峰,周涛,江维克,贺勇,朱寿东,郭兰萍. 续断居群主要活性成分的空间结构及地理分布规律[J]. 中国中药杂志,2013,38(20):3419−3423. Ma WF,Zhou T,Jiang WK,He Y,Zhu SD,Guo LP. Spatial structure and geographic distribution of major active component in medical herb Dipsacus asperoides population[J]. China Journal of Chinese Materia Medica,2013,38 (20):3419−3423.
[18] 曾凡琳,王欢,温美佳,张琴,谢彩香. 宁夏枸杞有效成分与气候因子相关性的分析[J]. 中成药,2015,37(12):2696−2701. Zeng FL,Wang H,Wen MJ,Zhang Q,Xie CX. Relationships between effective constituents of Lycium barbarum L. and climatic factors[J]. Chinese Traditional Patent Medicine,2015,37 (12):2696−2701.
[19] 郭杰,张琴,孙成忠,文检,谢彩香. 人参药材中人参皂苷的空间变异性及影响因子[J]. 植物生态学报,2017,41(9):995−1002. doi: 10.17521/cjpe.2016.0368 Guo J,Zhang Q,Sun CZ,Wen J,Xie CX. Spatial variations of ginsenosides in Panax ginseng and their impact factors[J]. Chinese Journal of Plant Ecology,2017,41 (9):995−1002. doi: 10.17521/cjpe.2016.0368
[20] 王建林,钟志明,冯西博,付刚,侯维海,等. 青藏高原青稞蛋白质含量空间分异规律及其与环境因子的关系[J]. 中国农业科学,2017,50(6):969−977. Wang JL,Zhong ZM,Feng XB,Fu G,Hou WH,et al. Spatial distribution regulation of protein content of naked barley varieties and its relationships with environmental factors in Qinghai-Tibet Plateau[J]. Scientia Agricultura Sinica,2017,50 (6):969−977.
[21] 冯西博,王建林,钟志明,侯维海,王改花,大次卓嘎. 青藏高原青稞赖氨酸含量空间分布及其与环境因子的关系[J]. 核农学报,2017,31(7):1388−1396. Feng XB,Wang JL,Zhong ZM,Hou WH,Wang GH,Dacizhuoga. Spatial distribution of lysine content in highland barley and its relationship with environmental factors in Qinghai-Tibet Plateau[J]. Journal of Nuclear Agricultural Sciences,2017,31 (7):1388−1396.
[22] 张琴,文检,郭杰,孙成忠,谢彩香. 药用植物黄花蒿生产区划[J]. 植物保护学报,2018,45(3):503−510. Zhang Q,Wen J,Guo J,Sun CZ,Xie CX. Production regionalization of medicinal sweet wormwood Artemisia annua[J]. Journal of Plant Protection,2018,45 (3):503−510.
[23] 王祎,江源. 野生黄芩有效成分含量的地理差异及与气候因素的关系[J]. 北京师范大学学报(自然科学版),2018,54(5):645−649. Wang Y,Jiang Y. Geographical differentiation of active components in wild Scutellaria baicalensis G. and its correlation with climate factors[J]. Journal of Beijing Normal University(Natural Science)
,2018,54 (5):645−649. [24] 马阳,侯娅,邹立思,刘训红,徐力,兰才武. 不同产地加工方法太子参核苷类成分Q-TRAP-LC-MS/MS分析[J]. 中草药,2015,46(1):43−47. Ma Y,Hou Y,Zou LS,Liu XH,Xu L,Lan CW. Q-TRAP-LC-MS/MS analysis on nucleosides in Pseudostellariae Radix with different processing methods[J]. Chinese Traditional and Herbal Drugs,2015,46 (1):43−47.
[25] 徐荣,江维克,周涛,肖承鸿,杨杰,石海霞. 不同加工干燥方法对太子参药材品质的影响[J]. 中药材,2018,41(12):2802−2806. Xu R,Jiang WK,Zhou T,Xiao CH,Yang J,Shi HX. Effect of different drying methods on quality of Pseudostellariae Radix[J]. Journal of Chinese Medicinal Materials,2018,41 (12):2802−2806.
[26] 曾令杰,林茂兹,李振方,戴林泉,李吉,等. 连作对太子参光合作用及药用品质的影响[J]. 作物学报,2012,38(8):1522−1528. Zeng LJ,Lin MZ,Li ZF,Dai LQ,Li J,et al. Effects of continuous cropping on photosynthesis and medicinal quality of Pseudostellariae heterophylla[J]. Acta Agronomica Sinica,2012,38 (8):1522−1528.
[27] 康传志,周涛,郭兰萍,黄璐琦,朱寿东,肖承鸿. 全国栽培太子参生态适宜性区划分析[J]. 生态学报,2016,36(10):2934−2944. Kang CZ,Zhou T,Guo LP,Huang LQ,Zhu SD,Xiao CH. Ecological suitability and regionalization of Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm. in China[J]. Acta Ecologica Sinica,2016,36 (10):2934−2944.
[28] 武孔云,谢彩香,黄林芳,耿瑞,陈士林. 贵州省太子参适生地等级划分的研究[J]. 中国农业资源与区划,2017,38(10):81−86,106. doi: 10.7621/cjarrp.1005-9121.20171011 Wu KY,Xie CX,Huang LF,Geng R,Chen SL. The land hierarchical classification of Guizhou Heterpphylla[J]. Chinese Journal of Agricultural Resources and Regional Planning,2017,38 (10):81−86,106. doi: 10.7621/cjarrp.1005-9121.20171011
[29] 曾艳萍. 太子参药材的质量评价研究[D]. 南京: 南京中医药大学, 2008: 10-11. [30] 邹立思,侯娅,马阳,刘训红,罗益远. 基于GC-MS分析不同栽培地域太子参中挥发性成分的差异[J]. 中华中医药杂志,2019,34(6):2469−2473. Zou LS,Hou Y,Ma Y,Liu XH,Luo YY. Difference analysis of volatile constituents of Pseudostellariae Radix from different cultivated regions by GC-MS[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2019,34 (6):2469−2473.
[31] 刘训红,谈献和,曾艳萍,董明惠,张月婵. 不同产地太子参的质量比较研究[J]. 现代中药研究与实践,2007,22(2):36−38. Liu XH,Tan XH,Zeng YP,Dong MH,Zhang YC. Comparison of quality of Radix Pseudostellariae from different habitats[J]. Research and Practice of Chinese Medicines,2007,22 (2):36−38.
[32] 侯娅,马阳,邹立思,刘晓,刘训红,陈士林. 基于UPLC-Triple TOF-MS/MS技术分析不同产地太子参的差异化学成分[J]. 质谱学报,2015,36(4):359−366. Hou Y,Ma Y,Zou LS,Liu X,Liu XH,Chen SL. Difference of chemical compositions in Pseudostellariae Radix from different origins by UPLC-Triple TOF-MS/MS[J]. Journal of Chinese Mass Spectrometry Society,2015,36 (4):359−366.
[33] 谢彩香,索风梅,贾光林,宋经元,黄林芳,等. 人参皂苷与生态因子的相关性[J]. 生态学报,2011,31(24):7551−7563. Xie CX,Suo FM,Jia GL,Song JY,Huang LF,et al. Correlation between ecological factors and ginsenosides[J]. Acta Ecologica Sinica,2011,31 (24):7551−7563.
[34] 黄林芳,索风梅,宋经元,温美佳,贾光林,等. 中国产西洋参品质变异及生态型划分[J]. 药学学报,2013,48(4):580−589. Huang LF,Suo FM,Song JY,Wen MJ,Jia GL,et al. Quality variation and ecotype division of Panax quinquefolium in China[J]. Acta Pharmaceutica Sinica,2013,48 (4):580−589.
[35] 康传志,周涛,江维克,郭兰萍,张小波,等. 基于气候因子的全国栽培太子参品质区划分析[J]. 中国中药杂志,2016,41(13):2386−2390. Kang CZ,Zhou T,Jiang WK,Guo LP,Zhang XB,et al. Research on quality regionalization of cultivated Pseudostellaria heterophylla based on climate factors[J]. China Journal of Chinese Materia Medica,2016,41 (13):2386−2390.
[36] 王晓鹏. 安徽皇甫山琅琊山野生太子参生态环境比较研究[J]. 广西植物,2003,23(5):385−390. Wang XP. Comparison of the eco-environment of the wild Pseudostellaria heterophylla in Mt. Huangfu and in Mt. Langya[J]. Guihaia,2003,23 (5):385−390.
[37] 梁平,王洪斌,龙先菊,卢君,袁芳菊. 黔东南州种植太子参的气候生态适宜性分区[J]. 中国农业气象,2008,29(3):329−332. Liang P,Wang HB,Long XJ,Lu J,Yuan FJ. Climatic and ecological suitability division for Radix Pseudostellariae (Pseudostellaria heterophylla Pax ex Pax et Hoffm. ) growing in Southeast Guizhou Prefecture[J]. Chinese Journal of Agrometeorology,2008,29 (3):329−332.
[38] 杨俊,王德群,姚勇,靳雪飞. 野生太子参生物学特性的观察[J]. 中药材,2011,34(9):1323−1328. Yang J,Wang DQ,Yao Y,Jin XF. Observation on biological characteristics of wild Pseudostellaria heterophylla[J]. Journal of Chinese Medicinal Materials,2011,34 (9):1323−1328.
[39] 侯丽娟,王嘉伟,胡静,毛积磊,田孝威. 威海地区太子参高产栽培管理要点[J]. 特种经济动植物,2018,21(5):33−35. doi: 10.3969/j.issn.1001-4713.2018.05.015




 下载:
下载: