Composition and content of anthocyanins and flavonoids in purple-red, pink, and white petals of Bauhinia variegata L.
-
摘要:
本研究选择 3 种不同花色的洋紫荆(Bauhinia variegata L.)为实验材料,应用LC-MS/MS技术分析花青素和类黄酮物质,比较不同花色洋紫荆之间的差异。结果显示,洋紫荆有53 种花青素和340 种类黄酮物质。不同花色洋紫荆花瓣中的花青素差异较大,紫红色花中的锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、飞燕草素-3-O-半乳糖苷等含量较高,粉红色花中的飞燕草素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-槐糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-桑布双糖苷-5-葡萄糖苷等含量较高,白色花中的天竺葵素-3-O-对香豆酰葡萄糖苷等含量较高。白色花中几乎不含天竺葵素-3-O-桑布双糖苷、天竺葵素-3-O-槐糖苷、飞燕草素-3-O-桑布双糖苷等。紫红色花中几乎不含飞燕草素-3-O-槐糖苷。不同花色洋紫荆花瓣中的类黄酮差异较大,粉红色花中的芍药花素-3-O-葡萄糖苷、芍药花素-3,5-O-二葡萄糖苷、金圣草黄素-7-O-芸香糖苷-5-O-葡萄糖苷、异牡荆素-7-O-(6''-芥子酰)葡萄糖苷等含量较白色、紫红色花高。
Abstract:The composition, content, and structure of anthocyanins and flavonoids in purple-red, pink, and white petals of Bauhinia variegata L. were studied to lay a foundation for further investigations of the floral pigment mechanisms and molecular breeding of this species. The anthocyanins and flavonoids were analyzed using liquid chromatography-mass spectrometry (LC-MS/MS). In total, 53 anthocyanins and 340 flavonoids were detected. However, the anthocyanins were markedly different among the different colored petals. Malvidin-3-O-galactoside, malvidin-3-O-glucoside, delphinidin-3-O-galactoside were higher in the purple-red petals than in the white and pink petals. Delphinidin-3-O-(coumaryl)-glucoside, malvidin-3-O-sophoroside, petunidin-3-O-(coumaryl)-glucoside were higher in the pink petals than in the purple-red and white petals. Pelargonidin-3-O-(coumaryl)-glucoside was higher in the white petals than in the purple-red and pink petals. The flavonoids also differed significantly among the different petals. Pelargonidin-3-O-sambubioside-5-O-glucoside, pelargonidin-3-O-sophoroside, and delphinidin-3-O-sambubioside were almost not detected in the white petals and delphinidin-3-O-sophoroside was almost not detected in the purple-red petals, while peonidin-3-O-glucoside, peonidin-3,5-O-diglucoside, chrysoeriol-7-O-rutinoside-5-O-glucoside, and isovitexin-7-O-(6''-sinapoyl) glucoside were higher in the pink than in the white and purple-red petals.
-
Keywords:
- Bauhinia variegata /
- Anthocyanins /
- Flavonoids /
- Petal color
-
洋紫荆(Bauhinia variegata L.),又名宫粉紫荆,为豆科羊蹄甲属落叶乔木,有“南国樱花”之美誉,具有极高的观赏价值,同时也是优质蜜源植物,其花芽、嫩叶和幼果可食,药用价值高[1]。研究表明,洋紫荆所有花色花瓣均不含类胡萝卜素和叶绿素,而含有黄酮类化合物[2]。白色花的总黄酮含量最低,红色花的类黄酮含量最高;类黄酮、花青素含量分别在紫色系、红色系中随着花色加深而增加,且差异显著;白花洋紫荆无花青素存在,表明花青素是洋紫荆花色呈现红色的主要因素[2]。Zhang等[3]的研究表明,洋紫荆花中有46种花青素,其中27种在白花和红花之间存在差异,Malvidin 3-O-galactoside、Peonidin 3-O-galactoside等被认为是洋紫荆花瓣呈红色的原因。
花青素是广泛存在于植物中的一种水溶性色素,有一定的抗氧化能力,其合成后会进行分子修饰形成稳定的物质,其修饰类型包括糖基化、酰基化和甲基化等[4-6]。花色素安全无毒,可作为食品添加剂用于食品着色,在营养保健、防治心血管疾病、抗癌、延缓衰老等方面具有较高的开发价值[7-9]。黄酮能有效地清除体内的氧自由基,是一种很强的抗氧剂[10, 11]。目前,对洋紫荆的研究一般集中在树种特征[12]、种质资源收集[13]、繁育[14]、城市绿化应用[1]及其化学成分研究[15]等方面。洋紫荆最重要的观赏性状是花色,前人仅开展了洋紫荆花瓣中类黄酮、花青素总含量的测定,或白花和红花花青素含量的测定,有关白色、粉红色和紫红色花的花青素、类黄酮物质的组成与含量的差异尚未见报道。本研究采用超高效液相色谱串联质谱(LC-MS/MS)方法,对不同花色洋紫荆花瓣中花青素和类黄酮的组成和含量进行分析,以期为洋紫荆花色形成的机理研究提供基础。
1. 材料与方法
1.1 实验材料
以白色、粉红色、紫红色等3种花色的洋紫荆为实验材料(图1),材料均种植于广州增城林木良种繁育基地,树龄均在10年以上。于2021年3月,每种花色的洋紫荆各随机选取3个单株,白色花瓣的植株编号为BH1~BH3,粉红色为FH1~FH3,紫红色为ZH1~ZH3。每个单株分上、中、下3层随机选取花瓣,混合后置于液氮中带回备用。
1.2 试剂
花青素样品制备及代谢物提取采用的甲醇(Merck,德国)和甲酸(Sigma-Aldrich)为色谱纯,盐酸(信阳市化学试剂厂)为优级纯。矢车菊素-3,5-O-二葡萄糖苷、矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-半乳糖苷和矢车菊素-3-O-葡萄糖苷等标准品购自法国ExtraSynthese公司[16]。
类黄酮样品制备及代谢物提取采用的甲醇(Merck,德国)和乙腈(Merck,德国)均为色谱纯。4-烯丙基儿茶酚、3,4-二羟基苯甲酸、原儿茶酸、5,7-二羟基色酮、白杨素、异甘草素、7-羟基-4'-甲氧基黄烷等标准品均购自BioBioPha/Sigma-Aldrich公司[17]。
1.3 样品制备及代谢物提取
花青素样品制备及代谢物提取:将花瓣放置于冻干机(Scientz-100F,宁波)中真空冷冻干燥。利用研磨仪(MM 400,Retsch,德国)研磨(30 Hz,1.5 min)至粉末状,称取50 mg粉末,溶解于500 μL提取液(50%甲醇水溶液,含0.1%盐酸)中。将溶液涡旋5 min,超声5 min,离心(12000 r/min,3 min),吸取上清,重复操作1次;合并两次上清液,用微孔滤膜(0.22 μm)过滤样品,并保存于进样瓶中[18]。
黄酮类化合物样品制备及代谢物提取:将花瓣放置于冻干机中真空冷冻干燥;利用研磨仪研磨(30 Hz,1.5 min)至粉末状。称取100 mg粉末,溶解于1.2 mL 70%甲醇提取液中[18]。每30 min涡旋一次,每次持续30 s,共涡旋6次,然后样本置于4 ℃冰箱过夜。次日离心(12000 r/min,10 min)后,吸取上清,用微孔滤膜(0.22 μm)过滤样品,并保存于进样瓶中[17]。
1.4 超高效液相色谱串联质谱(LC-MS/MS)
花青素检测数据采集仪器系统的液相条件为:(1)色谱柱:ACQUITY BEH C18 1.7 µm,2.1 mm×100 mm;(2)洗脱梯度:0.00 min B相比例为5%,6.00 min增至50%,12.00 min增至95%,保持2 min,14 min降至5%,并平衡2 min;(3)流动相:A相为超纯水(含0.1%的甲酸),B相为甲醇(含0.1%的甲酸)[19];(4)流速0.35 mL/min;柱温40 ℃;进样量2 μL。
质谱条件主要包括:电喷雾离子源(Electrospray ionization,ESI)温度550 ℃,正离子模式下质谱电压 5 500 V,气帘气(Curtain gas,CUR)35 psi[16]。在Q-Trap 6500 + 中,每个离子对根据优化的去簇电压(Declustering potential,DP)和碰撞能(Collision energy,CE)进行扫描检测。
黄酮类化合物检测数据采集仪器系统液相条件主要包括:(1)色谱柱:Agilent SB-C18 1.8 µm,2.1 mm×100 mm[20];(2)洗脱梯度:0.00 min B相比例为5%,9.00 min内B相比例线性增加到95%,并在95% 维持1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min[21];(3)流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸)[20];(4)流速0.35 mL/min;柱温40 ℃;进样量4 μL[21]。质谱条件主要包括:LIT和三重四极杆(QQQ)扫描[20]。
1.5 统计分析
利用Analyst 1.6.3软件处理质谱数据。以混合标准溶液作为质控样本,每隔10个检测样本插入1个质控样本,通过对同一质控样本的总离子流色谱图(TIC)进行重叠展示分析,判断仪器的稳定性[22]。
通过配制不同浓度的标准品溶液,获取各浓度对应的质谱峰强度数据,绘制不同物质的标准曲线,进行差异代谢物的筛选[16]。
2. 结果与分析
2.1 洋紫荆花瓣中花青素与黄酮类化合物的组成
本研究发现,洋紫荆花瓣中花青素、类黄酮样本质控总离子流色谱图的重叠性较高,保留时间和峰强度均一致(附图1、2
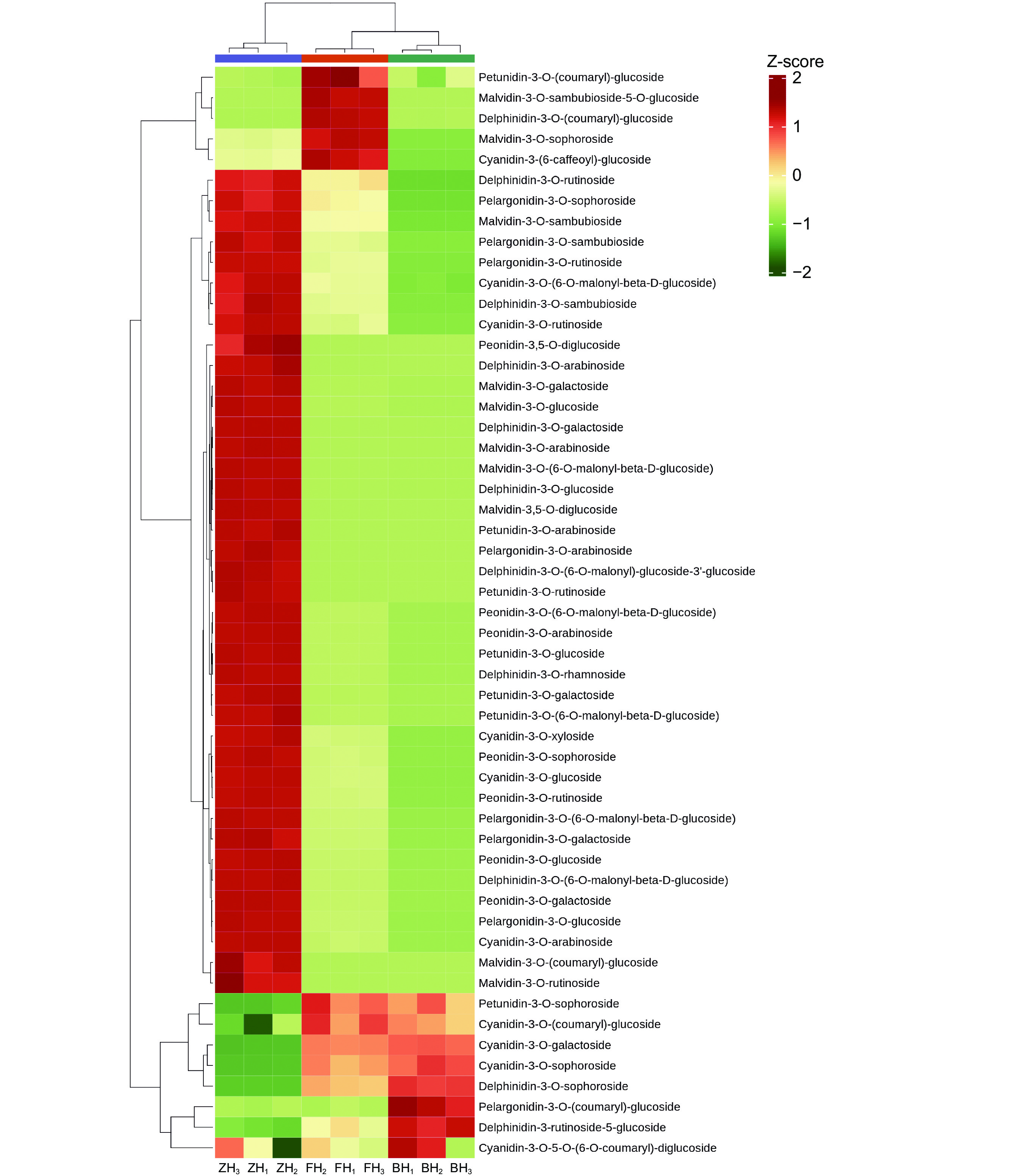
1 ),表明检测期间仪器稳定性较好,数据可信。利用本方法,最终从洋紫荆花瓣样本中检测到53种花青素代谢物,主要包括锦葵色素-3-O-葡萄糖苷、锦葵色素-3-O-半乳糖苷、芍药花色素-3-O-葡萄糖苷等。此外,共鉴定出340种黄酮类化合物,主要成分为芍药花素-3-O-葡萄糖苷、锦葵色素-3-O-(6''-O-丙二酰)葡萄糖苷、5,6,7,5′-四甲氧基-3′,4′-亚甲二氧基黄酮、5,7-二羟基色酮、异杞柳苷(根皮苷查尔酮)、原花青素B3等。2.2 不同花色洋紫荆花青素、类黄酮的成分及含量
对花青素不同成分的含量进行分析,并使用R程序脚本绘制聚类热图,颜色越红表示含量越高。分析结果显示,不同花色洋紫荆间差异明显。紫红色花中的锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、飞燕草素-3-O-半乳糖苷等含量较高;粉红色花中的飞燕草素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-槐糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-桑布双糖苷-5-葡萄糖苷等含量较高;而洋紫荆白色花中的天竺葵素-3-O-对香豆酰葡萄糖苷等含量较高(图2)。此外,白色花中几乎不含天竺葵素-3-O-桑布双糖苷、天竺葵素-3-O-槐糖苷、飞燕草素-3-O-桑布双糖苷等。而紫红色花中几乎不含飞燕草素-3-O-槐糖苷。
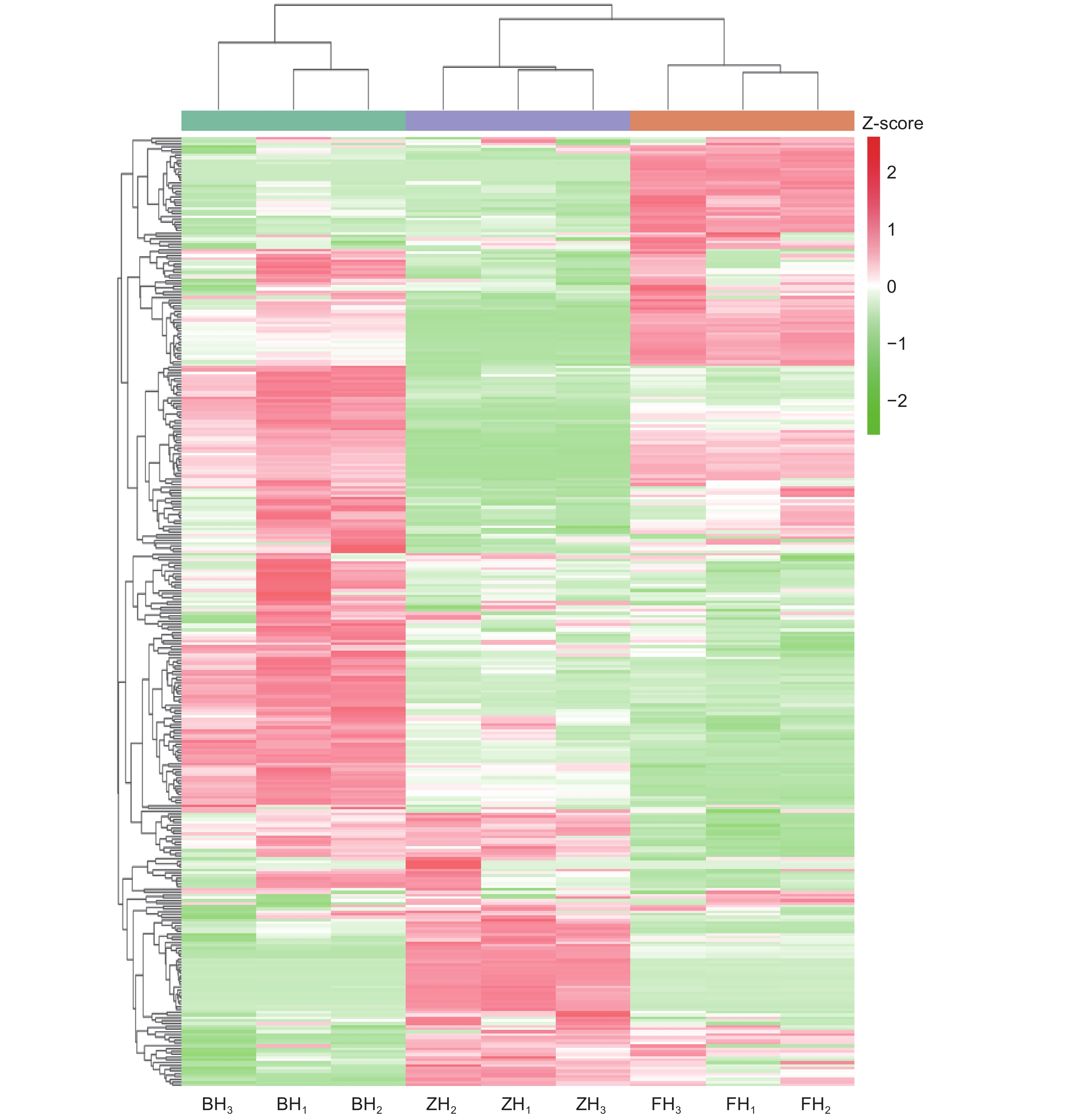
对洋紫荆类黄酮成分的含量数据进行聚类,结果表明,3种花色中,粉红色花中的芍药花素-3-O-葡萄糖苷、芍药花素-3,5-O-二葡萄糖苷、金圣草黄素-7-O-芸香糖苷-5-O-葡萄糖苷、异牡荆素-7-O-(6''-芥子酰)葡萄糖苷等含量较高(图3)。
2.3 不同花色洋紫荆差异代谢物筛选及KEGG通路分析
2.3.1 不同花色洋紫荆差异代谢物筛选
对各组花青素差异代谢物的数目进行统计,发现FH vs ZH组的花青素差异代谢物最多,为36种,BH vs ZH组的差异代谢物有16种,BH vs FH组的差异代谢物有13种(表1)。对类黄酮物质差异代谢物的数目进行统计,发现BH vs ZH组的差异代谢物最多,为116种,FH vs ZH组的差异代谢物有112种,而BH vs FH组的差异代谢物为87种(表2)。
表 1 不同花色洋紫荆花青素差异代谢物数目统计Table 1. Statistics of differential anthocyanin metabolites between groups对比组
Group差异代谢物数目
Number of differential metabolites下调代谢物
Down-regulated metabolites上调代谢物
Up-regulated metabolitesBH vs FH 13 1 12 BH vs ZH 16 3 13 FH vs ZH 36 5 31 表 2 不同花色洋紫荆类黄酮物质差异代谢物数目统计Table 2. Statistics of differential flavonoid metabolites between groups对比组
Group差异代谢物数目
Number of differential metabolites下调代谢物
Down-regulated metabolites上调代谢物
Up-regulated metabolitesBH vs FH 87 50 37 BH vs ZH 116 86 30 FH vs ZH 112 67 45 2.3.2 差异代谢物KEGG通路
对不同对比组的花青素差异代谢物进行注释,结果表明,BH vs FH组在植物代谢、次生物代谢及花青素合成途径注释的代谢物分别为1、1和8个,分别占被注释代谢物总数的12.5%、12.5%和100%;BH vs ZH组在植物代谢、次生物代谢及花青素合成途径注释的代谢物数目分别为1、1、9个,分别占被注释代谢物总数的10%、10%、90%。
不同对比组筛选的花青素差异代谢物映射到3条通路,即花青素合成(ko00942)、植物代谢(ko01100)和次生代谢合成(ko01110)。代谢通路共映射18种物质,包括矮牵牛素-3-O-葡萄糖、飞燕草素-3-O-丙二酰葡萄糖苷、飞燕草素-3-O-对香豆酰葡萄糖苷等。其中花青素合成通路的差异代谢物最多,共有18 种。而天竺葵素-3-O-葡萄糖苷参与了3 条代谢通路。
对不同对比组的类黄酮差异代谢物进行注释,结果表明,BH vs FH组在植物代谢、 类黄酮合成、黄酮和黄酮醇的生物合成、次生代谢物以及花青素合成途径注释的代谢物数目分别为2、7、4、8、7,分别占被注释代谢物总数的10.53%、36.84%、21.05%、42.11%、36.84%。BH vs ZH组在植物代谢、类黄酮合成、黄酮和黄酮醇生物合成、次生代谢物合成以及花青素合成途径注释的代谢物数目分别为2、4、6、6、7,分别占被注释代谢物总数的11.11%、22.22%、33.33%、33.33%、38.89%。
不同对比组筛选的类黄酮差异代谢物映射到6条通路,分别为花青素合成(ko00941)、花青素合成(ko00942)、花青素合成(ko00943)、花青素合成(ko00944)、植物代谢(ko01100)、次生代谢合成(ko01110)。代谢通路共映射60种物质,包括白杨素、橙皮素-7-O-葡萄糖苷、短叶松素、高良姜素、异杞柳苷 (根皮苷查尔酮)、柚皮素-7-O-葡萄糖苷 (樱桃苷)、柚皮素-7-O-新橙皮糖苷(柚皮苷)、紫铆素、紫铆因、柚皮素、芹菜素-8-C-葡萄糖苷 (牡荆素)、槲皮素等。以花青素合成(ko00941)通路的差异代谢物最多,共有27种物质。其中,柚皮素参与了花青素合成(ko00941)、花青素合成(ko00943),植物代谢(ko01100)、次生代谢合成(ko01110)等4 条代谢通路;而槲皮素、木犀草素、山奈酚参与了花青素合成(ko00941)、花青素合成(ko00944)、植物代谢(ko01100)、次生代谢合成(ko01110)等4条代谢通路。
3. 讨论
植物花色的形成受色素组成及含量、细胞pH值、花瓣表皮细胞性状等多种因素影响[23]。洋紫荆花色多样,主要有白色、粉红色和紫红色。本研究从洋紫荆中鉴定出53种花青素代谢物和340种黄酮类化合物,发现不同颜色洋紫荆花瓣中的花青素差异较大,这与Zhang等[3]的研究结果有所不同,该研究只检测到46种花青素,这可能是其只采集了白色和紫红色花瓣,未采集粉红色花瓣所导致。本研究发现不同颜色洋紫荆花瓣中的花青素差异较大,紫红色花中的锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、飞燕草素-3-O-半乳糖苷等含量较高,粉红色花中的飞燕草素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-槐糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-桑布双糖苷-5-葡萄糖苷等含量较高,而白色花中的天竺葵素-3-O-对香豆酰葡萄糖苷等含量较高。白色花中几乎检测不到天竺葵素-3-O-桑布双糖苷、天竺葵素-3-O-槐糖苷、飞燕草素-3-O-桑布双糖苷等。紫红色花中几乎检测不到飞燕草素-3-O-槐糖苷。同时,不同颜色洋紫荆花瓣中的类黄酮差异也较大,粉红色花中的芍药花素-3-O-葡萄糖苷、芍药花素-3,5-O-二葡萄糖苷、金圣草黄素-7-O-芸香糖苷-5-O-葡萄糖苷、异牡荆素-7-O-(6''-芥子酰)葡萄糖苷等含量较高。该研究结果与李群[2]的研究有所不同。研究表明,花青素合成通路对植物花色的形成有重要作用[24]。本研究基于KEGG通路分析,发现不同对比组筛选的花青素差异代谢物映射到花青素合成、植物代谢和次生代谢合成等3条通路,共18种物质,包含矮牵牛素-3-O-葡萄糖、飞燕草素-3-O-丙二酰葡萄糖苷、飞燕草素-3-O-对香豆酰葡萄糖苷等。不同对比组筛选的类黄酮差异代谢物映射到花青素合成、植物代谢、次生代谢合成等6条通路,共60种物质,包括白杨素、橙皮素-7-O-葡萄糖苷、短叶松素、高良姜素、异杞柳苷(根皮苷查尔酮)、柚皮素-7-O-葡萄糖苷(樱桃苷)、柚皮素-7-O-新橙皮糖苷(柚皮苷)、紫铆素、紫铆因、柚皮素、芹菜素-8-C-葡萄糖苷(牡荆素)、槲皮素等。
植物代谢途径交错复杂,不同差异代谢物在代谢途径中的作用还需进一步深入研究[16]。针对山茶(Camellia japonica L.)不同花色品种进行色素种类及含量的测定后发现,花青素生物合成途径相关的矢车菊素和矮牵牛素的含量在红色品种中显著增加[25]。上述结论和本研究结果相一致,即认为花青素合成途径在组织呈色中扮演了关键角色,同时该结论也和植物表型及生理研究结果相吻合。本研究仅初步探索了花青素、类黄酮在洋紫荆不同花色中的代谢差异,今后需进一步联合多组学技术研究洋紫荆不同花色的呈色机制。
1 如需查阅附图内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 不同花色洋紫荆花青素差异代谢物数目统计
Table 1 Statistics of differential anthocyanin metabolites between groups
对比组
Group差异代谢物数目
Number of differential metabolites下调代谢物
Down-regulated metabolites上调代谢物
Up-regulated metabolitesBH vs FH 13 1 12 BH vs ZH 16 3 13 FH vs ZH 36 5 31 表 2 不同花色洋紫荆类黄酮物质差异代谢物数目统计
Table 2 Statistics of differential flavonoid metabolites between groups
对比组
Group差异代谢物数目
Number of differential metabolites下调代谢物
Down-regulated metabolites上调代谢物
Up-regulated metabolitesBH vs FH 87 50 37 BH vs ZH 116 86 30 FH vs ZH 112 67 45 -
[1] 陈勇,唐昌亮,吴忠锋,钱磊,李浩,等. 洋紫荆资源培育及其应用[J]. 中国城市林业,2016,14(6):43−46. Chen Y,Tang CL,Wu ZF,Qian L,Li H,et al. Cultivation of Bauhinia variegata and its application[J]. Journal of Chinese Urban Forestry,2016,14(6):43−46.
[2] 李群. 三种羊蹄甲花色素成分及呈色因子分析[D]. 广州: 华南农业大学, 2018: 35-49. [3] Zhang G,Yang XH,Xu F,Wei D. Combined analysis of the transcriptome and metabolome revealed the mechanism of petal coloration in Bauhinia variegata[J]. Front Plant Sci,2022,13:939299. doi: 10.3389/fpls.2022.939299
[4] Tanaka Y,Sasaki N,Ohmiya A. Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids[J]. Plant J,2008,54(4):733−749. doi: 10.1111/j.1365-313X.2008.03447.x
[5] 戴思兰,洪艳. 基于花青素苷合成和呈色机理的观赏植物花色改良分子育种[J]. 中国农业科学,2016,49(3):529−542. Dai SL,Hong Y. Molecular breeding for flower colors modification on ornamental plants based on the mechanism of anthocyanins biosynthesis and coloration[J]. Scientia Agricultura Sinica,2016,49(3):529−542.
[6] Grotewold E. The genetics and biochemistry of floral pigments[J]. Annu Rev Plant Biol,2006,57:761−780. doi: 10.1146/annurev.arplant.57.032905.105248
[7] 石碧,杜晓. 植物原花色素研究利用进展与发展趋势[J]. 四川大学学报(工程科学版),2006,38(5):16−24. Shi B,Du X. The progress on research and utilization of plant proanthocyanidins[J]. Journal of Sichuan University (Engineering Science Edition)
,2006,38(5):16−24. [8] 姜亚. 天然抗氧化剂原花色素的研究趋势[J]. 广西轻工业,2010,26(10):14−15. [9] 白海娜,王振宇. 花色素研究进展[J]. 中国林副特产,2011,26(5):46−49. Bai HN,Wang ZY. Reserch advances of anthocyanidin[J]. Forest By-Product and Speciality in China,2011,26(5):46−49.
[10] 刘炎. 植物黄酮类化合物功能的研究进展[J]. 科技信息,2012(18):131−132. doi: 10.3969/j.issn.1001-9960.2012.18.112 [11] 梁倩,郑艳玲,刘云,王军民,赵平. 野龙竹竹叶黄酮含量及其抗氧化活性测定实验[J]. 西部林业科学,2013,42(2):110−112. Liang Q,Zheng YL,Liu Y,Wang JM,Zhao P. Flavonoid contents and antioxidant activities of extracts from leaves of Dendrocalamus semiscandens[J]. Journal of West China Forestry Science,2013,42(2):110−112.
[12] 张继方,唐昌亮,罗树凯,钱磊,陈勇. 洋紫荆在广州的适应性及观赏特性调查分析[J]. 热带农业科学,2017,37(8):112−115. Zhang JF,Tang CL,Luo SK,Qian L,Chen Y. Adaptability and ornamental characteristics of Bauhinia variegata in Guangzhou[J]. Chinese Journal of Tropical Agriculture,2017,37(8):112−115.
[13] 魏丹,唐洪辉,赵庆,胡柔璇. 宫粉羊蹄甲种质资源的综合评价研究[J]. 林业与环境科学,2016,32(5):22−30. Wei D,Tang HH,Zhao Q,Hu RX. Integrative evaluation on the germplasm resources of Bauhinia variegata[J]. Forestry and Environmental Science,2016,32(5):22−30.
[14] 胡柔璇,邹伟杰,王裕霞,杨清,魏丹. 洋紫荆的栽培技术研究[J]. 绿色科技,2016(23):41−44,46. Hu RX,Zou WJ,Wang YX,Yang Q,Wei D. Study advances on cultivation techniques in Bauhinia variegata[J]. Journal of Green Science and Technology,2016(23):41−44,46.
[15] 赵燕燕,崔承彬,蔡兵,韩冰,孙启时. 洋紫荆中生物碱类抗肿瘤活性成分的研究[J]. 中国药物化学杂志,2004,14(3):169−171. doi: 10.3969/j.issn.1005-0108.2004.03.011 Zhao YY,Cui CB,Cai B,Han B,Sun QS. Study on the constituents with anticancer activities of alkaloids from Bauhimia variegata L.[J]. Chinese Journal of Medicinal Chemistry,2004,14(3):169−171. doi: 10.3969/j.issn.1005-0108.2004.03.011
[16] 杨蕾,侯慧芳,王敏,洪林,杨海健,等. 基于LC-MS/MS分析‘塔罗科’血橙优系果实花青素组分特征[J]. 食品科学,2022,43(22):281−290. doi: 10.7506/spkx1002-6630-20220111-090 Yang L,Hou HF,Wang M,Hong L,Yang HJ,et al. Analysis of anthocyanin components in superior strain of ‘Tarocco’ blood orange by liquid chromatography tandem mass spectrometry[J]. Food Science,2022,43(22):281−290. doi: 10.7506/spkx1002-6630-20220111-090
[17] 周泳臣,刘颖,郑文忠,高峻,赵一明,等. 两个普洱茶品种的代谢物比较分析[J]. 现代食品科技,2022,38(7):152−159. Zhou YC,Liu Y,Zheng WZ,Gao J,Zhao YM,et al. Comparative analysis of the metabolites in two varieties of Pu-erh tea[J]. Modern Food Science and Technology,2022,38(7):152−159.
[18] 覃艳红,明如宏,姚绍嫦,谭勇,黄鼎. 基于代谢组学的黑老虎果实发育过程中花青苷组分动态分析[J]. 广西中医药大学学报,2022,25(3):40−45. doi: 10.3969/j.issn.2095-4441.2022.03.013 Qin YH,Ming RH,Yao SC,Tan Y,Huang D. Dynamic analysis of anthocyanin components in Kadsura coccinea fruits during fruit development by metabolomics[J]. Journal of Guangxi University of Chinese Medicine,2022,25(3):40−45. doi: 10.3969/j.issn.2095-4441.2022.03.013
[19] 张勉羚,牛丽亚,涂瑾,余莉莉,肖建辉. 不同熟化方式对速冻熟紫薯品质的影响[J]. 食品科学,2023,44(7):48−56. doi: 10.7506/spkx1002-6630-20220322-259 Zhang ML,Niu LY,Tu J,Yu LL,Xiao JH. Effects of different cooking methods on the quality of quick-frozen cooked purple sweet potato[J]. Food Science,2023,44(7):48−56. doi: 10.7506/spkx1002-6630-20220322-259
[20] 陈林,王敏,胡媛,刘友平,陈鸿平,王福. 药用与食用黄精次生代谢产物差异分析及改善胰岛素抵抗的活性成分与作用机制研究[J]. 天然产物研究与开发,2022,34(9):1582−1596. Chen L,Wang M,Hu Y,Liu YP,Chen HP,Wang F. Differential analysis of secondary metabolites of medicinal and edible Polygonati Rhizoma and study on potential active components and mechanism for improving insulin resistance[J]. Natural Product Research and Development,2022,34(9):1582−1596.
[21] 胡媛,吴蓓,易达,陈鸿平,杨放晴,等. 基于广泛靶向代谢组学技术与高通量测序技术探究广陈皮陈化机制[J]. 天然产物研究与开发,2022,34(4):553−562. Hu Y,Wu B,Yi D,Chen HP,Yang FQ,et al. Integration of high throughput sequencing and widely targeted metabolomics reveals the aging mechanism of Pericarpium Citri Reticulatae 'Chachiensis'[J]. Natural Product Research and Development,2022,34(4):553−562.
[22] 刘建新,刘瑞瑞,贾海燕,刘秀丽,卜婷,李娜. 硫化氢对盐碱混合胁迫下裸燕麦叶片类胡萝卜素组成的影响[J]. 植物生理学报,2021,57(11):2213−2223. Liu JX,Liu RR,Jia HY,Liu XL,Bu T,Li N. Effect of hydrogen sulfide on carotenoid composition in leaves of naked oat under salt-alkali mixed stress[J]. Plant Physiology Journal,2021,57(11):2213−2223.
[23] 赵昶灵,郭维明,陈俊愉. 植物花色形成及其调控机理[J]. 植物学通报,2005,22(1):70−81. Zhao CL,Guo WM,Chen JY. Formation and regulation of flower color in higher plants[J]. Chinese Bulletin of Botany,2005,22(1):70−81.
[24] 吴雪霞,张爱东,朱宗文,姚静,查丁石,李贤. 植物花青素生物合成代谢途径及调控因子研究[J]. 上海农业学报,2018,34(4):127−132. Wu XX,Zhang AD,Zhu ZW,Yao J,Zha DS,Li X. Research on plants anthocyanin biosynthesis metabolic pathway and its regulator factors[J]. Acta Agriculturae Shanghai,2018,34(4):127−132.
[25] Fu MY,Yang X,Zheng JR,Wang L,Yang XY,et al. Unraveling the regulatory mechanism of color diversity in camellia japonica petals by integrative transcriptome and metabolome analysis[J]. Front Plant Sci,2021,12:685136. doi: 10.3389/fpls.2021.685136
-
其他相关附件
-
PDF格式
陈勇附图 点击下载(543KB)
-




 下载:
下载: