Effects of light, phosphorus and arbuscular mycorrhizal fungi on Trifolium repens L. growth
-
摘要:
外来植物成功入侵受非生物因素与生物因素的共同调控。本研究以典型入侵植物白车轴草(Trifolium repens L.)为研究对象,通过三因素两水平正交实验,探究光照(L)、磷(P)和丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)及其交互作用对其生长的影响。结果显示:(1)高光照、高磷和接种AMF均显著提高白车轴草的生物量及生长速率,且接种AMF对生物量的促进作用随着光照的增加而增强,低磷条件下AMF对总生物量和相对生长速率的促进效应更明显;(2)高光照降低比叶面积;高磷和接种AMF显著增加叶片数和总叶面积,在高光强下尤为明显;(3)高光照可显著提高根表面积、根直径和根质量分数,但降低细根占比和比根长。高磷显著降低根质量分数。不接种AMF时,高磷增加根表面积与根直径,降低细根长占比;但接种AMF后,高磷则降低根表面积与根直径,增加细根长占比。AMF显著降低根质量分数和比根长。研究结果表明,三种因素对白车轴草的生长具有显著影响,且磷和AMF对其生长及地上性状的影响与光照强度相关,AMF对其地下性状的影响与磷浓度相关。
Abstract:The successful invasion of alien plants is regulated by both abiotic factors (such as changes in aboveground and underground resources) and biological factors (such as mutualistic symbionts). In this study, the typical invasive plant Trifolium repens L. was used to investigate the effects of light, phosphorus, symbiotic arbuscular mycorrhizal fungi (AMF), and their interactions on growth using a three-factor two-level orthogonal experiment. Results showed that: (1) High light, high phosphorus, and AMF inoculation significantlyincreased the biomass and growth rate of T. repens. The promotion effect of AMF inoculation on biomass increased with increasing light, and the promotion effect of AMF on total biomass and relative growth rate was more pronounced under low phosphorus conditions; (2) High light intensity reduced specific leaf area but improved the performance of other aboveground traits, except for root mass fraction. High phosphorus and AMF inoculation significantly increased the number of leaves and total leaf area, which was more obvious under high light intensity; (3) High light intensity significantly increased root surface area, root diameter, and root mass fraction, but decreased the proportion of fine roots and specific root length. The promotion effect of high light intensity on root surface area was higher under low phosphorus. High phosphorus significantly reduced the root mass fraction. In the absence of AMF inoculation, high phosphorus increased the root surface area and root diameter and decreased the proportion of fine root length. However, after inoculation with AMF, high phosphorus reduced the root surface area and root diameter and also increased the proportion of fine root length. AMF significantly reduced the root mass fraction and specific root length. Overall, these results showed that light, phosphorus, and AMF significantly affected T. repens growth, and the intensity of the effects of phosphorus and AMF on growth and aboveground traits was dependent on light intensity, while the intensity of the effects of AMF on underground traits was dependent on phosphorus concentration.
-
外来植物入侵已成为一个全球性的严峻问题。入侵植物往往通过快速生长和繁殖优势占据本地植物的生态位,降低本地生物多样性,破坏生态系统结构和功能[1],对环境、经济和社会造成极大的危害[2, 3]。因此,揭示外来植物成功入侵的机制一直是入侵生态学的核心问题。外来植物的成功入侵与其自身生长速度快、竞争力强、化感作用强、资源获取与利用能力高效[4, 5]密切相关。此外,非生物因素(如地上、地下资源变化)和其他生物因素(如共生微生物)也对外来植物入侵过程具有重要的调控作用[6, 7]。理解这些因素的调控机制将有助于全面系统地解析外来植物成功入侵的过程。
在各种地下资源中,磷(P)是陆地植物的主要限制养分之一[8],也是构成植物光合作用中高能化合物ATP的必需元素[9]。人类活动引起的氮沉降的增加可能加剧土壤磷限制,进而加剧入侵植物与本地植物的竞争[10]。有研究指出,提高氮有效性水平能够加剧入侵植物与本地植物对磷的竞争[11],从而比本地植物获得更多的竞争优势[12, 13]。另外,磷可显著促进豆科植物根瘤的形成,并提高其固氮能力[14]。因此,豆科植物在入侵过程中可能更易受到磷的限制。
作为最重要的地上资源,光照(L)影响入侵植物的生长发育过程。譬如,在正常光照条件下,入侵植物通常比本地植物具有更高的生物量和生长速率;而在低光照条件下,入侵植物的生长可能低于本地植物。光照不仅能够单独影响入侵植物的生长,还可与地下资源耦合,调控其生长发育,进而影响入侵过程[15]。Zhang等[15]对比了4种入侵植物与4种本地植物对不同光照强度与养分水平的响应,发现高光强对入侵植物生长的促进效应要强于本地植物,且在高养分水平下二者的差异更加明显。因此,在探究土壤磷水平对豆科入侵植物生长发育的影响时,也需考虑地上光照强度的差异。
入侵植物生长发育所需要的磷元素不仅可以通过自身根系的吸收获得,还可以通过一些互惠共生的微生物如菌根真菌获得[16]。研究发现,丛枝菌根真菌(Arbuscular mycorrhizal fungal,AMF)在植物入侵过程中发挥着重要作用。大多数入侵植物不仅能够迅速与AMF结合,而且能破坏本地植物与AMF的共生关系,进而促进入侵植物的入侵[17]。AMF对入侵植物入侵的促进作用还取决于土壤养分的高低,因为随着土壤磷可利用性的增加,AMF与植物的相互关系可能从互利共生转化为弱共生或寄生[18, 19]。基于此,在低磷环境中AMF可能促进入侵植物的生长,而在高磷环境中AMF对入侵植物生长的影响可能会减弱。另外,AMF与植物的互惠共生主要体现在AMF可帮助植物吸收土壤中的营养元素(尤其是磷),同时依赖获取植物的光合产物来维持自身的生长和繁殖[17, 20]。因此,AMF与植物的互惠共生关系也会受光照强度的影响。随着光照强度的降低,植物与AMF的共生关系通常会减弱[21]。综上,AMF可能有助于豆科植物在高光强下的生长,且该过程可能还会受到地下磷资源的耦合调控。但在光异质性及养分富集不断加剧的背景下,AMF如何与地下磷水平及地上光照水平相耦合,进而调控入侵植物的生长发育,目前还未见报道。
白车轴草(Trifolium repens L.)为豆科车轴草属多年生草本植物,原产于欧洲,早期作为优质牧草引入我国,逸生为杂草。其匍匐茎生长快,与周围其他植物竞争空间、营养和水分,有较强的竞争能力及很强的入侵性和排他性,极易对周边生态环境和本地植物产生负面影响,从而显著降低本地群落的生物多样性[22, 23]。目前,白车轴草已被列为严重入侵类植物[24]。尽管有研究表明,养分或光照限制均可显著抑制白车轴草的生长[25, 26],而AMF则能显著促进其生长[27],但三者之间的交互作用对白车轴草的生长及其成功入侵的影响却很少受到关注。因此,本文以白车轴草为研究对象,探究光照、磷、AMF及其交互作用对白车轴草生长及其地上、地下性状的影响,研究结果旨在揭示光照、磷和AMF等多因素互作对白车轴草入侵成功的影响机制,以期为入侵植物的防控与治理提供科学依据。
1. 材料与方法
1.1 实验材料
本研究所用的白车轴草种子采购于北京创绿种业。挑选大小一致且籽粒饱满的200粒种子,均匀播撒在经高温灭菌的草炭土表面,保持土壤湿润,待种子萌发,生长至两片子叶完全展开后,进行后续实验。
本研究使用的AMF为Rhizophagus intraradices,采用白车轴草在实验室中进行培养,沙子、蛭石和黑土(体积比为1∶1∶1)混合,经高压灭菌90 min后,作为培养基质。称量25 g菌种,与灭菌培养基质充分混合均匀后,装入体积为2.5 L的花盆中进行培养。培养4个月后,去除白车轴草的地上部分,将其根系剪碎,与培养基质混合均匀,放置于4 ℃冰箱中备用。
盆栽所用的培养基为沙子和蛭石(体积比为1∶1)的混合物,并经121 ℃灭菌30 min。所用容器为高12 cm、顶部直径9 cm、容积为1 L的圆形塑料花盆。
1.2 实验设计与方法
本实验采用光照强度(高光强和低光强)×磷水平(低磷和高磷)×AMF(接种与不接种AMF菌剂)的三因子两水平的完全交互设计,设15个重复,共120盆。
通过不遮阴与遮阴模拟高光强与低光强处理,所用装置为PVC管搭建的6个塑料框架(1 m×0.9 m×1.2 m),其中3个框架罩上两层遮阴网,作为低光强处理,另外3个不罩遮阴网,作为高光强处理。为消除位置效应的影响,材料在温室内完全随机摆放。在晴朗的中午用SpectraPen LM500手持式光谱仪测量框架内的光照强度,遮阴框架内光照强度为(49.0±6.1) μmol·m−2·s−1,不遮阴处理框架内光照强度为(137.4±9.3)μmol·m−2·s−1。
基于前期研究结果[28],低磷和高磷处理为分别在整个实验周期内添加28 mg与2.8 mg的磷。分别使用磷浓度为1 mol/L和0.1 mol/L的改良版霍格兰营养液进行配置,低磷营养液添加4 mL 0.1 mol/L的CaHPO4·2H2O溶液,而高磷营养液添加4 mL 1.0 mol/L的CaHPO4·2H2O溶液,定容至1 L备用。处理时每盆施加16 mL高磷或低磷营养液,每周1次,共10次。
接种AMF处理为向花盆中接种预先培养的20 g AMF菌剂,不接种AMF处理的花盆中加入的是经高温灭菌的20 g AMF菌剂。称取120份低温保存的菌剂,每份20 g(约含300个AMF孢子),将其中60份121 ℃灭菌30 min。再分别将120份AMF菌剂与120份1 L的灭菌基质充分混合,装入花盆中备用。
挑选120株长势一致且健壮的白车轴草幼苗,分别移栽到120个花盆中央,为避免交叉污染,先移栽不接种AMF的花盆,移苗装置经消毒处理后,再移栽接种AMF的花盆。缓苗7 d,期间死亡的幼苗及时选择大小相当、长势一致的幼苗替换。幼苗成活后,测量初始株高,然后进行遮阴和施肥处理。分别将AMF接种或不接种处理的花盆平均分配到光照处理的6个架子中,每个架子包含10个接种与10个不接种AMF的花盆。再分别将接种或不接种AMF的花盆随机分成两组,进行高磷和低磷处理,即每个光照架子下面有5个重复。实验中每个光照水平有3个架子,因此每个处理有15个重复。为了降低位置效应的影响,遮阴处理下的花盆完全随机摆放,且在实验的第30天对每个框架及其中的花盆再进行一次随机摆放。实验于2021年9月25日-12月5日在中国科学院东北地理与农业生态研究所温室(43°59'49"N,125°24'4 "E)进行,温室透光率约为51%,湿度为14%~15%,平均温度为20.3 ℃。
1.3 测定指标与方法
移苗时挑选30株与移栽植株长势一致的幼苗,置于烘箱内65 ℃烘干72 h,称重,用其平均生物量表示白车轴草初始总生物量。处理10周后,所有植株按叶、茎和根分别收获,65 ℃烘干72 h后称重,按如下公式计算植株相对生长率(RGR):
RGR=(M1−M0)/t (1) 式中,
M0 为白车轴草平均初始总生物量,M1 为收获时总生物量,t 为生长时间,单位为d。同时,收获时测量植物地上生长相关指标,包括:叶片数、比叶面积(Specific leaf area,SLA)、叶质量分数(Leaf mass fraction,LMF)、总叶面积(Total leaf area,TLA)和叶厚;地下生长相关指标,包括:比根长(Specific root length,SRL)、根平均直径、细根长占比(Fine root length ratio,FRLR)、根平均表面积和根质量分数。每株选取3~5片健康叶片,测定叶片厚度、叶面积、比叶面积。叶片厚度用叶厚仪测定,叶面积用Canon Lide 220扫描仪扫描,然后用ImageJ软件计算,SLA=扫描叶面积/扫描叶生物量,LMF=叶生物量/总生物量,TLA= SLA×叶生物量;用根系扫描仪对根系进行扫描,然后用WinRHIZO软件对扫描的根部影像进行分析,SRL=扫描根根长/扫描根生物量,FRLR=扫描细根长/扫描总根长。
1.4 数据分析
采用线性混合模型,检验光照、磷、AMF及其交互作用对白车轴草总生物量、相对生长速率、地上生长指标和地下生长指标的影响。将植株初始株高作为协变量,光照水平的架子编号作为随机因子。此外,为确保残差的正态性,对根质量分数、根表面积、根平均直径和细根长占比进行了平方根转化,对总生物量、相对生长速率、叶片数、比根长和叶厚进行了对数转化,对总叶面积进行了立方根转换。使用R 4.1.2软件进行统计分析和绘图。
2. 结果与分析
2.1 3种因素对白车轴草总生物量和相对生长速率的影响
在正常光照条件下,随着磷水平的增加,白车轴总生物量显著增加。在高光照条件下,接种AMF显著提高总生物量和相对生长速率,而在低光照条件下,AMF对总生物量和相对生长速率的促进效应减弱。高磷提高了白车轴草的相对生长速率,特别是在未接种AMF处理中。高光照、高磷和接种AMF均使白车轴草总生物量和相对生长速率显著增加(表1、图1),但三者对白车轴草总生物量和相对生长速率没有明显的交互作用(表1)。
表 1 光照强度、磷和AMF及其交互作用对总生物量和相对生长率的影响Table 1. Effects of light intensity, P, AMF and their interactions on total biomass and relative growth rate固定因子
Fixed effectsdf 总生物量
Total biomass相对生长速率
Relative growth rateχ2 P χ2 P 协变量 1 7.390 0.007 12.088 0.001 光强(L) 1 17.581 <0.001 13.189 <0.001 磷(P) 1 22.612 <0.001 20.820 <0.001 丛植菌根真菌 AMF(A) 1 47.281 <0.001 54.187 <0.001 L×P 1 4.108 0.043 0.342 0.558 L×A 1 20.254 <0.001 8.819 0.003 P×A 1 9.612 0.002 15.332 <0.001 L×P×A 1 0.289 0.591 1.696 0.193 随机因子 SD SD 区组 0.206 0.079 残差 0.552 0.166 注:粗体表示效应显著(P<0.05)。下同。 Note: Bold shows significant effects (P<0.05). Same below. 2.2 光照、磷和AMF对白车轴草地上性状的影响
光照强度和磷对白车轴草叶片数、SLA、总叶面积和叶质量分数表现出显著的交互作用。高光照水平下,高磷显著提高SLA,且对叶片数和总叶面积的促进效应更强,但对叶质量分数则表现出相反的效应。同样,高光照水平下,AMF对叶片数和总叶面积的促进效应更加明显,而在低光照水平下AMF仅提高了叶质量分数(表2、图2)。除SLA显著降低外,高光照显著提高了叶片数、总叶面积和叶厚;高磷提高了叶片数、总叶面积和叶厚;接种AMF则使SLA、叶片数、总叶面积和叶质量分数显著增加(表2、图2)。但光照强度、磷和AMF的交互效应对白车轴草叶片性状的影响不显著(表2)。
表 2 3种因素及其交互作用对叶片数、比叶面积、叶质量分数、总叶面积和叶厚的影响Table 2. Effects of light intensity, P, AMF and their interactions on leaf number, SLA, leaf mass fraction, total leaf area, and leaf thickness固定因子
Fixed effectsdf 叶片数
Leaf number比叶面积
SLA叶质量分数
Leaf mass fraction总叶面积
Total leaf area叶厚
Leaf thicknessχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 − 2.891 0.089 0.405 0.525 1.958 0.162 2.983 0.084 0.301 0.583 光强(L) 1 19.366 <0.001 12.801 <0.001 1.342 0.247 18.849 <0.001 11.930 0.001 磷(P) 1 21.918 <0.001 1.664 0.197 0.433 0.511 17.330 <0.001 7.075 0.008 丛植菌根真菌
AMF(A)1 56.500 <0.001 31.216 <0.001 6.644 0.010 44.478 <0.001 0.257 0.612 L×P 1 5.823 0.016 4.305 0.038 4.082 0.043 6.095 0.014 0.542 0.462 L×A 1 30.580 <0.001 1.207 0.272 6.418 0.011 36.884 <0.001 3.582 0.058 P×A 1 13.130 <0.001 1.952 0.162 2.845 0.092 4.871 0.027 3.512 0.061 L×P×A 1 0.029 0.866 1.237 0.266 0.630 0.427 0.132 0.716 0.422 0.516 随机因子 SD SD SD SD SD 区组 0.054 0.122 0.001 0.119 0.066 残差 0.415 0.250 0.027 0.623 0.103 2.3 光照、磷和AMF对白车轴草地下性状的影响
光照强度和磷对根平均面积具有显著的交互作用,低磷水平下,高光照对根平均面积的促进效应更强(表3、图3)。光照和AMF对根平均直径和比根长的影响具有显著的交互作用,高光照水平下,AMF对根平均直径的增加以及对比根长的降低效应均更强。在根平均面积、根平均直径、根质量分数和细根长占比等性状上,磷和AMF均具有显著的交互作用。AMF在高磷下降低根平均面积,但在低磷下影响不显著;AMF在低磷下提高根平均直径,但在高磷下不显著。AMF在低磷下降低细根长占比,但在高磷下提高细跟长占比。在低磷下,接种AMF使根质量分数下降更多(表3、图3)。高光照降低白车轴草的比根长和细根长占比,但增加根平均面积、根平均直径和根质量分数。高磷显著降低根质量分数。AMF显著增加根平均直径,但降低比根长和根质量分数。光照强度、磷和AMF三者的交互效应对白车轴草根系性状的影响不显著(表3)。
表 3 3种因素及其交互作用对根平均表面积、平均直径、质量分数、比根长和细根长占比的影响Table 3. Effects of light intensity, P, AMF and their interactions on root average area, root average diameter, root mass fraction, specific root length and fine root length ratio固定因子
Fixed effectsdf 根平均面积
Root average area根平均直径
Root average diameter根质量分数
Root mass fraction比根长
Specific root length细根长占比
Fine root length ratioχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 1 0.001 0.971 5.060 0.025 2.114 0.146 7.498 0.006 1.495 0.222 光强(L) 1 14.893 <0.001 9.694 0.002 6.837 0.009 8.471 0.004 7.718 0.006 磷(P) 1 0.015 0.904 2.633 0.105 6.632 0.010 0.253 0.615 3.425 0.064 丛植菌根真菌
AMF(A)1 3.129 0.077 5.015 0.025 79.024 <0.001 6.762 0.009 0.338 0.561 L×P 1 7.840 0.005 0.031 0.861 1.007 0.316 1.338 0.248 0.100 0.752 L×A 1 0.078 0.780 5.776 0.016 1.175 0.278 6.695 0.010 1.620 0.203 P×A 1 4.204 0.040 13.063 <0.001 4.330 0.037 0.338 0.561 15.017 <0.001 L×P×A 1 1.654 0.198 0.234 0.629 0.019 0.890 0.731 0.393 0.040 0.843 随机因子 SD SD SD SD SD 区组 0.245 0.004 0.024 0.049 0.008 残差 0.616 0.014 0.052 0.246 0.024 3. 讨论
土壤磷元素作为植物的主要限制养分之一,对入侵植物的生长具有显著影响。本研究结果表明,土壤磷的增加可显著提高白车轴草生物量及一些地上性状的表现。包国章等[25]研究发现,与低磷相比,高磷显著提高了白车轴草茎、叶、分株及分枝密度。我们的研究显示,尽管高磷改善了白车轴草地上性状的表现,但却降低了其根质量分数。这是因为土壤磷水平的提高缓解了地下资源对植物生长的限制,因此植物倾向于将光合产物分配转向地上部分,以获取更多的光资源,同时降低其根生物量分配,最终优化其整体的资源获取能力[29, 30]。实际上,一些研究也表明,低磷环境下植物会增加根系质量、减小根直径、提高细根数量和比根长,以最低能量损耗来取得最大的吸收表面积[31, 32]。从这个角度来讲,土壤磷变化对豆科入侵植物白车轴草生长的影响与其他植物存在相似之处。
光照作为重要的地上资源,对植物生长的影响存在较强的物种差异性。在低光照条件下,耐阴植物通常能够获得更多的生长优势,而喜阳植物的生物量积累以及地上、地下部的生长则容易受到低光照的负面影响[33-35]。本研究中的白车轴草属喜阳植物,低光照显著抑制了其生物量的积累及相对生长速率,同时,低光照抑制了大部分地上及地下性状的表现,与前人研究结果一致[23, 35]。其主要原因可能是在低光照条件下,地上光资源受限强度超过地下养分限制,因此植物将更多的资源投资于地上性状,或提高原有资源投资的利用效率,如扩展叶片面积、增大比叶面积等,从而使其在低光照环境下获取更多的光资源[36]。光照和磷的变化均会影响植物资源的分配,因此,二者对入侵植物白车轴草的生长可能存在交互效应。本研究发现,高磷对白车轴草生长的促进效应在高光照条件下强于低光照,即磷限制对白车轴草生长的影响存在光照强度依赖性。Baeten等[37]的研究也证实,光限制降低了高磷与低磷对植株生长的影响差异。这与土壤氮素和光照的交互效应对白车轴草生长影响的结果一致,即高氮的促生效应在高光照水平下更加明显[23]。根据李比希的木桶理论,在低光照水平下光资源是植物生长的主要限制因子,因此,养分的增加并不能有效缓解光限制对植物生长的负面效应[38]。
AMF通常与植物形成共利互惠关系,其对外来入侵植物生长的促进作用已得到证实[10, 32]。本研究结果发现,接种AMF能显著促进白车轴草生物量的积累和生长速率,与前人研究结果一致[24]。接种AMF显著提高了叶片数、比叶面积等性状,但降低了地下根质量分数、比根长等。其主要原因可能是当植物与AMF形成互惠共生关系时,植物根系的部分光合产物(4%~20%)用于与AMF的共生消耗,在根外形成庞大的菌丝网络,延伸了根系养分吸收区域[17, 20];同时,较高的地上光合产物有利于促进地上性状[39],因此养分吸收和光合作用同时提高,从而达到资源快速获取和快速生长的目的。Veresoglou等[21]的研究指出,随着光照强度的降低,AMF对植物的促进作用减弱,即AMF对植物的促进作用存在光照强度依赖性。本研究也发现,在低光照水平下,AMF对白车轴草生物量、地上性状以及地下性状的影响减弱。这可能是因为低光照下植物光合产物向共生AMF的转运受限,使其生长受到限制[40, 41],进而削弱了AMF对植物生长的促进作用。但该推论还需要结合测定入侵植物根系的菌根侵染率来进一步验证。
此外,本研究发现AMF和磷对白车轴草的地下性状具有显著的交互作用。总体而言, 不接种AMF时,高磷处理增加了根平均面积与平均直径,降低了细根长占比和根质量分数。该结果符合植物的资源优化策略,即当地下磷受限得到缓解时,优先地上光资源的获取。而在AMF接种后,这些性状的响应不敏感或者朝着资源优化相反的方向进行。因此,最终导致高磷对生长速率的促进效应在不接种AMF时更强,即AMF对白车轴草生长速率的促进效应在低磷水平下更强。Chen等[42]在研究AMF对入侵植物南美蟛蜞菊(Wedelia trilobata (L.) A. S. Hitchc.)的影响时也发现,AMF显著提高了低磷水平下植株的生长速度和抗病性。AMF主要促进植物对土壤中磷的吸收,当土壤磷受限时,植物会增加向AMF的成本投资,进而通过AMF的菌丝网络获取最大的养分吸收效益;而当磷限制缓解时,植株则逐渐减少向AMF的成本投入,从而使AMF的生长受到限制。因此,高磷削弱了AMF对植物生长的促进效应[17, 43]。
外来植物在入侵过程中会同时受到非生物因子和生物因子的影响。本研究发现土壤磷水平和AMF对白车轴草生长的影响存在光照强度依赖性,即在高光照水平下其促进效应更强。此外,AMF对白车轴草的促进效应也具有土壤磷依赖性,在低磷水平下AMF对生长的促进作用更强。本研究结果有助于理解光照、养分等非生物因子和AMF等生物因子变化背景下的外来植物入侵过程。
-
表 1 光照强度、磷和AMF及其交互作用对总生物量和相对生长率的影响
Table 1 Effects of light intensity, P, AMF and their interactions on total biomass and relative growth rate
固定因子
Fixed effectsdf 总生物量
Total biomass相对生长速率
Relative growth rateχ2 P χ2 P 协变量 1 7.390 0.007 12.088 0.001 光强(L) 1 17.581 <0.001 13.189 <0.001 磷(P) 1 22.612 <0.001 20.820 <0.001 丛植菌根真菌 AMF(A) 1 47.281 <0.001 54.187 <0.001 L×P 1 4.108 0.043 0.342 0.558 L×A 1 20.254 <0.001 8.819 0.003 P×A 1 9.612 0.002 15.332 <0.001 L×P×A 1 0.289 0.591 1.696 0.193 随机因子 SD SD 区组 0.206 0.079 残差 0.552 0.166 注:粗体表示效应显著(P<0.05)。下同。 Note: Bold shows significant effects (P<0.05). Same below. 表 2 3种因素及其交互作用对叶片数、比叶面积、叶质量分数、总叶面积和叶厚的影响
Table 2 Effects of light intensity, P, AMF and their interactions on leaf number, SLA, leaf mass fraction, total leaf area, and leaf thickness
固定因子
Fixed effectsdf 叶片数
Leaf number比叶面积
SLA叶质量分数
Leaf mass fraction总叶面积
Total leaf area叶厚
Leaf thicknessχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 − 2.891 0.089 0.405 0.525 1.958 0.162 2.983 0.084 0.301 0.583 光强(L) 1 19.366 <0.001 12.801 <0.001 1.342 0.247 18.849 <0.001 11.930 0.001 磷(P) 1 21.918 <0.001 1.664 0.197 0.433 0.511 17.330 <0.001 7.075 0.008 丛植菌根真菌
AMF(A)1 56.500 <0.001 31.216 <0.001 6.644 0.010 44.478 <0.001 0.257 0.612 L×P 1 5.823 0.016 4.305 0.038 4.082 0.043 6.095 0.014 0.542 0.462 L×A 1 30.580 <0.001 1.207 0.272 6.418 0.011 36.884 <0.001 3.582 0.058 P×A 1 13.130 <0.001 1.952 0.162 2.845 0.092 4.871 0.027 3.512 0.061 L×P×A 1 0.029 0.866 1.237 0.266 0.630 0.427 0.132 0.716 0.422 0.516 随机因子 SD SD SD SD SD 区组 0.054 0.122 0.001 0.119 0.066 残差 0.415 0.250 0.027 0.623 0.103 表 3 3种因素及其交互作用对根平均表面积、平均直径、质量分数、比根长和细根长占比的影响
Table 3 Effects of light intensity, P, AMF and their interactions on root average area, root average diameter, root mass fraction, specific root length and fine root length ratio
固定因子
Fixed effectsdf 根平均面积
Root average area根平均直径
Root average diameter根质量分数
Root mass fraction比根长
Specific root length细根长占比
Fine root length ratioχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 1 0.001 0.971 5.060 0.025 2.114 0.146 7.498 0.006 1.495 0.222 光强(L) 1 14.893 <0.001 9.694 0.002 6.837 0.009 8.471 0.004 7.718 0.006 磷(P) 1 0.015 0.904 2.633 0.105 6.632 0.010 0.253 0.615 3.425 0.064 丛植菌根真菌
AMF(A)1 3.129 0.077 5.015 0.025 79.024 <0.001 6.762 0.009 0.338 0.561 L×P 1 7.840 0.005 0.031 0.861 1.007 0.316 1.338 0.248 0.100 0.752 L×A 1 0.078 0.780 5.776 0.016 1.175 0.278 6.695 0.010 1.620 0.203 P×A 1 4.204 0.040 13.063 <0.001 4.330 0.037 0.338 0.561 15.017 <0.001 L×P×A 1 1.654 0.198 0.234 0.629 0.019 0.890 0.731 0.393 0.040 0.843 随机因子 SD SD SD SD SD 区组 0.245 0.004 0.024 0.049 0.008 残差 0.616 0.014 0.052 0.246 0.024 -
[1] Blackburn TM,Pyšek P,Bacher S,Carlton JT,Duncan RP,et al. A proposed unified framework for biological invasions[J]. Trends Ecol Evol,2011,26(7):333−339. doi: 10.1016/j.tree.2011.03.023
[2] Diagne C,Leroy B,Vaissière AC,Gozlan RE,Roiz D,et al. High and rising economic costs of biological invasions worldwide[J]. Nature,2021,592(7855):571−576. doi: 10.1038/s41586-021-03405-6
[3] Luo YJ,Yuan YF,Wang RQ,Liu J,Du N,Guo WH. Functional traits contributed to the superior performance of the exotic species Robinia pseudoacacia:a comparison with the native tree Sophora japonica[J]. Tree Physiol,2016,36(3):345−355. doi: 10.1093/treephys/tpv123
[4] Van Kleunen M,Weber E,Fischer M. A meta-analysis of trait differences between invasive and non-invasive plant species[J]. Ecol Lett,2010,13(2):235−245. doi: 10.1111/j.1461-0248.2009.01418.x
[5] Zhang ZJ,Liu YJ,Yuan L,Weber E,van Kleunen M. Effect of allelopathy on plant performance:a meta-analysis[J]. Ecol Lett,2021,24(2):348−362. doi: 10.1111/ele.13627
[6] Fahey C,Flory SL. Soil microbes alter competition between native and invasive plants[J]. J Ecol,2022,110(2):404−414. doi: 10.1111/1365-2745.13807
[7] Crawford KM,Bauer JT,Comita LS,Eppinga MB,Johnson DJ,et al. When and where plant-soil feedback may promote plant coexistence:a meta-analysis[J]. Ecol Lett,2019,22(8):1274−1284. doi: 10.1111/ele.13278
[8] 彭昀月,彭慧元,韩文轩. 豆科和非固氮植物氮磷利用效率的比较研究[J]. 中国农业大学学报,2017,22(6):48−55. Peng JY,Peng HY,Han WX. The comparison of nitrogen-and phosphorus-use efficiency between legume and non-nitrogen-fixing plant[J]. Journal of China Agricultural University,2017,22(6):48−55.
[9] Vitousek PM,Porder S,Houlton BZ,Chadwick OA. Terrestrial phosphorus limitation:mechanisms,implications,and nitrogen-phosphorus interactions[J]. Ecol Appl,2010,20(1):5−15. doi: 10.1890/08-0127.1
[10] 刘艳杰,黄伟,杨强,郑玉龙,黎绍鹏,等. 近十年植物入侵生态学重要研究进展[J]. 生物多样性,2022,30(10):22438. doi: 10.17520/biods.2022438 Liu YJ,Huang W,Yang Q,Zheng YL,Li SP,et al. Research advances of plant invasion ecology over the past 10 years[J]. Biodiversity Science,2022,30(10):22438. doi: 10.17520/biods.2022438
[11] Hu CC,Lei YB,Tan YH,Sun XC,Xu H,et al. Plant nitrogen and phosphorus utilization under invasive pressure in a montane ecosystem of tropical China[J]. J Ecol,2019,107(1):372−386. doi: 10.1111/1365-2745.13008
[12] Yu HX,Le Roux JJ,Jiang ZY,Sun F,Peng CL,Li WH. Soil nitrogen dynamics and competition during plant invasion:insights from Mikania micrantha invasions in China[J]. New Phytol,2021,229(6):3440−3452. doi: 10.1111/nph.17125
[13] Li SP,Jia P,Fan SY,Wu YT,Liu X,et al. Functional traits explain the consistent resistance of biodiversity to plant invasion under nitrogen enrichment[J]. Ecol Lett,2022,25(4):778−789. doi: 10.1111/ele.13951
[14] Gentili F,Huss-Danell K. Local and systemic effects of phosphorus and nitrogen on nodulation and nodule function in Alnus incana[J]. J Exp Bot,2003,54(393):2757−2767. doi: 10.1093/jxb/erg311
[15] Zhang ZJ,Liu YJ,Hardrath A,Jin HF,van Kleunen M. Increases in multiple resources promote competitive ability of naturalized non-native plants[J]. Commun Biol,2022,5(1):1150. doi: 10.1038/s42003-022-04113-1
[16] Smith SE,Smith FA,Jakobsen I. Functional diversity in arbuscular mycorrhizal (AM) symbioses:the contribution of the mycorrhizal P uptake pathway is not correlated with mycorrhizal responses in growth or total P uptake[J]. New Phytol,2004,162(2):511−524. doi: 10.1111/j.1469-8137.2004.01039.x
[17] Chen EJ,Liao HX,Chen BM,Peng SL. Arbuscular mycorrhizal fungi are a double-edged sword in plant invasion controlled by phosphorus concentration[J]. New Phytol,2020,226(2):295−300. doi: 10.1111/nph.16359
[18] Johnson NC,Wilson GWT,Wilson JA,Miller RM,Bowker MA. Mycorrhizal phenotypes and the law of the minimum[J]. New Phytol,2015,205(4):1473−1484. doi: 10.1111/nph.13172
[19] Hoeksema JD,Chaudhary VB,Gehring CA,Johnson NC,Karst J,et al. A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi[J]. Ecol Lett,2010,13(3):394−407. doi: 10.1111/j.1461-0248.2009.01430.x
[20] Jiang SJ,Liu YJ,Luo JJ,Qin MS,Johnson NC,et al. Dynamics of arbuscular mycorrhizal fungal community structure and functioning along a nitrogen enrichment gradient in an alpine meadow ecosystem[J]. New Phytol,2018,220(4):1222−1235. doi: 10.1111/nph.15112
[21] Veresoglou SD,Chen BD,Fischer MM,Helgason T,Mamolos AP,et al. Latitudinal constraints in responsiveness of plants to arbuscular mycorrhiza:the ‘sun-worshipper’ hypothesis[J]. New Phytol,2019,224(2):552−556. doi: 10.1111/nph.15918
[22] 黄玉梅,张凯,孙凌霞,张健,李三月,等. 白三叶(Trifolium repens)入侵对城市草坪生态系统土壤动物的影响[J]. 生态学报,2018,38(23):8489−8499. Huang YM,Zhang K,Sun LX,Zhang J,Li SY,et al. Effects of Trifolium repens invasion on soil animals in an urban turf ecosystem[J]. Acta Ecologica Sinica,2018,38(23):8489−8499.
[23] Santangelo JS,Ness RW,Cohan B,Fitzpatrick CR,Innes SG,et al. Global urban environmental change drives adaptation in white clover[J]. Science,2022,375(6586):1275−1281. doi: 10.1126/science.abk0989
[24] 马金双, 李惠茹. 中国外来入侵植物名录[M]. 北京: 高等教育出版社, 2018: 1-200. [25] 包国章,李向林,房春生,谢忠雷,沈万斌. 土壤速效磷浓度对白三叶构型及能量分配的影响[J]. 草地学报,2001,9(4):265−268,282. Bao GZ,Li XL,Fang CS,Xie ZL,Shen WB. Effect of quick-acting phosphorous concentration in soil on the architecture and energy allocation of Trifolium repens[J]. Acta Agrestia Sinica,2001,9(4):265−268,282.
[26] 安慧,上官周平. 光照强度和氮水平对白三叶幼苗生长与光合生理特性的影响[J]. 生态学报,2009,29(11):6017−6024. An H,Shangguang ZP. Effects of light intensity and nitrogen application on the growth and photosynthetic characteristics of Trifolium repens L.[J]. Acta Ecologica Sinica,2009,29(11):6017−6024.
[27] 王晓英,王冬梅,陈保冬,黄益宗,王幼珊. 丛枝菌根真菌群落对白三叶草生长的影响[J]. 生态学报,2010,30(6):1456−1462. Wang XY,Wang DM,Chen BD,Huang YZ,Wang YS. Growth response of white clover to inoculation with different arbuscular mycorrhizal fungi communities[J]. Acta Ecologica Sinica,2010,30(6):1456−1462.
[28] Zhang Z,Pan MX,Zhang X,Liu YJ. Responses of invasive and native plants to different forms and availability of phosphorus[J]. Am J Bot,2022,109(10):1560−1567. doi: 10.1002/ajb2.16081
[29] Gruber BD,Giehl RFH,Friedel S,von Wirén N. Plasticity of the Arabidopsis root system under nutrient deficiencies[J]. Plant Physiol,2013,163(1):161−179. doi: 10.1104/pp.113.218453
[30] Motte H,Vanneste S,Beeckman T. Molecular and environmental regulation of root development[J]. Annu Rev Plant Biol,2019,70:465−488. doi: 10.1146/annurev-arplant-050718-100423
[31] Lambers H,Shane MW,Cramer MD,Pearse SJ,Veneklaas EJ. Root structure and functioning for efficient acquisition of phosphorus:matching morphological and physiological traits[J]. Ann Bot,2006,98(4):693−713. doi: 10.1093/aob/mcl114
[32] He HH,Peng Q,Wang X,Fan CB,Pang JY,et al. Growth,morphological and physiological responses of alfalfa (Medicago sativa) to phosphorus supply in two alkaline soils[J]. Plant Soil,2017,416(1-2):565−584. doi: 10.1007/s11104-017-3242-9
[33] 王艺,韦小丽. 不同光照对植物生长、生理生化和形态结构影响的研究进展[J]. 山地农业生物学报,2010,29(4):353−359. Wang Y,Wei XL. Advance on the effects of different light environments on growth,physiological biochemistry and morphostructure of plant[J]. Journal of Mountain Agriculture and Biology,2010,29(4):353−359.
[34] 尹慧,安莹,陈雅君,陈阳,孙佳林,等. 不同遮阴强度下白三叶形态特征和生长动态[J]. 中国草地学报,2015,37(5):86−91. Yin H,An Y,Chen YJ,Chen Y,Sun JL,et al. Effect of light intensity on morphological characteristic and growth index of Trifolium repens L. cv. ‘Longping No. 1’[J]. Chinese Journal of Grassland,2015,37(5):86−91.
[35] Weijschedé J,Martínková J,de Kroon H,Huber H. Shade avoidance in Trifolium repens:costs and benefits of plasticity in petiole length and leaf size[J]. New Phytol,2006,172(4):655−666. doi: 10.1111/j.1469-8137.2006.01885.x
[36] Yano S,Terashima I. Developmental process of sun and shade leaves in Chenopodium album L.[J]. Plant Cell Environ,2004,27(6):781−793. doi: 10.1111/j.1365-3040.2004.01182.x
[37] Baeten L,Vanhellemont M,de Frenne P,de Schrijver A,Hermy M,Verheyen K. Plasticity in response to phosphorus and light availability in four forest herbs[J]. Oecologia,2010,163(4):1021−1032. doi: 10.1007/s00442-010-1599-z
[38] Cheaïb A,Mollier A,Thunot S,Lambrot C,Pellerin S,Loustau D. Interactive effects of phosphorus and light availability on early growth of maritime pine seedlings[J]. Ann For Sci,2005,62(6):575−583. doi: 10.1051/forest:2005050
[39] Kramer-Walter KR,Laughlin DC. Root nutrient concentration and biomass allocation are more plastic than morphological traits in response to nutrient limitation[J]. Plant Soil,2017,416(1-2):539−550. doi: 10.1007/s11104-017-3234-9
[40] Zheng CY,Ji BM,Zhang JL,Zhang FS,Bever JD. Shading decreases plant carbon preferential allocation towards the most beneficial mycorrhizal mutualist[J]. New Phytol,2015,205(1):361−368. doi: 10.1111/nph.13025
[41] Bennett JA,Klironomos J. Mechanisms of plant-soil feedback:interactions among biotic and abiotic drivers[J]. New Phytol,2019,222(1):91−96. doi: 10.1111/nph.15603
[42] Chen Q,Wu WW,Qi SS,Cheng H,Li Q,et al. Arbuscular mycorrhizal fungi improve the growth and disease resistance of the invasive plant Wedelia trilobata[J]. J Appl Microbiol,2021,130(2):582−591. doi: 10.1111/jam.14415
[43] Bennett AE,Groten K. The costs and benefits of plant-arbuscular mycorrhizal fungal interactions[J]. Annu Rev Plant Biol,2022,73:649−672. doi: 10.1146/annurev-arplant-102820-124504
-
期刊类型引用(0)
其他类型引用(1)



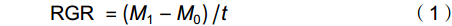
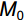
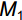
 下载:
下载:



