Geographic patterns of leaf functional traits and environmental drivers of national key protected wild plant Davidia involucrata Baillon
-
摘要:
以国家重点保护植物珙桐(Davidia involucrata Baillon)为研究对象,对其分布区内18个种群的17项叶片功能性状进行测量,探究叶功能性状的地理格局与对异质环境的适应机制。结果显示,在局域尺度上,珙桐叶片功能性状变异系数介于1.48%~24.81%,其中,叶碳磷比变异程度最大,叶有机质含量变异最小。随着经度或纬度的增加,珙桐叶片叶锯齿数、叶面积、叶厚度显著降低。随着海拔的增加,珙桐叶片叶磷含量、叶面积、叶厚度、叶干物质含量显著增加,珙桐叶片形状变得更宽且更近于圆形。叶片边缘锯齿增强了珙桐叶片对于寒冷的适应性。环境因子解释了79.90%的珙桐叶片性状变异,该变异主要由地理变量与气候因子驱动,同时受到土壤因子的影响。年降水和土壤氮元素是叶片性状变异的最强解释因子,随着降水增加或者土壤氮元素减少,叶片变得小且薄。研究结果说明,珙桐叶片功能性状在物种分布区尺度上呈现出明显的地理格局,其中降水、土壤氮元素含量在地理格局的形成中发挥了重要的作用。
Abstract:The geographical patterns of plant functional traits and their environmental drivers remain central questions in plant population ecology. Leaf functional traits can directly affect the physiological and biochemical processes of plants, reflecting resource acquisition strategies and adaptation mechanisms. In this paper, we measured 17 functional traits of 18 populations of the national key protected wild plant Davidia involucrata Baillon across its natural distribution range in China, and analyzed the geographical patterns of leaf functional traits and their adaptation mechanisms to heterogeneous environments. At the local scale, the coefficients of variation of leaf traits ranged from 1.48% to 24.81%. The variation degree in the leaf carbon phosphorus ratio was the largest, while the variation degree of leaf organic carbon content was the smallest. With increasing longitude and latitude, leaf area, thickness, and serration number decreased significantly. With increasing altitude, leaf thickness, dry matter content, area, and phosphorus content increased significantly, while leaf shape became wider and rounder. Leaf serration enhanced the adaptability of D. involucrata leaves to cold. Significant leaf trait-geography correlations were mediated by climatic and/or soil factors. Environmental factors explained 79.90% of the variation in D. involucrata leaf traits, with variation of leaf traits mainly driven by geographical variables, climatic factors, and soil factors. Annual precipitation and soil nitrogen content were the strongest explanatory factors for leaf trait variation, with increasing precipitation or decreasing soil nitrogen leading to smaller and thinner leaves. In general, the functional traits of D. involucrata leaves showed a clear pattern at the species distribution scale, with precipitation and soil nitrogen content playing an important role in the formation of geographical patterns.
-
Keywords:
- Davidia involucrata /
- Leaf traits /
- Environmental factors /
- Phenotypic variation /
- Protected plant
-
在长期进化过程中,植物为适应环境变化而形成的形态、生理和物候特征称之为功能性状[1]。叶片是植物进行光合作用和蒸腾作用的主要器官,是植物与外界进行水、气交换的重要门户[2]。叶片功能性状是植物功能性状的重要指标,能够反映植物光合作用、资源利用策略及植物对于生长环境的适应[3],具有重要的生态学和生物进化意义[4]。
近年来,叶功能性状的地理格局及其与环境因子的关联成为植物生态学研究的热点之一[5-7]。叶大小、比叶面积与叶厚度等叶片功能性状地理分布的主要驱动因子是气候,在降水充沛、温暖且光辐射较弱的区域,植物一般具有较大的叶面积、比叶面积和较小的叶厚度,而在干旱、土壤贫瘠、寒冷且光辐射较强的区域,植物通常具有较大的叶厚度和较小的叶面积、比叶面积[8],以避免叶片过热或减少水分损失[9]。Li等[10]对中国木本植物的研究发现,叶片平均大小从中国东南到西北逐渐减小。Meng等[5]对领春木(Euptelea pleiospermum Hook. f. & Thomson)叶功能性状地理格局的研究发现,随着纬度增加,领春木叶周长、比叶面积显著增加,叶密度显著降低;而随着经度增加,叶面积显著增加。植物叶面积通常随海拔升高而减小,叶厚度随海拔升高而增加[11],但也存在与之相反的情况[12]。多数研究使用了物种平均值来研究叶片性状与环境之间的关系[13, 14],而研究表明种内性状变异与种间性状变异同样十分重要[15, 16]。已经证实,种内变异可以影响物种分布[17]、群落构建[18]、生态系统功能[19]和功能多样性指数[20]。Albert 等[21]发现种内性状变异在不同性状和物种间差异明显,且受环境影响较大。多物种分析结果显示,某些植物性状的种内变异高达40%[15]。 Siefert等[16]在对全球数据集的荟萃分析中,将25%的群落内变异和32%的群落间变异归因于种内性状差异。因此,研究植物种内性状变异及其对环境因子的响应,对于认识其对环境异质性的适应机制,促进生物多样性保护具有重要意义。
珙桐(Davidia involucrata Baillon),又名鸽子树,为蓝果树科珙桐属落叶乔木[22],被列为国家 Ⅰ 级重点保护野生植物。珙桐是我国特有的第三纪古热带植物区系的孑遗种,在第四纪气候变化过程中,其种群规模持续减少[23]。从始新世-渐新世到更新世,在温带北半球曾广泛分布着具有类似叶和果形态的同属物种,在第四纪气候波动中,只有分布于中国西南及其邻近地区的珙桐种群幸存下来[24]。珙桐以其美丽的花而闻名,开花时节,两片白色苞片覆盖着花冠,像展翅飞翔的鸽子,具有很高的观赏价值。目前,国内外学者对珙桐的群落特征与种间关系[25]、种群结构与动态[26]、苞片形态与功能[27]、遗传多样性与遗传结构[23]、谱系地理学[28]、人工引种与种质资源保存[29]等方面进行了研究。而关于珙桐叶片功能性状变异及其对环境响应方面的研究鲜有报道[30],尤其是在物种分布区尺度上。本研究以保护植物珙桐为研究对象,在分布区尺度上测定18个种群的17项叶片功能性状,结合10项环境因子,分析珙桐叶片功能性状的种内变异及其与环境因子的关系,探究珙桐叶功能性状的地理格局与对异质环境的适应机制。深入研究其生态策略和地理分布的驱动因素,以期为珙桐的保护方案优化提供理论基础。
1. 材料与方法
1.1 珙桐分布区域
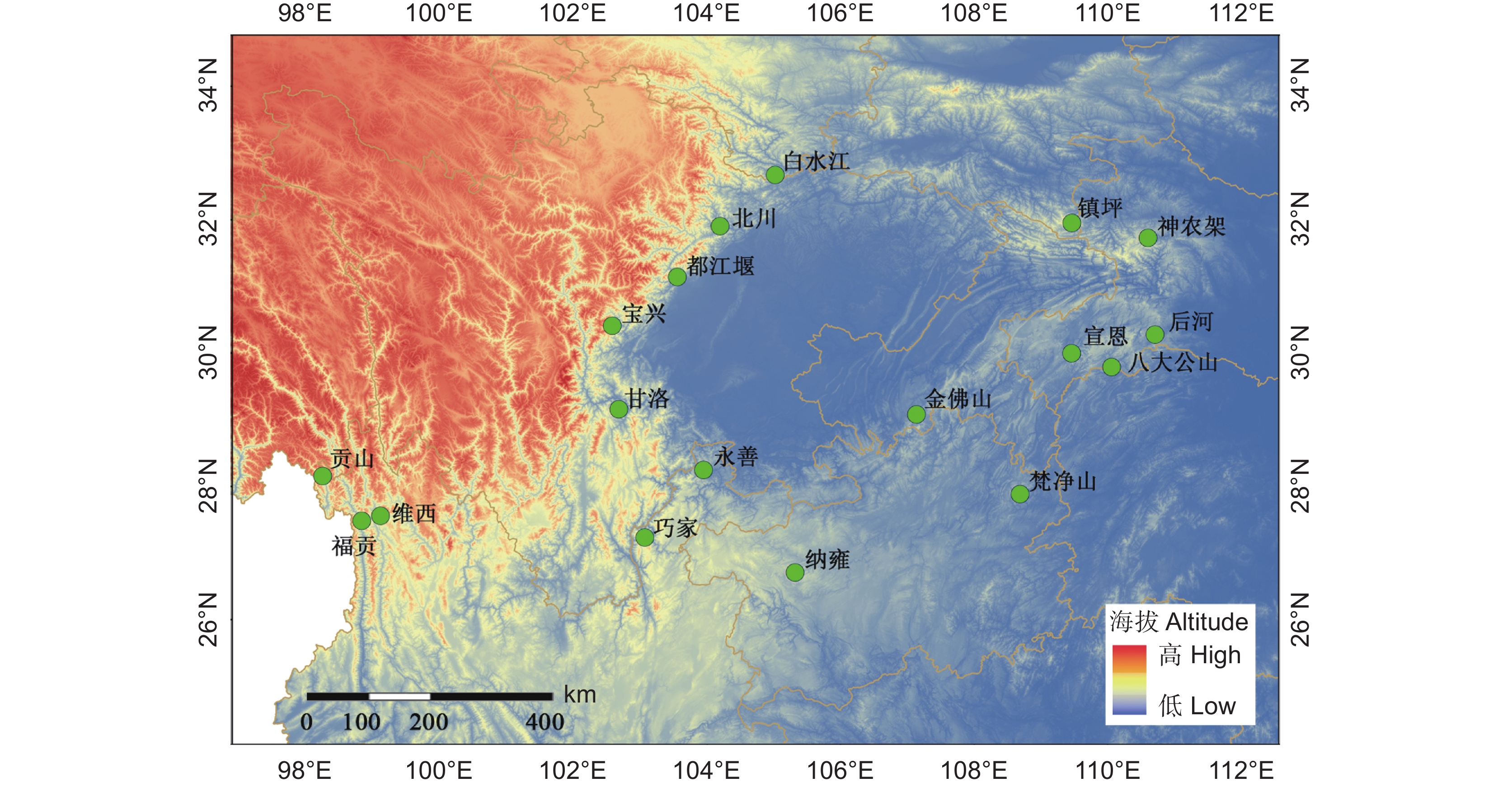
目前,珙桐野生种群仅分布于我国长江流域的湿润亚热带山地(图1),在贵州、湖南、湖北、陕西、云南、甘肃、四川和重庆 8个省市均有分布[31],分布范围为26.71°~32.67°N,98.27°~111.54°E,海拔为600~3 000 m。珙桐自然分布区地貌以丘陵、中山和山地峡谷为主,集中分布于山坡沟谷。年均温度9 ℃~12 ℃,年均降水量700~1 500 mm,土壤呈酸性,pH值为4.00~6.81(附表1
1 )。1.2 样品采集与参数指标测定
在珙桐分布范围内8个省(直辖市)的18个样点采集了珙桐叶片样品,记录各采样点的经纬度和海拔信息(图1、附表1)。每个采样点相距至少30 km,每个个体相距至少10 m,每个个体采集约30片无虫食、成熟的叶片。本研究共采集个体390株,叶片11 646片,叶片样本现场称重并扫描后置于信封中带回实验室。土壤采样采用5点交叉采样法,钻取5个深度为25 cm的土样,混匀后装入自封袋带回实验室,去除杂质并置于阴凉处自然风干,以测定土壤化学指标。
每株个体随机挑选30片完整叶片,用叶绿素仪测量其叶绿素含量。使用电子天平称取鲜重,并用游标卡尺测量叶厚度。将叶片平铺于扫描仪中进行扫描,叶片图片用万深 LA-S 叶分析软件进行批量处理,计算叶长、叶宽、叶长宽比、叶面积、叶周长、叶形状因子、叶锯齿数 (公式1)。将扫描后的叶片置于80 ℃烘箱,48 h后取出,测定干重。计算得到比叶面积和叶干物质含量。在植株个体水平混合测样,叶磷含量采用钼锑抗比色法测定,叶碳含量和叶氮含量采用碳氮元素分析仪测定,最后计算得到碳氮比、碳磷比和氮磷比。
土壤有机质含量使用重铬酸钾容量法测定,土壤pH值使用酸度计测定,土壤硝态氮使用紫外分光光度法测定,土壤铵态氮使用纳氏试剂比色法测定,土壤有效磷使用钼锑抗比色法测定。从世界气候数据库WorldClim (http://www.worldclim.org/) 获取气候数据[32]。
叶形状因子=4π叶面积叶周长2 (1) 1.3 数据处理
将样点(单一种群)内定义为局域尺度,将整个采样区域定义为区域尺度,计算叶片性状的最大值、最小值、平均值、倍数范围(最大值除以最小值)和变异系数。对环境因子数据进行正态检验,不满足正态分布数据进行转换以满足正态分布和方差齐性。分析使用个体水平数据,采用Pearson相关分析珙桐叶片功能性状之间、叶功能性状和环境因子之间的相关性,使用Holm-Boferroni校正P值。在进行(Redundancy analysis,RDA)冗余分析之前,先进行降趋对应分析(Detrended correspondence analysis,DCA),当DCA 分析结果中排序轴梯度最大值小于 3 时,选择RDA分析环境因子对珙桐叶片功能性状的影响。数据处理采用 R 4.2.2和Canoco 5.0软件完成。
2. 结果与分析
2.1 叶片性状变异
研究结果显示,珙桐叶片功能性状的变异倍数范围为1.06~4.77倍。在局域尺度上,叶片功能性状变异系数为1.48%~24.81%;在区域尺度上,变异系数为2.02%~18.64%。在局域尺度上,变异系数最大的 5个性状分别是:叶碳磷比、叶磷含量、比叶面积、叶氮磷比和叶面积,其中叶碳磷比是变异最大的叶片性状。在区域尺度上,比叶面积是变异程度最大,其次是叶磷含量和叶碳磷比,叶有机质含量是变异程度最小的性状。半数以上叶片性状的局域变异系数都大于区域变异系数,其中6个叶片性状(叶周长、叶长宽比、叶形状因子、叶绿素含量、叶干物质含量、叶有机质含量)则相反(表1)。
表 1 珙桐叶片功能性状的变异系数Table 1. Leaf trait variations in Davidia involucrata性状
Trait最大值
Maximum最小值
Minimum平均值
Mean value倍数
Fold局域变异系数
Local CV / %区域变异系数
Regional CV / %叶面积LA / cm2 199.86 50.36 107.01 3.97 15.91 14.66 叶周长LP / cm 92.83 45.57 64.31 2.04 6.27 8.83 叶长LL / cm 20.23 10.46 14.97 1.93 7.82 7.41 叶宽LW / cm 15.19 7.41 10.94 2.05 7.84 7.58 叶长宽比LWR 1.70 1.19 1.38 1.43 3.67 4.30 叶形状因子LSF 0.61 0.18 0.33 3.36 11.54 12.63 叶锯齿数LSN 134.23 29.80 80.78 4.50 11.60 11.45 叶绿素含量LCH(SPAD) 50.52 23.72 38.10 2.13 6.83 9.01 叶干物质含量LDMC / mg/g 393.26 172.11 270.98 2.28 9.36 10.55 比叶面积SLA / m2/kg 58.99 12.37 28.55 4.77 21.07 18.64 叶厚度LT / mm 0.32 0.11 0.21 3.02 13.23 10.18 叶有机质含量LOC / mg/g 467.54 440.36 450.42 1.06 1.48 2.02 叶磷含量LTP / mg/g 3.43 1.34 1.88 2.56 24.39 15.90 叶氮含量LTN / mg/g 36.10 22.23 28.67 1.62 11.05 9.93 叶碳氮比LCN 20.39 12.95 15.89 1.57 10.49 9.93 叶碳磷比LCP 13.00 4.16 8.92 3.13 24.81 15.50 叶氮磷比LNP 21.04 9.05 15.82 2.33 17.73 13.29 注:区域变异系数为所有采样点性状变异系数平均值;局域变异系数为各采样点内平均性状的变异系数。CV:变异系数;LA:叶面积; LP:叶周长; LL:叶长; LW:叶宽; LWR:叶长宽比; LSF:叶形状因子; LSN:叶锯齿数; LCH:叶绿素含量; LDMC:叶干物质含量; SLA:比叶面积; LT:叶片厚度; LOC:叶有机质含量; LTP:叶磷含量; LTN:叶氮含量; LCN:叶碳氮比; LCP:叶碳磷比; LNP:叶氮磷比。 Notes: Regional trait CV, CV of mean trait values in each site; Local trait CV, average trait CV of within site leaf samples. CV: Coefficient of variation; LA: Leaf area; LP: Leaf perimeter; LL: Leaf length; LW: Leaf width; LWR: Length/width; LSF: Leaf shape factor; LSN: Leaf serration number; LCH: Leaf chlorophyll content; LDMC: Leaf dry matter content; SLA: Specific leaf area; LT: Leaf thickness; LOC: Leaf organic carbon content; LTP: Leaf phosphorus content; LTN: Leaf nitrogen content; LCN: Leaf organic carbon/nitrogen content; LCP: Leaf organic carbon/phosphorus content; LNP: Leaf nitrogen/phosphorus content. 2.2 叶片性状之间的相关性
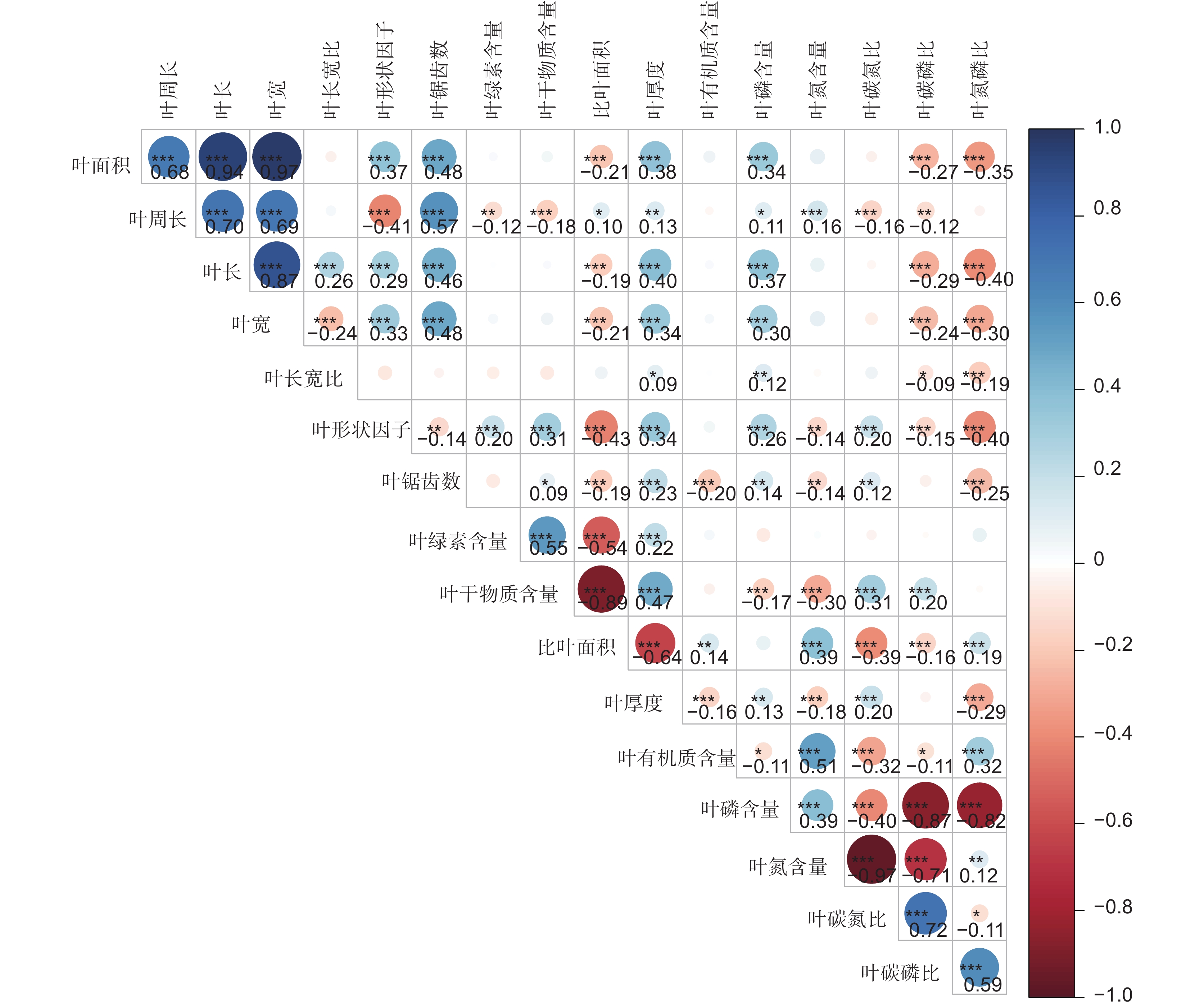
叶功能性状之间的相关分析结果表明(图2),在叶片的形态特征方面,叶长、叶宽、叶面积、叶周长之间相互呈极显著正相关(P<0.001)。叶绿素含量与叶干物质含量、叶厚度显著正相关,与比叶面积呈极显著负相关。叶形状因子与比叶面积、叶氮磷比呈极显著负相关。叶生态化学计量特征方面,叶有机质含量与叶氮含量呈极显著正相关。叶碳磷比与叶氮磷比呈极显著正相关。
2.3 环境因子与叶片性状的关系
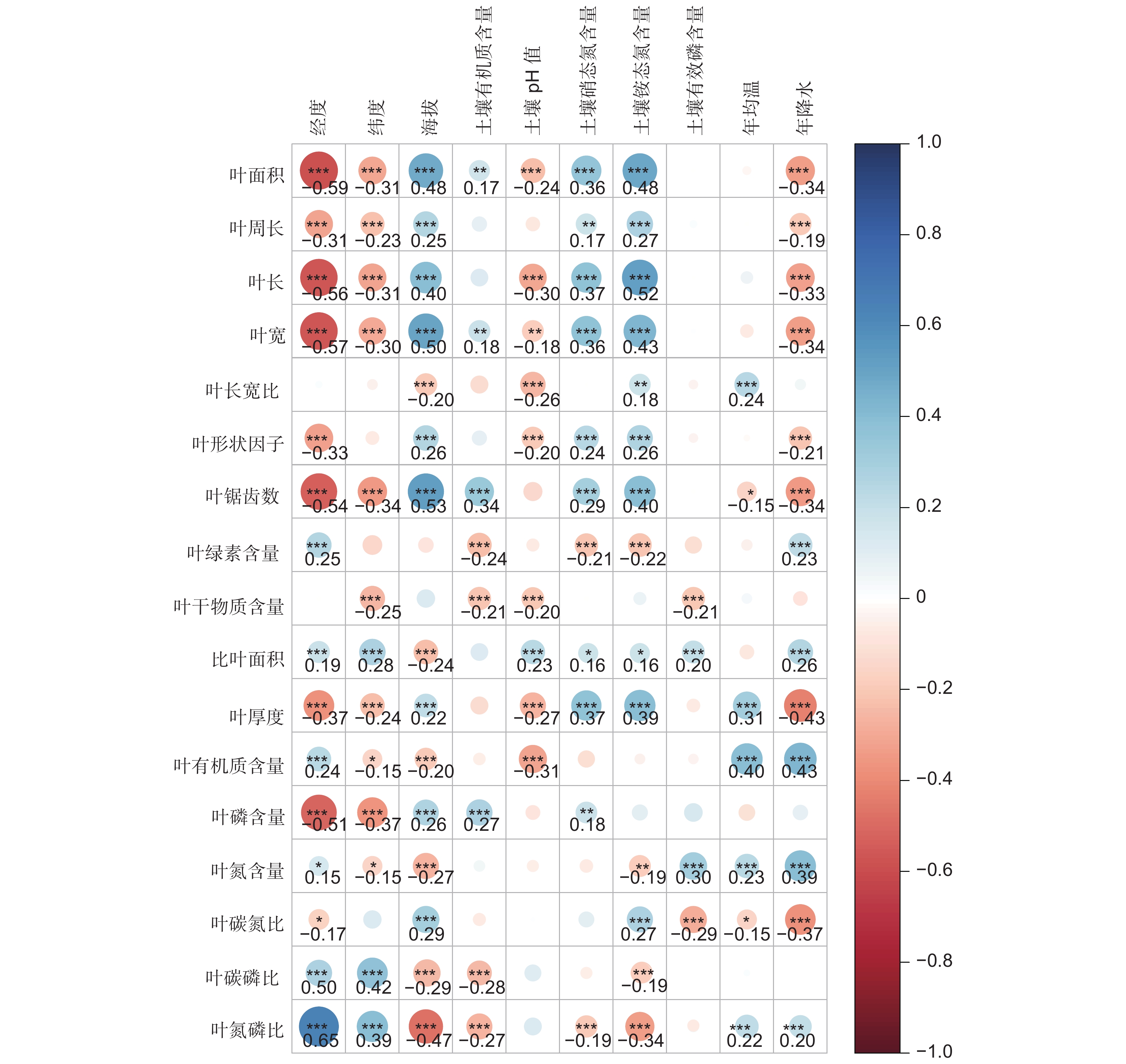
叶功能性状与经纬度、海拔以及土壤和气候的相关性分析结果显示(图3),叶面积、叶长、叶宽、叶锯齿数都分别与经度、纬度、降水呈极显著负相关,与海拔呈现极显著正相关(P<0.001)。叶长宽比与海拔呈现极显著负相关,叶形状因子与海拔呈现极显著正相关,与经度呈极显著负相关。叶有机质含量与经度、年均温、年降水显著正相关,与海拔、土壤pH值呈极显著负相关。叶磷含量与经度、纬度呈现极显著负相关,与海拔、土壤有机质含量呈极显著正相关。叶碳磷比、叶氮磷比都与经度、纬度呈现极显著正向相关,与海拔呈极显著负相关。
2.4 冗余分析
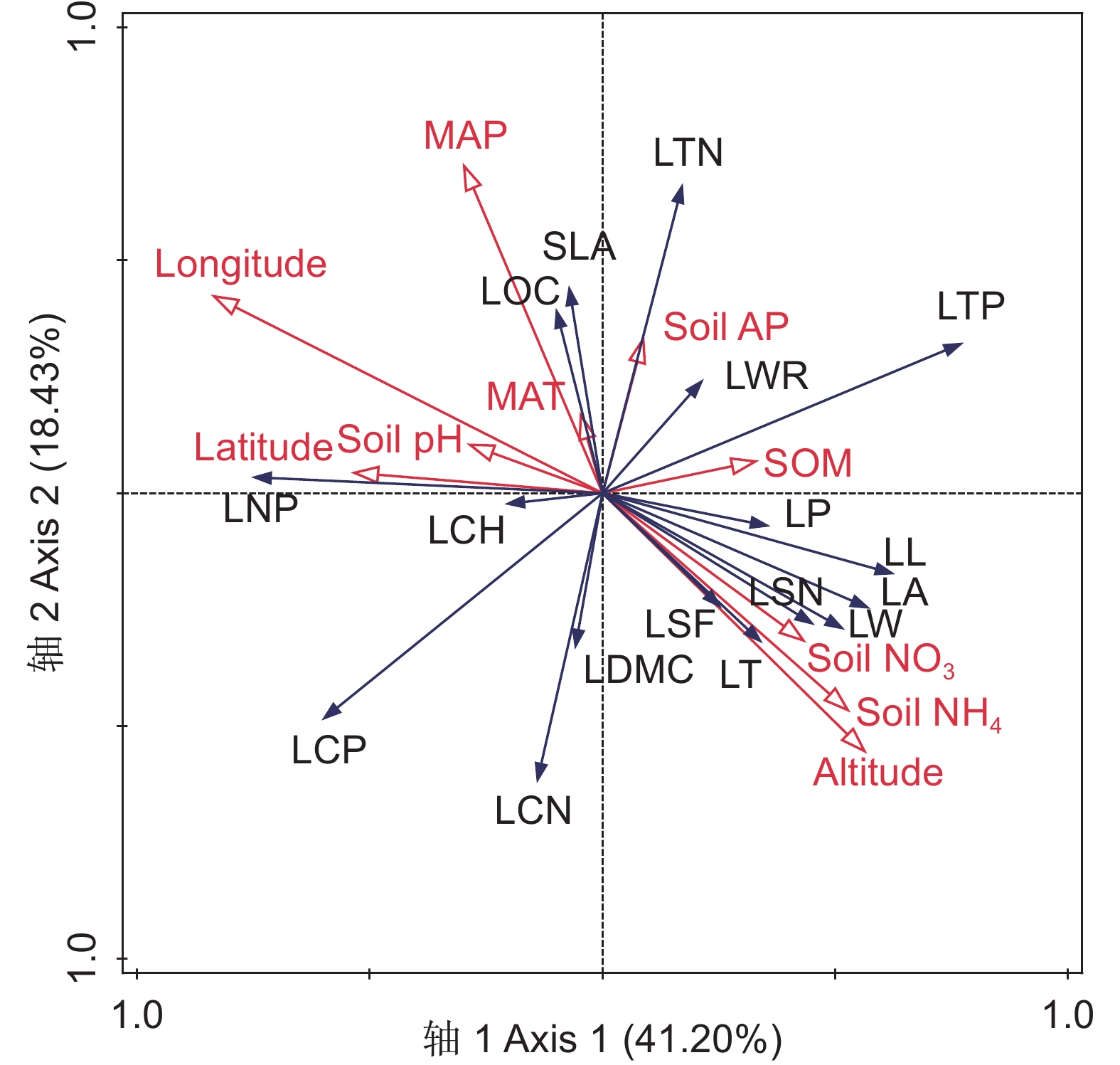
冗余分析筛选出8个显著相关的环境因子(P<0.05),包括经度、纬度、海拔、年降水、年均温、土壤有效磷含量、土壤铵态氮含量和土壤pH值(图4)。4个排序轴的特征值分别为0.4120、0.1843、0.1483和0.0524,累积为79.70%。环境因子与叶片性状之间的相关系数均大于0.95,较好地反映了性状与环境之间的关系。经度、海拔、土壤pH值在第Ⅰ轴影响叶片性状,纬度、土壤硝态氮、土壤有效磷、年均温、年降水主要在第Ⅱ轴影响叶片性状。土壤铵态氮含量、土壤有效磷含量、经度、纬度、海拔、年降水与珙桐叶功能性状极呈极显著相关(P<0.01),说明经度、纬度、海拔、年降水、土壤有效磷含量、土壤铵态氮含量是影响珙桐叶功能性状的主要环境因子。如图4所示,经度、纬度、年降水、年均温、土壤pH值分别与叶长、叶宽、叶面积、叶周长、叶厚度、叶形状因子、叶锯齿数反向关联,与叶绿素含量、比叶面积、叶有机质含量、叶氮磷比正向关联;土壤有效磷含量与叶长宽比、叶周长、比叶面积、叶有机质含量、叶氮含量、叶磷含量正向关联,与其他叶性状参数呈反向关联;土壤铵态氮含量、土壤硝态氮含量、海拔分别与叶长、叶宽、叶面积、叶周长、叶锯齿数、叶厚度、叶形状因子、叶磷含量、叶干物质含量、叶碳氮比正向关联,与其他叶性状参数呈反向关联。
![]() 图 4 珙桐叶功能性状与环境因子的冗余分析MAT:年均温; MAP:年降水; SOM:土壤有机质含量; Soil AP:土壤有效磷含量; Soil NO3:土壤硝态氮含量; Soil NH4:土壤铵态氮含量。其余简写参考表1。Figure 4. Redundancy analysis of functional traits and environmental factors in D. involucrata leavesMAT: Mean annual temperature; MAP: Mean annual precipitation; SOM: Soil organic matter; Soil AP: Soil available phosphorus content; Soil NO3: Soil nitrate nitrogen content; Soil NH4: Soil ammonium nitrogen content. Abbreviations of leaf functional traits are shown in Table 1.
图 4 珙桐叶功能性状与环境因子的冗余分析MAT:年均温; MAP:年降水; SOM:土壤有机质含量; Soil AP:土壤有效磷含量; Soil NO3:土壤硝态氮含量; Soil NH4:土壤铵态氮含量。其余简写参考表1。Figure 4. Redundancy analysis of functional traits and environmental factors in D. involucrata leavesMAT: Mean annual temperature; MAP: Mean annual precipitation; SOM: Soil organic matter; Soil AP: Soil available phosphorus content; Soil NO3: Soil nitrate nitrogen content; Soil NH4: Soil ammonium nitrogen content. Abbreviations of leaf functional traits are shown in Table 1.3. 讨论
3.1 叶片性状的种内变异
本研究发现,珙桐叶片功能性状种内变异不均匀,多数性状在区域尺度上的变化值小于局域尺度,这可能与区域尺度上广泛的环境梯度适应有关[33] 。在局域尺度上,珙桐17项叶片功能性状的变异系数范围在1.48%~24.81%,变异倍数范围在1.06~4.77,叶性状变异的不同幅度反映了植物适应不同环境波动的权衡。张腾驹等[30]对四川省的珙桐叶片的11项性状的分析表明,种群间叶表型性状的变异系数(区域变异系数)的均值为16.22%,变异幅度为4.32%~29.10%,略大于本研究中的区域变异系数(1.48%~24.81%),这可能是由于本研究采样区域更大,获取了更完整的叶片种间变异。本研究中,叶碳磷比、叶磷含量、比叶面积、叶氮磷比和叶面积变异程度最高,这些性状与植物对光、养分和水资源的竞争密切相关[34]。珙桐叶片的叶磷含量及其相关的叶碳磷比、叶氮磷比的变异程度都较大,这与全球的研究结果一致[16]。研究表明,植物养分储存取决于环境资源的可用性[35],全球研究发现叶磷含量主要由土壤肥力决定[36]。土壤磷是陆地植被的限制元素[37],Maire 等[38]发现叶磷含量与土壤磷呈正相关。本研究中,土壤有效磷含量变化较大(2.83~27.96 mg/g),同时Pearson相关分析与RDA分析都表明土壤有效磷含量与叶磷含量正相关,因此,我们认为不同分布地区土壤磷含量分布不均是珙桐叶磷含量相对于其他叶片性状变化较大的原因。
3.2 叶片性状之间的相关性
珙桐比叶面积与叶干物质含量呈现极显著负相关,叶厚度与叶形态因子、叶干物质含量呈极显著正相关,即越厚的叶片其干物质含量越高,叶片形状也越圆,这可能是珙桐为了适应潮湿的生长环境[39]。叶锯齿数与叶厚度呈极显著正相关。叶边缘锯齿能减小叶的边界层厚度,以加强叶的水分运输和提升水分的利用效率[40],叶锯齿能增强落叶植物生长季早期的气体交换,加强碳固定[41]。珙桐叶面积与叶磷含量呈显著正相关,而叶磷含量与叶有机质含量、叶氮含量、叶碳氮比均存在显著相关性,即叶磷含量能调控植物生理过程(特别是生长速率),叶碳含量、叶氮含量、叶碳氮比与生产力之间的关系[42]。
3.3 叶片性状对环境因子的响应
植物根据环境差异调节不同的功能性状,形成最佳的性状组合,从而最大限度地利用资源,避免逆境的影响,提升对生境的适应性[7]。Meng等[5]发现随着纬度增加,领春木通过高生长率(更高比叶面积)和低投资策略(低叶片密度)适应纬度变化。本研究中,叶面积、叶周长、叶长、叶宽和叶厚度随经度、纬度的增加而减小,比叶面积随经度、纬度的增加而增加。这可能反映了珙桐叶片在光合生产能力最大化和适应逆境之间的权衡。随着纬度的降低,植物叶片越大,蒸腾作用加强导致的水分损失可能高于光合作用增加的碳收益[43]。叶片大小影响叶边缘的空气对流速度而调节了叶片表面温度,从而提高光合酶的活性[6],以最大化叶片的碳吸收能力并提高叶片水分利用效率。珙桐叶锯齿数与经度、纬度和年降水呈极显著负相关,这可能是由于叶锯齿能够减小叶片边界层的厚度,促进叶片的水气交换 [40]。
海拔的变化能改变生境的水热条件,从而影响植物的功能性状,海拔增加,植物倾向于提高资源利用率的保守策略或有利于捕获资源的开放策略[44, 45]。Li和Bao[46]对小雀花(Campylotropis polyantha (Franch.) Schindl.)的研究发现,生长在较高海拔的植物叶面积片和叶厚度都显著提升,这与本研究结论一致,即海拔升高后珙桐叶片功能性状没有明显的资源获取倾向。本研究中,随着海拔升高,珙桐叶厚度显著增加,同时叶面积和叶磷含量也有显著提升。刘婷婷等[27]对珙桐苞片性状的研究发现,低海拔珙桐苞片的长、宽和面积均显著大于高海拔。张腾驹等[30]的研究认为,珙桐叶片面积叶片大小与海拔呈显著负相关,与本研究结论相反,这可能是由研究尺度的差异造成的。较宽的叶片其边界层较厚,能减少水汽交换,因此生活在均温较低地区的植物往往具有较小的叶片长宽比,即较宽的叶片[47]。本研究中,珙桐叶形态因子随着海拔的增加而增大,叶长宽比随着海拔的增加而减小,这种模式可能反映了珙桐叶片的热力学调节与水力限制之间的权衡,以响应跨空间的气候变化[48]。这一结果印证了全球变暖可能会增加植物叶长宽比的结论[38]。研究表明,在寒冷气候中叶片边缘通常具有更多、更大的锯齿,叶齿能增强生长季早期的液流,提高叶片在低温条件下的光合和蒸腾速率,促进叶片吸收的碳,弥补低温对植物光合作用的影响[41]。在寒冷气候下,叶齿的存在也有助于缓解冻融栓塞,防止早春冻害[40]。珙桐叶锯齿数与海拔显著正相关,与年均温显著负相关,即叶边缘锯齿是珙桐叶片对寒冷的适应。
冗余分析结果表明,环境和叶片功能性状变异之间的关联比较复杂。在所有的环境因子中,经度、纬度、海拔、年降水量是解释度最高的4个,土壤有效磷含量、土壤铵态氮的解释度次之,这说明珙桐叶片性状变异主要由地理变量与气候因子驱动,同时受到土壤因子的影响。先前的研究指出,经度、纬度、海拔和降水量与叶片功能性状显著相关[5, 49]。冗余分析与Pearson相关分析结果都显示,土壤硝态氮、铵态氮含量表现出强烈的协同性,两者分别与叶面积、叶周长、叶长、叶宽、叶锯齿数、叶厚度、叶形状因子、叶磷含量、叶碳氮比正向关联,与其他叶性状参数呈负向关联。土壤养分(如本研究的土壤有机质、土壤硝态氮和铵态氮含量)越高,珙桐叶功能性状倾向于有更大的叶面积、更高的比叶面积和叶磷含量,在土壤养分更充足的情况下,珙桐叶片倾向于快速生长的策略。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 4 珙桐叶功能性状与环境因子的冗余分析
MAT:年均温; MAP:年降水; SOM:土壤有机质含量; Soil AP:土壤有效磷含量; Soil NO3:土壤硝态氮含量; Soil NH4:土壤铵态氮含量。其余简写参考表1。
Figure 4. Redundancy analysis of functional traits and environmental factors in D. involucrata leaves
MAT: Mean annual temperature; MAP: Mean annual precipitation; SOM: Soil organic matter; Soil AP: Soil available phosphorus content; Soil NO3: Soil nitrate nitrogen content; Soil NH4: Soil ammonium nitrogen content. Abbreviations of leaf functional traits are shown in Table 1.
表 1 珙桐叶片功能性状的变异系数
Table 1 Leaf trait variations in Davidia involucrata
性状
Trait最大值
Maximum最小值
Minimum平均值
Mean value倍数
Fold局域变异系数
Local CV / %区域变异系数
Regional CV / %叶面积LA / cm2 199.86 50.36 107.01 3.97 15.91 14.66 叶周长LP / cm 92.83 45.57 64.31 2.04 6.27 8.83 叶长LL / cm 20.23 10.46 14.97 1.93 7.82 7.41 叶宽LW / cm 15.19 7.41 10.94 2.05 7.84 7.58 叶长宽比LWR 1.70 1.19 1.38 1.43 3.67 4.30 叶形状因子LSF 0.61 0.18 0.33 3.36 11.54 12.63 叶锯齿数LSN 134.23 29.80 80.78 4.50 11.60 11.45 叶绿素含量LCH(SPAD) 50.52 23.72 38.10 2.13 6.83 9.01 叶干物质含量LDMC / mg/g 393.26 172.11 270.98 2.28 9.36 10.55 比叶面积SLA / m2/kg 58.99 12.37 28.55 4.77 21.07 18.64 叶厚度LT / mm 0.32 0.11 0.21 3.02 13.23 10.18 叶有机质含量LOC / mg/g 467.54 440.36 450.42 1.06 1.48 2.02 叶磷含量LTP / mg/g 3.43 1.34 1.88 2.56 24.39 15.90 叶氮含量LTN / mg/g 36.10 22.23 28.67 1.62 11.05 9.93 叶碳氮比LCN 20.39 12.95 15.89 1.57 10.49 9.93 叶碳磷比LCP 13.00 4.16 8.92 3.13 24.81 15.50 叶氮磷比LNP 21.04 9.05 15.82 2.33 17.73 13.29 注:区域变异系数为所有采样点性状变异系数平均值;局域变异系数为各采样点内平均性状的变异系数。CV:变异系数;LA:叶面积; LP:叶周长; LL:叶长; LW:叶宽; LWR:叶长宽比; LSF:叶形状因子; LSN:叶锯齿数; LCH:叶绿素含量; LDMC:叶干物质含量; SLA:比叶面积; LT:叶片厚度; LOC:叶有机质含量; LTP:叶磷含量; LTN:叶氮含量; LCN:叶碳氮比; LCP:叶碳磷比; LNP:叶氮磷比。 Notes: Regional trait CV, CV of mean trait values in each site; Local trait CV, average trait CV of within site leaf samples. CV: Coefficient of variation; LA: Leaf area; LP: Leaf perimeter; LL: Leaf length; LW: Leaf width; LWR: Length/width; LSF: Leaf shape factor; LSN: Leaf serration number; LCH: Leaf chlorophyll content; LDMC: Leaf dry matter content; SLA: Specific leaf area; LT: Leaf thickness; LOC: Leaf organic carbon content; LTP: Leaf phosphorus content; LTN: Leaf nitrogen content; LCN: Leaf organic carbon/nitrogen content; LCP: Leaf organic carbon/phosphorus content; LNP: Leaf nitrogen/phosphorus content. -
[1] Dı́az S,Cabido M. Vive la différence:plant functional diversity matters to ecosystem processes[J]. Trends Ecol Evol,2001,16(11):646−655. doi: 10.1016/S0169-5347(01)02283-2
[2] 李耀琪,王志恒. 植物叶片形态的生态功能、地理分布与成因[J]. 植物生态学报,2021,45(10):1154−1172. doi: 10.17521/cjpe.2020.0405 Li YQ,Wang ZH. Leaf morphological traits:ecological function,geographic distribution and drivers[J]. Chinese Journal of Plant Ecology,2021,45(10):1154−1172. doi: 10.17521/cjpe.2020.0405
[3] Garnier E,Navas ML. A trait-based approach to comparative functional plant ecology:concepts,methods and applications for agroecology. A review[J]. Agron Sustain Dev,2012,32(2):365−399. doi: 10.1007/s13593-011-0036-y
[4] Moles AT,Perkins SE,Laffan SW,Flores-Moreno H,Awasthy M,et al. Which is a better predictor of plant traits:temperature or precipitation?[J]. J Veg Sci,2014,25(5):1167−1180. doi: 10.1111/jvs.12190
[5] Meng H,Wei X,Franklin SB,Wu H,Jiang M. Geographical variation and the role of climate in leaf traits of a relict tree species across its distribution in China[J]. Plant Biol,2017,19(4):552−561. doi: 10.1111/plb.12564
[6] Tian D,Yan ZB,Niklas KJ,Han WX,Kattge J,et al. Global leaf nitrogen and phosphorus stoichiometry and their scaling exponent[J]. Natl Sci Rev,2018,5(5):728−739. doi: 10.1093/nsr/nwx142
[7] 何雅琴,史晓洁,陈国杰,赖敏英,曾纪毅,等. 滨柃叶功能性状对环境因子的响应[J]. 生态学报,2022,42(6):2418−2429. He YQ,Shi XJ,Chen GJ,Lai MY,Zeng JY,et al. Response and adaptation of leaf functional traits of Eurya emarginata to environmental factors[J]. Acta Ecologica Sinica,2022,42(6):2418−2429.
[8] Wright IJ,Dong N,Maire V,Prentice IC,Westoby M,et al. Global climatic drivers of leaf size[J]. Science,2017,357(6354):917−921. doi: 10.1126/science.aal4760
[9] Wang CG,He JM,Zhao TH,Cao Y,Wang GJ,et al. The smaller the leaf is,the faster the leaf water loses in a temperate forest[J]. Front Plant Sci,2019,10:58. doi: 10.3389/fpls.2019.00058
[10] Li YQ,Reich PB,Schmid B,Shrestha N,Feng X,et al. Leaf size of woody dicots predicts ecosystem primary productivity[J]. Ecol Lett,2020,23(6):1003−1013. doi: 10.1111/ele.13503
[11] Guerin GR,Wen HX,Lowe AJ. Leaf morphology shift linked to climate change[J]. Biol Lett,2012,8(5):882−886. doi: 10.1098/rsbl.2012.0458
[12] Zhang L,Luo TX,Liu XS,Wang Y. Altitudinal variation in leaf construction cost and energy content of Bergenia purpurascens[J]. Acta Oecol,2012,43:72−79. doi: 10.1016/j.actao.2012.05.011
[13] Cornwell WK,Ackerly DD. Community assembly and shifts in plant trait distributions across an environmental gradient in coastal California[J]. Ecol Monogr,2009,79(1):109−126. doi: 10.1890/07-1134.1
[14] 王瑞丽,于贵瑞,何念鹏,王秋凤,赵宁,徐志伟. 中国森林叶片功能属性的纬度格局及其影响因素[J]. 地理学报,2015,70(11):1735−1746. doi: 10.11821/dlxb201511004 Wang RL,Yu GR,He NP,Wang QF,Zhao N,Xu ZW. Latitudinal patterns and influencing factors of leaf functional traits in Chinese forest ecosystems[J]. Acta Geographica Sinica,2015,70(11):1735−1746. doi: 10.11821/dlxb201511004
[15] Kattge J,Díaz S,Lavorel S,Prentice IC,Leadley P,et al. TRY-a global database of plant traits[J]. Glob Chang Biol,2011,17(9):2905−2935. doi: 10.1111/j.1365-2486.2011.02451.x
[16] Siefert A,Violle C,Chalmandrier L,Albert CH,Taudiere A,et al. A global meta-analysis of the relative extent of intraspecific trait variation in plant communities[J]. Ecol Lett,2015,18(12):1406−1419. doi: 10.1111/ele.12508
[17] Zhou W,Wang ZX,Davy AJ,Liu GH. Geographic variation and local adaptation in Oryza rufipogon across its climatic range in China[J]. J Ecol,2013,101(6):1498−1508. doi: 10.1111/1365-2745.12143
[18] Siefert A. Incorporating intraspecific variation in tests of trait-based community assembly[J]. Oecologia,2012,170(3):767−775. doi: 10.1007/s00442-012-2351-7
[19] Breza LC,Souza L,Sanders NJ,Classen AT. Within and between population variation in plant traits predicts ecosystem functions associated with a dominant plant species[J]. Ecol Evol,2012,2(6):1151−1161. doi: 10.1002/ece3.223
[20] Albert CH,de Bello F,Boulangeat I,Pellet G,Lavorel S,Thuiller W. On the importance of intraspecific variability for the quantification of functional diversity[J]. Oikos,2012,121(1):116−126. doi: 10.1111/j.1600-0706.2011.19672.x
[21] Albert CH,Thuiller W,Yoccoz NG,Soudant A,Boucher F,et al. Intraspecific functional variability:extent,structure and sources of variation[J]. J Ecol,2010,98(3):604−613. doi: 10.1111/j.1365-2745.2010.01651.x
[22] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1983, 52(2): 157. [23] Chen Y,Ma T,Zhang LS,Kang MH,Zhang ZY,et al. Genomic analyses of a “living fossil”:the endangered dove-tree[J]. Mol Ecol Resour,2020,20(3):756−769. doi: 10.1111/1755-0998.13138
[24] Tang CQ,Matsui T,Ohashi H,Dong YF,Momohara A,et al. Identifying long-term stable refugia for relict plant species in East Asia[J]. Nat Commun,2018,9(1):4488. doi: 10.1038/s41467-018-06837-3
[25] 张潇月,周润惠,余飞燕,叶鑫,王敏,等. 大相岭自然保护区珙桐群落植物区系、结构及动态[J]. 生态学杂志,2020,39(5):1509−1517. Zhang XY,Zhou RH,Yu FY,Ye X,Wang M,et al. Flora,structure,and dynamics of Davidia involucrata community in Daxiangling Nature Reserve[J]. Chinese Journal of Ecology,2020,39(5):1509−1517.
[26] 刘海洋,金晓玲,沈守云,张日清. 湖南珍稀濒危植物——珙桐种群数量动态[J]. 生态学报,2012,32(24):7738−7746. doi: 10.5846/stxb201203270425 Liu HY,Jin XL,Shen SY,Zhang RQ. Population quantitative characteristics and dynamics of rare and endangered plant Davidia involucrata in Hunan province[J]. Acta Ecologica Sinica,2012,32(24):7738−7746. doi: 10.5846/stxb201203270425
[27] 刘婷婷,刘沁松,徐文娟,徐治兵,李中阳,等. 珙桐(Davidia involucrata Baill. )苞片功能性状及性状间关系对海拔的响应[J]. 生态学杂志,2020,39(3):794−802. Liu TT,Liu QS,Xu WJ,Xu ZB,Li ZY,et al. Altitudinal changes of functional traits and relationships among traits of bracts in dove tree (Davidia involucrata Baill.)[J]. Chinese Journal of Ecology,2020,39(3):794−802.
[28] Chen JM,Zhao SY,Liao YY,Gichira AW,Gituru RW,Wang QF. Chloroplast DNA phylogeographic analysis reveals significant spatial genetic structure of the relictual tree Davidia involucrata(Davidiaceae)[J]. Conserv Genet,2015,16(3):583−593. doi: 10.1007/s10592-014-0683-z
[29] 牛文娟,张涛,邓东周,庄文化. 珙桐繁殖技术及生长发育研究进展[J]. 植物生理学报,2013,49(10):1018−1022. Niu WJ,Zhang T,Deng DZ,Zhuang WH. A review on reproductive technology and growing of Davidia involucrata Baill.[J]. Plant Physiology Journal,2013,49(10):1018−1022.
[30] 张腾驹,陈小红,康喜坤,刘静. 四川省珙桐天然种群叶表型多样性[J]. 生态学杂志,2019,38(1):35−43. Zhang TJ,Chen XH,Kang XK,Liu J. Phenotypic diversity of leaf morphologic traits of Davidia involucrata natural populations in Sichuan province[J]. Chinese Journal of Ecology,2019,38(1):35−43.
[31] 陈艳,苏智先. 中国珍稀濒危孑遗植物珙桐种群的保护[J]. 生态学报,2011,31(19):5466−5474. Chen Y,Su ZX. Research on the protection of Davidia involucrata populations,a rare and endangered plant endemic to China[J]. Acta Ecologica Sinica,2011,31(19):5466−5474.
[32] Fick SE,Hijmans RJ. WorldClim 2:new 1-km spatial resolution climate surfaces for global land areas[J]. Int J Climatol,2017,37(12):4302−4315. doi: 10.1002/joc.5086
[33] Craine JM,Ocheltree TW,Nippert JB,Towne EG,Skibbe AM,et al. Global diversity of drought tolerance and grassland climate-change resilience[J]. Nat Clim Change,2013,3(1):63−67. doi: 10.1038/nclimate1634
[34] Dong N,Prentice IC,Wright IJ,Evans BJ,Togashi HF,et al. Components of leaf-trait variation along environmental gradients[J]. New Phytol,2020,228(1):82−94. doi: 10.1111/nph.16558
[35] Chapin III FS,Schulze E,Mooney HA. The ecology and economics of storage in plants[J]. Annu Rev Ecol Evol Syst,1990,21:423−447. doi: 10.1146/annurev.es.21.110190.002231
[36] Ordoñez JC,van Bodegom PM,Witte JPM,Wright IJ,Reich PB,Aerts R. A global study of relationships between leaf traits,climate and soil measures of nutrient fertility[J]. Glob Ecol Biogeogr,2009,18(2):137−149. doi: 10.1111/j.1466-8238.2008.00441.x
[37] Reich PB,Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proc Natl Acad Sci USA,2004,101(30):11001−11006. doi: 10.1073/pnas.0403588101
[38] Maire V,Wright IJ,Prentice IC,Batjes NH,Bhaskar R,et al. Global effects of soil and climate on leaf photosynthetic traits and rates[J]. Glob Ecol Biogeogr,2015,24(6):706−717. doi: 10.1111/geb.12296
[39] Niklas KJ. Plant allometry,leaf nitrogen and phosphorus stoichiometry,and interspecific trends in annual growth rates[J]. Ann Bot,2006,97(2):155−163. doi: 10.1093/aob/mcj021
[40] Feild TS,Sage TL,Czerniak C,Iles WJD. Hydathodal leaf teeth of Chloranthus japonicus(Chloranthaceae) prevent guttation-induced flooding of the mesophyll[J]. Plant,Cell Environ,2005,28(9):1179−1190.
[41] Peppe DJ,Royer DL,Cariglino B,Oliver SY,Newman S,et al. Sensitivity of leaf size and shape to climate:global patterns and paleoclimatic applications[J]. New Phytol,2011,190(3):724−739. doi: 10.1111/j.1469-8137.2010.03615.x
[42] Reich PB,Oleksyn J,Wright IJ. Leaf phosphorus influences the photosynthesis-nitrogen relation:a cross-biome analysis of 314 species[J]. Oecologia,2009,160(2):207−212. doi: 10.1007/s00442-009-1291-3
[43] Fonseca CR,Overton JM,Collins B,Westoby M. Shifts in trait-combinations along rainfall and phosphorus gradients[J]. J Ecol,2000,88(6):964−977. doi: 10.1046/j.1365-2745.2000.00506.x
[44] Midolo G,de Frenne P,Hölzel N,Wellstein C. Global patterns of intraspecific leaf trait responses to elevation[J]. Glob Chang Biol,2019,25(7):2485−2498. doi: 10.1111/gcb.14646
[45] Umaña MN,Swenson NG. Intraspecific variation in traits and tree growth along an elevational gradient in a subtropical forest[J]. Oecologia,2019,191(1):153−164. doi: 10.1007/s00442-019-04453-6
[46] Li FL,Bao WK. Elevational trends in leaf size of Campylotropis polyantha in the arid Minjiang River valley,SW China[J]. J Arid Environ,2014,108:1−9. doi: 10.1016/j.jaridenv.2014.04.011
[47] Hu J,Hu H. Viewing leaf shape and size variation in tobacco plants under different temperatures from a hydraulic perspective[J]. Plant Diversity,2015,37(2):168−176.
[48] Li YQ,Zou DT,Shrestha N,Xu XT,Wang QG,et al. Spatiotemporal variation in leaf size and shape in response to climate[J]. J Plant Ecol,2020,13(1):87−96. doi: 10.1093/jpe/rtz053
[49] Ensslin A,Fischer M. Variation in life-history traits and their plasticities to elevational transplantation among seed families suggests potential for adaptative evolution of 15 tropical plant species to climate change[J]. Am J Bot,2015,102(8):1371−1379. doi: 10.3732/ajb.1400518



 下载:
下载: