Comparison of quantitative research methods for flower scent based on dynamic headspace collection
-
摘要:
由于花气味能够影响植物与传粉者的相互作用并在香水产业中具有重要价值,研究者们开发出了众多收集花气味的方法。其中,通过连续的气流将花气味收集到吸附剂上的动态顶空吸附法是最为常用的方法。但在实验过程中,研究者们使用的具体方案仍不够统一,这可能会对分析结果造成较大影响。在总结已有文献相关方法的基础上,本研究以典型花香成分标准混合物和大花六道木(Abelia×grandiflora (André) Rehder)为研究对象,分别开展了室内和室外实验,对比了活性碳、Tenax TA与Propak Q 3种吸附剂,正己烷、二氯甲烷两种洗脱溶液,以及推拉法、循环法与闭环法3种连接方法的收集效果。结果显示,Propak Q是综合性能最为优秀的吸附剂,活性炭与Tenax TA分别对于苯类物质与脂肪族物质的吸附能力较差。两种洗脱溶液的效果类似,而3种连接方法中推拉法的综合表现最为优秀,同时能够保持植物的自然鲜活状态。在气味成分未知或需要进行群落水平研究时,推荐采用Propak Q吸附剂与推拉法连接方式进行实验。
Abstract:Floral scents play a critical role in mediating plant-pollinator interactions and hold significant commercial value in the perfume industry. To analyze these scents, researchers have developed various collection methods, with dynamic headspace collection-using continuous airflow to capture volatile compounds onto sorbent traps—being the most commonly used. However, the lack of standardized experimental protocols poses challenges in achieving consistent and reliable results. This study systematically evaluated the performance of three sorbent traps (charcoal, Tenax TA, and Propak Q), two elution solvents (hexane and dichloromethane), and three connection methods (push-pull, circulation, and closed-loop) through controlled indoor and outdoor experiments using a standard mixture of floral scent components and Abelia×grandiflora (André) Rehder. Results showed that Propak Q outperformed the other sorbent traps, while charcoal and Tenax TA exhibited relatively poor adsorption capabilities for benzenes and aliphatic compounds, respectively. The effects of the two elution solvents were similar. Among the three connection methods, the push-pull approach delivered the most consistent results, effectively preserving the natural freshness of floral scents. Based on these findings, the study recommends the use of Propak Q as the preferred sorbent trap and the push-pull method for floral scent experiments, particularly in cases where the composition of volatile compounds is unknown or when community-level analyses are required.
-
Keywords:
- Dynamic headspace collection /
- Floral scent /
- Sorbent trap /
- Elution solution /
- Connection method
-
除了产生诸如氧气与二氧化碳等无机挥发物以外,植物还可以合成大量挥发性有机化合物(Volatile organic compounds,VOCs)[1]。其中最广为人知的植物VOCs是由花朵合成的花VOCs。这些花VOCs共同构成了植物独特的花气味,并对吸引传粉者有着重要作用[2]。绝大多数开花植物以昆虫作为传粉者,昆虫具有灵敏的嗅觉系统,可以从空气中获取有效信息,以便于进行觅食、交配、筑巢和防御[3, 4]。花气味的相关代谢早在昆虫传粉进化出现之前就已经存在[5],二者彼此之间经历了漫长的共同进化。通过空气中的花气味与空气流向,昆虫可以在远距离锁定植物方位[6]。此外,研究表明,通过后天学习,昆虫可以在花气味与花报酬之间建立起记忆关联,以便于自身更好地觅食[7]。Kantsa等[8]的研究指出,花气味可以诚实地反映花蜜的存在;而花蜜是全球动植物互利互作的重要媒介,也是植物吸引传粉者的一种昂贵的生理成本。不同的昆虫对花气味具有不同的偏好性[9, 10];在自然群落中,植物与传粉者的互作是非随机分布的,花气味对维持植物与传粉者互作的特异性具有重要贡献,且有时比花色更为有效[10]。因此,花VOCs的分离与鉴定,在传粉生物学精细化研究中具有重要意义。
气相色谱-质谱联用(GC-MS)技术的快速发展,极大地推进了人类对花VOCs的认识。人类开发出了多种方法对花VOCs进行收集以用于科学研究或香水产品开发,包括:蒸汽蒸馏、萃取、溶剂提取、静态和动态顶空吸附法等方法[1, 9, 11-13];随后,收集的花VOCs通常通过GC-MS技术进行化学分析。由于野外操作方便,且对植物组织不具有破坏性,动态顶空吸附法得到了广泛使用[14]。在这种采样方法中,连续的气流作为载气经过含有样品的顶空空间,随后通过吸附剂。当VOCs被吸附剂捕获时,载气在密闭式装置中循环或从开放式装置中排出,从而收集到足够用于检测甚至结构解析的待测物质[1]。相比于密闭式装置,开放式装置可以通过恒定的气流有效消除顶空空间中气体代谢物(如二氧化碳)的累积,并减小环境温度或湿度的改变。但研究者应注意提供经过过滤的清洁空气,例如通过活性炭过滤,以避免空气中的杂质干扰化学分析[1]。
虽然动态顶空吸附法应用广泛,但是具体操作通常缺乏统一标准,研究者们使用的吸附剂、洗脱溶液甚至连接方式各不相同。因此,有必要通过更系统的实验对已发表的动态顶空吸附法的不同操作方法进行全面比较:一方面,便于研究者们在面对不同的实验材料与实验目的时,选择更适合的吸附剂、溶剂以及连接方式。另一方面,对于涉及大量物种的群落水平实验,研究者们也需要选择最为普适的实验方法。我们调查了国内外的相关研究(表1),总结了动态顶空吸附法中常用的3种吸附剂(Propak Q、Tenax TA和活性碳)、两种洗脱溶液(正己烷与二氯甲烷)和3种不同的连接方式(推拉法、闭环法、循环法)。在此基础上,我们以标准混合物或大花六道木(Abelia×grandiflora (André) Rehder)作为气味来源,分别在室内和室外条件下对3种吸附剂、两种洗脱溶液和3种不同连接方式的收集效果进行了对比,以便于后续研究者选择最为合适的研究方法。
表 1 使用动态顶空吸附法的花气味研究方案差异示例Table 1. Examples of differences in floral scent research protocols using dynamic headspace collection1. 材料与方法
1.1 气味来源
在实验中,我们采用了两种不同的样品作为气味来源:含有典型花气味成分的标准混合物和大花六道木。该物种来自于武汉大学校园中。标准品的具体成分为以下4种物质:1-辛烯(O108660,Aladin)、苯甲醛(B110459,Aladdin)、芳樟醇(L106905,Aladdin)和法尼醇(F113776,Aladdin),体积分数均为0.04%,溶剂为甲醇(M116118,Aladdin)。这4种物质分别代表了花气味组分中最主要的4类物质:脂肪族、苯类、单萜与倍半萜[9],可以较好地反映花气味的真实情况。在实验中,将200 μL的标准品滴加在洁净的称量纸上用于代替真实的植物作为气味来源,而大花六道木则作为天然的气味来源使用。选择该物种的原因在于其可挥发出可被人类感官感知的浓郁花气味,是一种优秀的天然气味来源。
1.2 气味收集
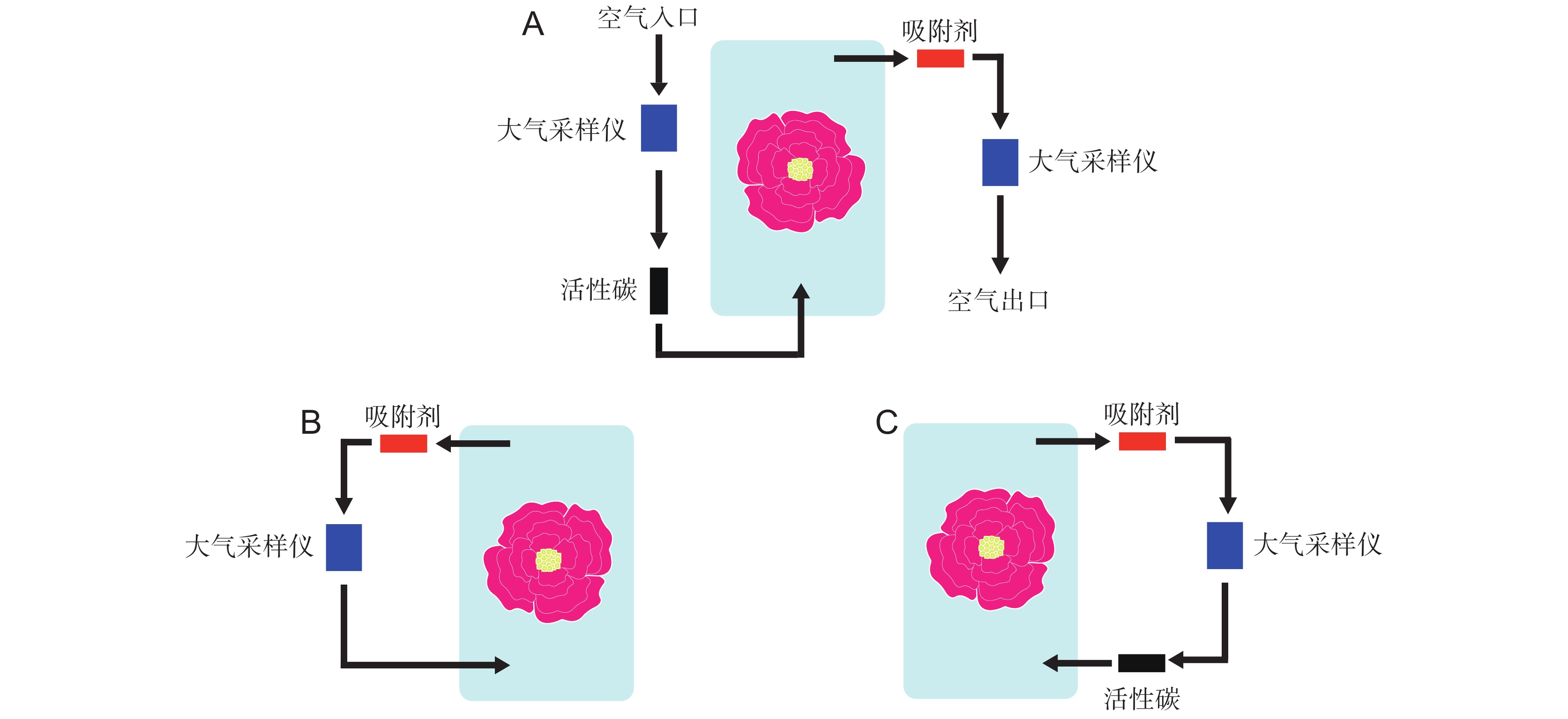
天然或人工的气味来源被封闭在25 cm×38 cm柔性烤肉袋构成的顶空空间中,用于进行后续3种连接方式的吸附实验。推拉法利用硅胶管依次连接大气采样仪出气口、活性炭、顶空空间、吸附剂以及第2台大气采样仪的进气口(图1)。新鲜的空气经过活性炭过滤之后,以250 mL/min的流速进入顶空空间,随后以200 mL/min的流速通过吸附剂离开装置,而花气味成分被截留在吸附剂中。这种不平衡的流速设定有助于维持顶空空间的正压状态,减少污染,同时有助于烤肉袋维持膨胀状态,避免由于烤肉袋收缩,挤压并损坏植物导致实验失败。
闭环法与循环法整体相似,均在密闭的环境中完成吸附过程(图1)。闭环法仅由大气采样仪、吸附剂与顶空空间3部分组成,内部空气以200 mL/min的流速循环流动,依次通过大气采样仪、顶空空间和吸附剂,循环收集气味。循环法则在大气采样仪与顶空空间之间增加了活性炭,对回流气体进行进一步过滤,这种方法在国内被大量使用(表1)。
采集结束后,采用1 mL洗脱溶液进行洗脱,随后加入4 μL体积分数为0.04%的癸酸乙酯(E101444,Aladdin)[19]作为内参,通过气相色谱-质谱联用仪进行分析。实验中,吸附剂与活性炭均被填装在外径为6 mm的玻璃吸附管中使用,填装量均为150 mg。
1.3 室内实验
1.3.1 实验1:不同吸附剂-洗脱溶液组合吸附气味标准混合物的效果对比
实验首先在环境条件更为稳定可控的室内环境下进行。在实验1中,我们统一按照循环法组装了收集装置,采集时间为3 h,气味来源为典型花气味成分的标准混合物。利用Propak Q、Tenax TA以及活性碳3种不同的吸附剂,与正己烷(
32293 ,Sigma-Aldrich)以及二氯甲烷(D116147,Aladdin)两种不同洗脱溶液的成对组合进行测试。然而,当使用二氯甲烷作为洗脱溶液进行洗脱时,Tenax TA吸附剂发生了溶解,因此该组合的实验无法开展。最终,本研究对比了5种吸附剂-洗脱溶液组合(表2),每个实验组设置4个重复。表 2 室内或室外实验中不同实验组的实验方案差异Table 2. Differences in experimental schemes for different experimental groups in indoor or outdoor experiments实验
Experiment实验组ID
Group ID吸附剂
Sorbent trap洗脱溶液
Elution solvent连接方式
Connection method实验1 1 活性炭 二氯甲烷 循环法 2 活性炭 正己烷 循环法 3 Propak Q 二氯甲烷 循环法 4 Propak Q 正己烷 循环法 5 Tenax TA 正己烷 循环法 实验2 4 Propak Q 正己烷 循环法 6 Propak Q 正己烷 推拉法 7 Propak Q 正己烷 闭环法 实验3 8 Charcoal 二氯甲烷 推拉法 9 Charcoal 正己烷 推拉法 10 Propak Q 二氯甲烷 推拉法 11 Propak Q 正己烷 推拉法 12 Tenax TA 正己烷 推拉法 实验4 13 Propak Q 正己烷 循环法 11 Propak Q 正己烷 推拉法 14 Propak Q 正己烷 闭环法 1.3.2 实验2:不同连接方式吸附气味标准混合物的效果对比
在实验2中,统一采用典型花气味成分的标准混合物作为气味来源,以Propak Q作为吸附剂,并以正己烷作为洗脱溶液。连接方式分别按照循环法、闭环法以及推拉法组装(表2),对气味均进行3 h的收集。循环法与闭环法设置4个重复,推拉法设置了3个重复。
1.4 室外实验
1.4.1 实验3:不同吸附剂-洗脱溶液组合吸附自然花气味的效果对比
由于动态吸附法通常被用于野外实验,本研究以大花六道木为实验材料在室外进行了相关实验。采样时间为9 h,起始时间为早晨8:00-10:00,每个实验组设置3个重复,同时设置1组没有花朵的空白对照组。我们同样测试了5种吸附剂-洗脱溶液组合,但不同于以上室内实验,在连接方式上我们仅使用推拉法(表2)。因为相比于密闭的循环法与闭环法,推拉法能够保持植物的自然鲜活状态[1]。由于自然花气味浓度相对较低,在进行GC-MS分析之前,洗脱液通过氮吹浓缩至50 μL。
1.4.2 实验4:不同连接方式吸附自然花气味的效果对比
在室外实验中,本研究同样对比了不同连接方式的吸附效果。实验操作与实验2大致相同:统一采用Propak Q作为吸附剂,以正己烷作为洗脱溶液;但气味来源为自然生长的活体大花六道木。将大花六道木2 ~ 5个花序封闭在顶空空间内,随后分别按照循环法,闭环法以及推拉法组装连接方式(表2),对其持续采样9 h。采样结束后,其余实验步骤与实验3相同。
1.5 气相色谱-质谱联用技术分析
室内实验,按照以下流程通过GC-MS(Trace GC Ultra,ISQ单四极质谱,Themo Scientist)分析:柱温箱在40 ℃保留3 min后,以10 ℃/min的速度升温到250 ℃,进样体积为1 μL,载气流速为1.5 mL/min,分流流速为11 mL/min,离子源与传输线温度均为250 ℃,质谱扫描范围为:33~550[19],色谱柱型号为DB-5MS(30 m×0.25 mm×0.25 μm)。由于法尼醇的挥发性较差,我们随后将洗脱液氮吹浓缩至约50 μL后,采取不分流进样,对其进行了2次检测。为了确定不同物质的保留时间,对以上4种物质的0.04%的标准溶液进行了检测,并通过与NIST08数据库比对确定物质种类。
室外实验为非靶向实验,为了尽可能区分物质,我们参照前人的研究[19],降低了GC-MS的升温速度与气流速度。柱温箱在40 ℃保留2 min后,以4 ℃/min升温到120 ℃,不进行保留,随后以5 ℃/min升温至250 ℃,最后于250 ℃保留4 min,载气流速为1 mL/min。在与空白组对比后,实验组中存在而空白组中不存在的色谱峰被视为目标物质。最终通过与NIST08数据库比对,确定物质种类。
1.6 数据分析
对于室内实验,我们通过待测物质与内参之间相对峰面积的大小衡量实验效果[14]。由于法尼醇含量过低,且有其他杂质与其共流出;为降低背景噪声,我们进一步提取了69特征峰作为参考。对于室外实验,我们通过相对峰面积与顶空空间内花组织鲜重的比值作为参考值。这种计算方式可反映单位质量花组织的气味挥发量,也是计算植物气味挥发量的常用方法。参考值乘以内参质量,并除以采样时间后,即为理论挥发速率。如果采用推拉法则需要进一步乘以进气流速与出气流速的比值进行调整。我们通过单因素方差分析与Tukey HSD事后检验,详细对比了不同吸附剂-洗脱溶液组合与连接方式在不同物质类型上的表现优劣。其中,吸附剂-洗脱溶液组合或连接方式作为预测变量,不同种类物质的参考值作为响应变量,参考值在室内实验中为相对面积,在室外实验中为相对峰面积与花组织鲜重的比值。所有数据均经过log10转换,以满足正态性。方差分析与Tukey HSD事后检验,分别通过R语言“stats”包中的aov函数与TukeyHSD函数进行。
2. 结果与分析
2.1 室内实验
2.1.1 实验1:不同吸附剂-洗脱溶液组合吸附气味标准混合物的效果对比
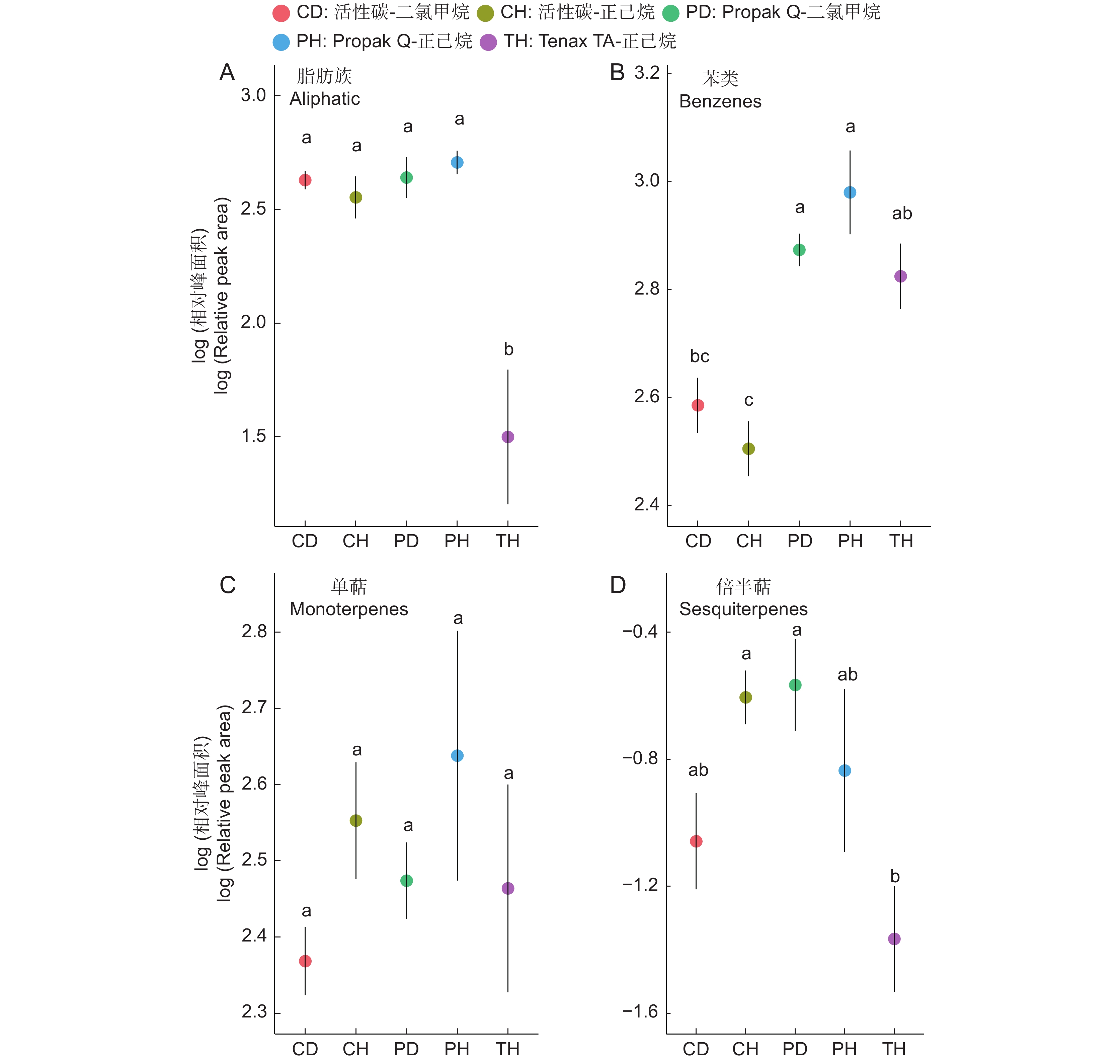
与室外实验相比,室内环境稳定可控,有利于更为详实地判断不同变量对结果的影响。根据实验1的结果,Propak Q的综合表现最为良好,其相较于另外两种吸附剂,在不同气味物质层面均展现出了明显的吸附优势。活性炭对苯类物质的吸附效果较差(F4,15=12.46,P<0.001,图2:B),而对于苯类物质,除Tenax TA-正己烷与活性碳-二氯甲烷之间在成对对比中无显著差异以外,活性炭无论采取何种洗脱溶液,其苯类物质的相对面积均显著低于其他组(图2:B)。Tenax TA吸附剂对脂肪族的吸附效果同样较差(F4,15=11.96,P<0.001,图2:A),其吸附的脂肪族物质的相对面积显著低于其他所有组(图2:A)。对于单萜类物质,不同组间无显著差异(F4,15=0.921,P=0.478, 图2:C)。在倍半萜层面,吸附剂-洗脱溶液组合的不同仍显著影响实验结果(F4,15=3.844,P=0.0241,图2:D)。Tenax TA-正己烷对倍半萜的吸附效果显著低于活性炭-正己烷(P=0.043)和Propak Q-二氯甲烷(P=0.032)两个组合(图2:D)。检测结果差异基本均来自于吸附剂的不同——对于所有气味物质标品,当吸附剂相同时,不同组合之间并不具有显著差异。
![]() 图 2 室内实验中5种吸附剂-洗脱溶液组合在不同物质层面的表现散点位置代表平均值,线条长度代表标准误。不同字母代表在Tukey HSD成对检验中P<0.05。下同。Figure 2. Performance of five sorbent trap-elution solvent combinations across different substances in indoor experimentsDot represents average value and line length represents standard error. Different letters indicate significant differences (P<0.05) in the Tukey HSD pairwise test. Same below.
图 2 室内实验中5种吸附剂-洗脱溶液组合在不同物质层面的表现散点位置代表平均值,线条长度代表标准误。不同字母代表在Tukey HSD成对检验中P<0.05。下同。Figure 2. Performance of five sorbent trap-elution solvent combinations across different substances in indoor experimentsDot represents average value and line length represents standard error. Different letters indicate significant differences (P<0.05) in the Tukey HSD pairwise test. Same below.2.1.2 实验2:不同连接方式吸附气味标准混合物的效果对比
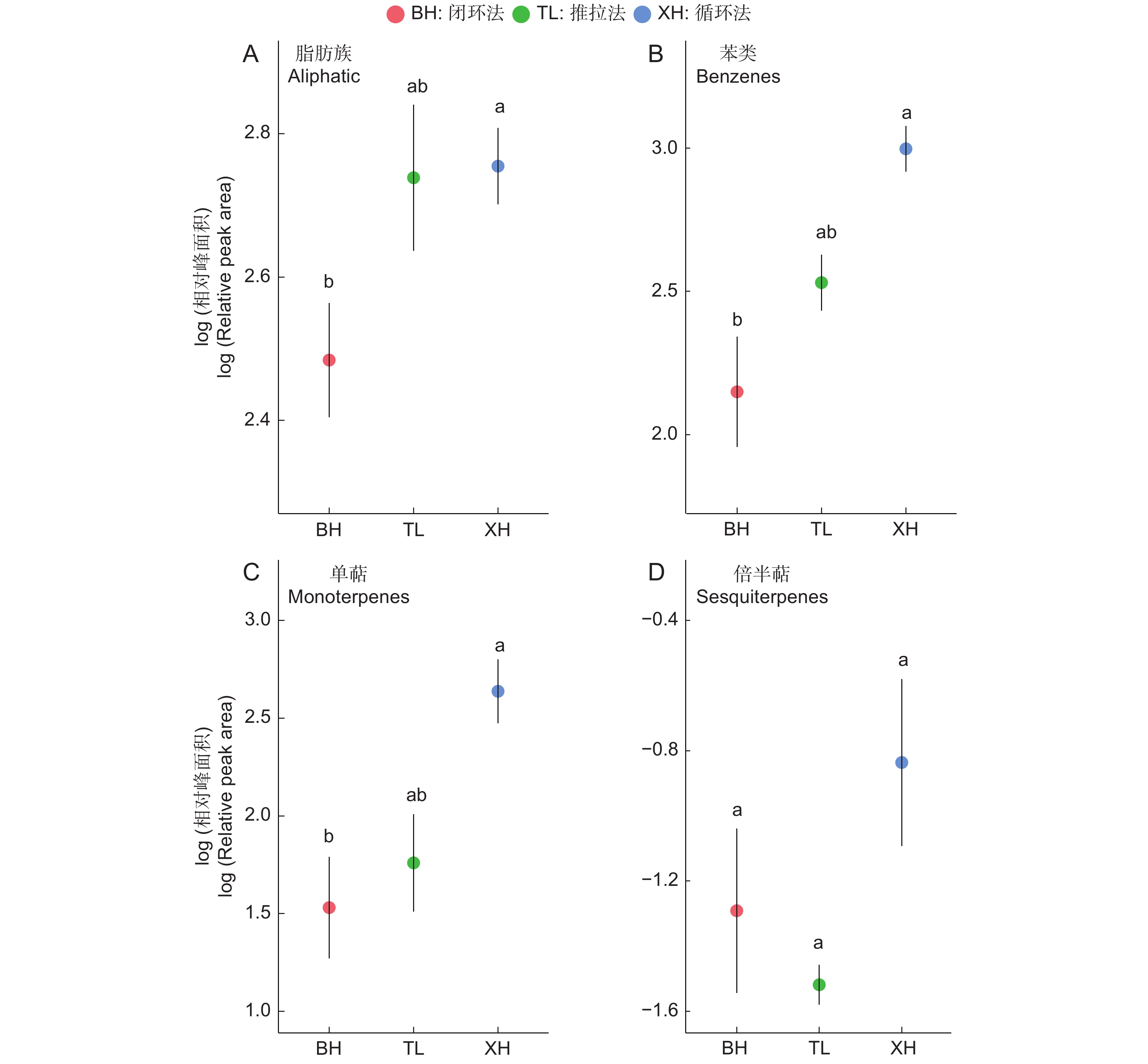
循环法在所有物质层面,均展现了最高的平均相对面积。但在所有物质层面,推拉法与循环法、推拉法与闭环法之间均不具有显著差异(P>0.05,图3)。方差分析结果显示,连接方式对脂肪族物质(F2,8=4.108,P=0.059,图3:A)以及倍半萜类物质(F2,8=2.195,P=0.174,图3:D)的吸附效果不具有显著影响,但却显著影响对苯类物质(F2,8=9.947,P=0.008,图3:B)与单萜类物质(F2,8=7.12,P=0.017,图3:C)的吸附效果。进一步的成对对比结果显示,在这两种物质中循环法显著优于闭环法(图3)。但值得注意的是,循环法中苯甲醛的相对面积高于沸点更低的辛烷。苯甲醛具有更高的沸点,Raguso和Pellmyr[14]的研究显示,当物质总量相同时,物质的相对面积通常随沸点上升逐步下降,因为沸点更高的物质通常更加难以挥发;这或许是因为吸附剂与过滤器之间的吸附效果不同,导致气味物质在吸附剂与过滤器之间发生了进一步分配,或改变了回流空气中残余气味物质的成分比例。以上现象的具体原因尚需进一步研究,但如果选择循环法进行实验,实验者需要更加慎重。此外,长时间的封闭环境偏离了植物的自然条件,对于活体植物的影响也不可忽视[1]。为此,本研究在实验3中优先选择了推拉法。
2.2 室外实验
2.2.1 实验3:不同吸附剂-洗脱溶液组合吸附自然花气味的效果对比
与室内实验相比,室外环境复杂多变,但室外环境通常是动态吸附法最真实的工作环境。实验结果显示,大花六道木以苯类与单萜类物质为主要挥发物。在实验3与实验4的所有结果中,这两类物质的挥发量平均占比均在94.7%以上(表3)。在实验3中,我们再一次对比了不同吸附剂-洗脱溶液组合的差异性。从检测出的物质种类数目来看,被检测的物质数目均为10种左右。其中,Propak Q-正己烷以及活性碳-二氯甲烷组合检测出了最多的物质成分(11种),而Propak Q-二氯甲烷组合与活性炭-正己烷组合只检测出9种物质成分(表3)。只有两种采用活性炭作为吸附剂的实验组以及Propak Q-正己烷组合,同时检测出了苯类、单萜、倍半萜与脂肪族4个功能群。在稀有成分上,Tenax TA组以及Propak Q-二氯甲烷组合均未检测出脂肪族物质(表3)。实验环境多变以及材料本身的生物学变异,均可能造成微量物质的较差的重复性。但值得注意的是,无论采用正己烷洗脱还是采用二氯甲烷洗脱的活性炭组,均未检测出主要挥发物苯乙醛,在其他3组实验中,苯乙醛的平均挥发量占比为25%~45%。
表 3 不同方法检测大花六道木花气味的实验结果Table 3. Experimental results of detecting floral scents in Abelia×grandiflora using different methods实验组
Group物质数字识别号码
CAS number名称
Name参考值
Value标准误
Standard error挥发速率
Emission rate / ng∙g−1∙h−1活性碳-
二氯甲烷100-51-6 苯甲醇 0.61 0.36 116.75 100-52-7 苯甲醛 9.98 6.66 1 913.80 123-35-3 月桂烯 0.06 0.01 12.25 140-11-4 乙酸苄酯 0.16 0.06 31.24 18172-67-3 β-蒎烯 3.03 0.64 580.63 23470-00-0 2-单棕榈酸甘油 0.35 0.35 67.05 3387-41-5 桧烯 0.12 0.04 23.85 5208-59-3 β-波旁烯 0.15 0.05 27.99 60-12-8 苯乙醇 0.74 0.3 141.77 80-56-8 α-蒎烯 11.09 1.86 2 127.34 87-44-5 β-石竹烯 0.39 0.13 74.67 活性碳-
正己烷100-51-6 苯甲醇 0.05 0.03 10.01 100-52-7 苯甲醛 2.23 1.92 428.56 18172-67-3 β-蒎烯 3.08 1.67 591.16 2867-05-2 α-thujene 0.04 0.02 7.08 3387-41-5 桧烯 0.08 0.04 16.24 5208-59-3 β-波旁烯 0.08 0.04 15.04 60-12-8 苯乙醇 0.11 0.09 21.07 72237-36-6 4-己烯-醋酸酯 0.03 0.01 6.57 80-56-8 α-蒎烯 6.94 3.67 1 330.45 Propak Q-
二氯甲烷100-51-6 苯甲醇 0.43 0.2 82.65 100-52-7 苯甲醛 5.69 2.43 1 090.83 119-36-8 水杨酸甲酯 0.06 0.05 10.59 122-78-1 苯乙醛 9.34 3.09 1 791.32 18172-67-3 β-蒎烯 0.92 0.5 177.23 3387-41-5 桧烯 0.02 0.02 4.18 60-12-8 苯乙醇 2.94 1.58 564.48 80-56-8 α-蒎烯 2.15 1.23 411.54 87-44-5 β-石竹烯 0.05 0.03 10.47 Propak Q-
正己烷100-51-6 苯甲醇 0.36 0.09 69.51 100-52-7 苯甲醛 6.07 1.38 1 164.27 119-36-8 水杨酸甲酯 0.05 0.02 9.24 122-78-1 苯乙醛 9.96 2.39 1 909.73 18172-67-3 β-蒎烯 0.81 0.33 155.24 2867-05-2 α-thujene 0.02 0.01 3.46 3387-41-5 桧烯 0.07 0.02 12.58 36653-82-4 十六醇 1.17 1.87 223.88 60-12-8 苯乙醇 2.35 0.97 450.36 80-56-8 α-蒎烯 2.57 1.03 492.12 87-44-5 β-石竹烯 0.07 0.02 13.50 Tenax TA-
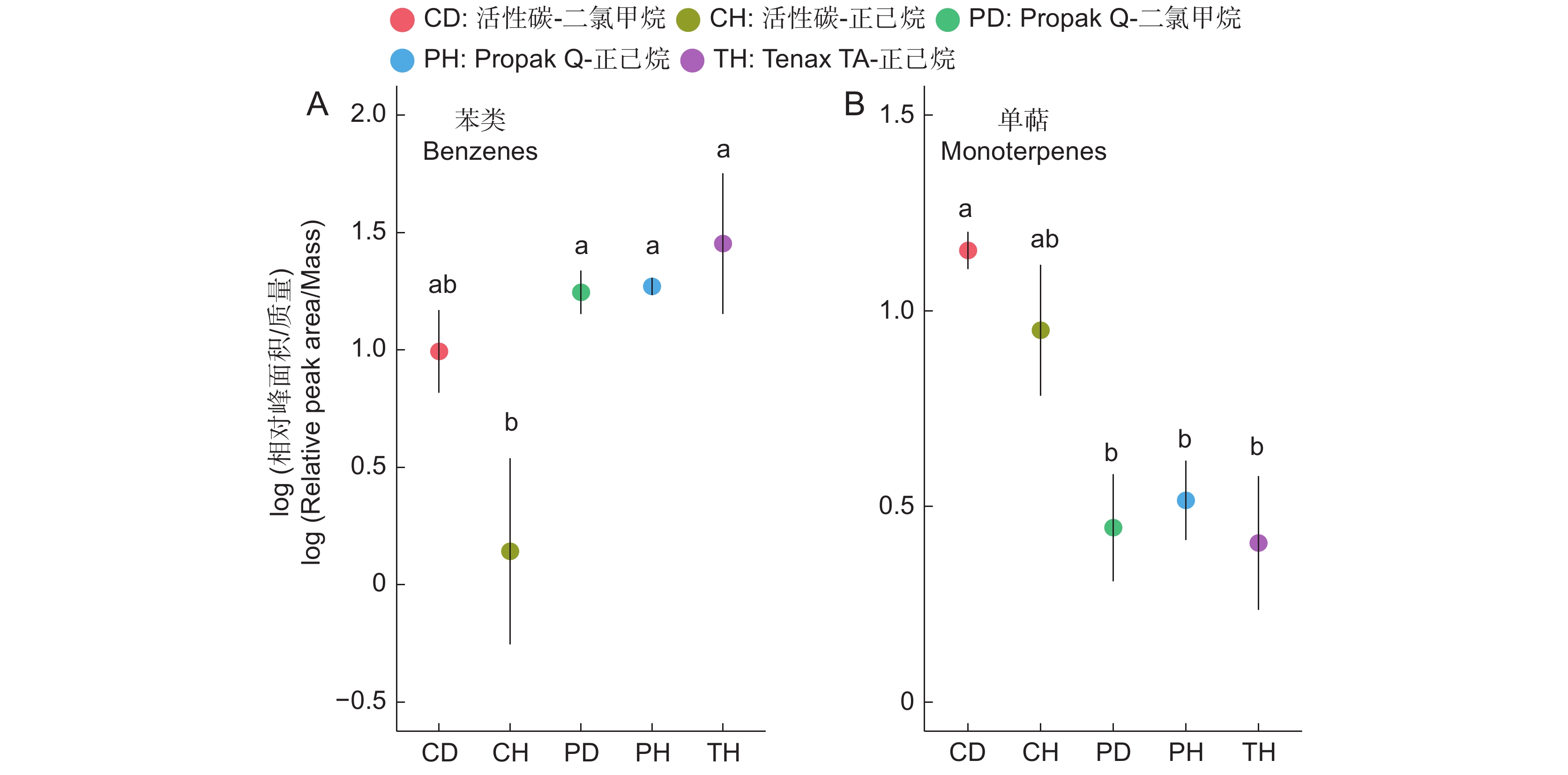
正己烷100-51-6 苯甲醇 1.00 0.36 191.97 100-52-7 苯甲醛 16.98 4.82 3 256.74 119-36-8 水杨酸甲酯 0.11 0.02 21.65 122-78-1 苯乙醛 8.40 1.8 1 610.69 18172-67-3 β-蒎烯 1.10 0.28 211.58 2867-05-2 α-thujene 0.02 0.02 3.81 5208-59-3 β-波旁烯 0.19 0.06 37.35 60-12-8 苯乙醇 2.18 0.49 418.78 80-56-8 α-蒎烯 1.82 1.62 348.15 87-44-5 β-石竹烯 0.27 0.15 52.65 闭环法 100-51-6 苯甲醇 0.52 0.14 79.86 100-52-7 苯甲醛 4.18 1.09 641.61 122-78-1 苯乙醛 0.58 0.23 89.67 1686-14-2 α-氧化蒎烯 0.07 0.04 11.33 18172-67-3 β-蒎烯 1.95 2.00 299.25 23470-00-0 2-单棕榈酸甘油 0.58 0.58 89.03 2867-05-2 α-thujene 0.02 0.03 2.90 3779-61-1 反式-β-罗勒烯 0.07 0.07 10.41 4501-58-0 龙脑烯醛 0.09 0.06 13.95 80-56-8 α-蒎烯 3.79 3.63 581.63 循环法 100-51-6 苯甲醇 0.20 0.04 30.68 100-52-7 苯甲醛 7.35 1.08 1 127.83 119-36-8 水杨酸甲酯 0.02 0.01 3.64 122-78-1 苯乙醛 1.55 0.26 237.5 1686-14-2 α-氧化蒎烯 0.03 0.01 4.51 18172-67-3 β-蒎烯 3.15 2.51 482.86 2867-05-2 α-thujene 0.03 0.02 5.00 3387-41-5 桧烯 0.11 0.07 17.01 60-12-8 苯乙醇 0.12 0.05 18.21 80-56-8 α-蒎烯 7.79 5.52 1 195.40 87-44-5 β-石竹烯 0.03 0.01 3.89 注:挥发速率 = (参考值×内参质量) ÷ 采样时间×(进气流速 ÷ 出气流速)。Propak Q-正己烷组合在实验4中代表推拉法。闭环法以及循环法的进气流速及出气流速均为200 mL/min。 Notes: Emission rate = (reference value×internal reference mass) ÷ sampling time×(push rate ÷ pull rate). Propak Q-hexane represents the push-pull method in Experiment 4. Push and pull rates were 200 mL/min in the closed-loop and circulation methods. 我们通过方差分析对比了不同吸附剂-洗脱溶液组合解析大花六道木两类主要挥发物的表现差异。结果显示,对于苯类物质,活性碳表现较差(F4,10=6.692,P=0.007,图4:A)。在成对对比中,采用正己烷洗脱的活性炭显著低于采用其他吸附剂的3个实验组,但与二氯甲烷洗脱的活性炭之间并不存在显著差异(图4:A),这与室内实验结果相同。而对于单萜类物质,活性碳首次展现出了一定的优势(F4,10=6.402,P=0.008,图4:B)。采用二氯甲烷洗脱的活性碳对单萜类物质的吸附效果显著高于采用不同吸附剂的3个实验组(图4:B)。
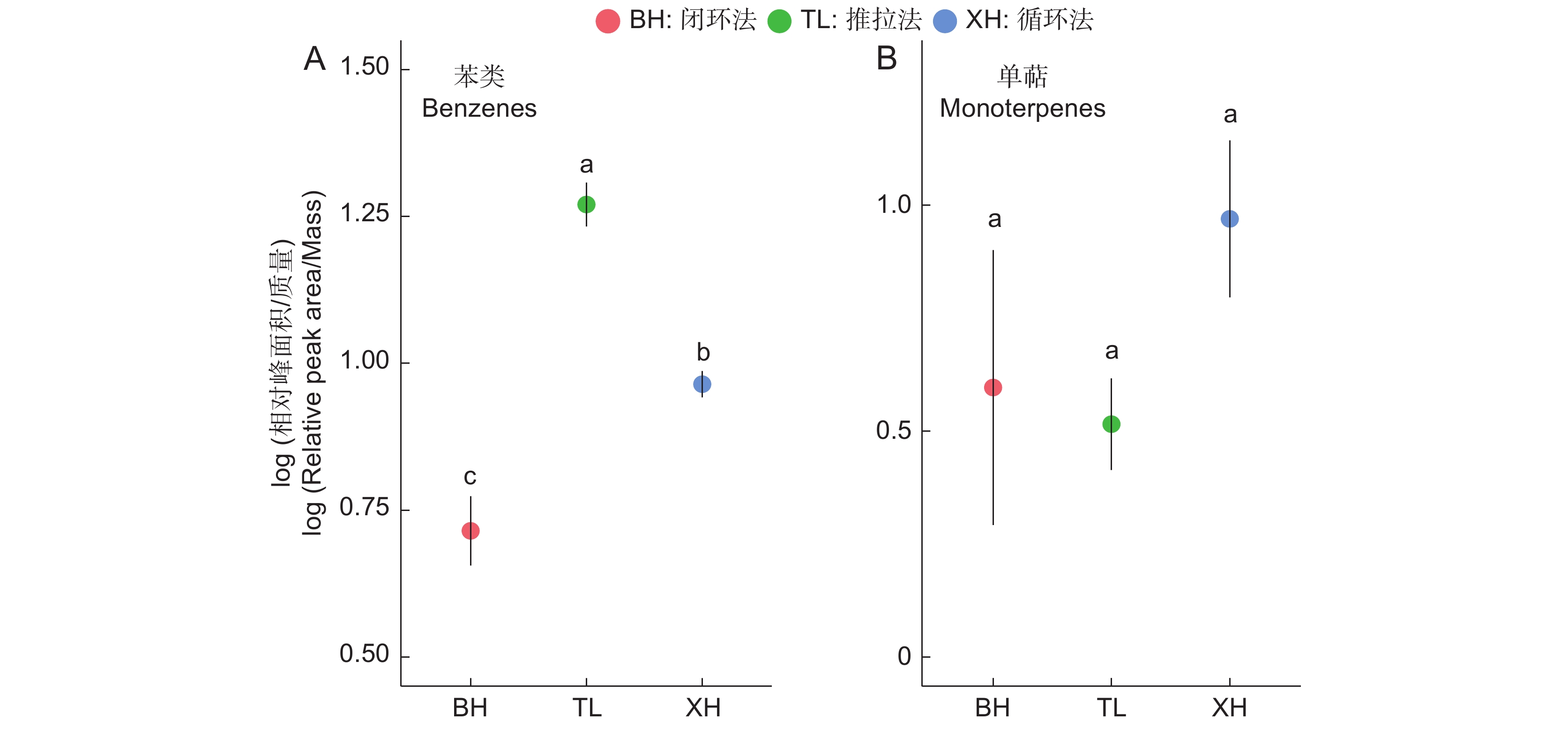
2.2.2 实验4:连接方式吸附自然花气味的效果对比
本研究同样在室外检测了3种连接方式的影响。相比于无代谢变化的人工气味来源,应注意密闭式的闭环法与循环法在真实条件下的工作表现。从物质种类上,推拉法与循环法均检测出了11种物质,而闭环法只检测出9种物质(表3)。与实验3相同,我们通过方差分析比对了不同实验组对苯类物质与单萜类物质的表现差异。结果显示,只有苯类物质受到连接方式的显著影响(F2,6=43.17,P<0.001,图5:B)。在成对对比中,对于苯类物质,3种连接方式彼此之间均具有显著差异(图5:A),按照吸附效果从高到低,依次为推拉法、循环法和闭环法。单萜类物质从高到低,依次为循环法、闭环法和推拉法,但彼此之间不具有显著差异(F2,6=1.315,P=0.336,图5:B)。而在室内实验中,循环法在各类物质中均具有最高的吸附效果,尽管循环法与推拉法在室内实验中不具有显著差异。这种变化可能是因为密闭环境中积蓄的气味物质引起了代谢改变[1]。
3. 讨论
相比于其他吸附剂与连接方式,本研究推荐使用Propak Q吸附剂和推拉法进行花气味研究。该方案具有最为广泛的适用性,尤其是进行群落水平研究时,该方案适合作为统一标准进行大规模的气味收集。而不同洗脱溶液在本研究中没有表现出显著差异。
3种吸附剂中,Propak Q的综合表现最为优秀。在室内实验中,Propak Q是唯一没有表现出明显缺陷的吸附剂。而活性炭与Tenax TA分别在苯类与脂肪族层面表现出了明显的缺陷(图2)。在室外实验中,Propak Q与Tenax TA表现类似。尽管室外实验中,二者均在单萜类物质层面显著低于活性炭-二氯甲烷组合(图4),但活性炭未能吸附部分主要成分(表3),展现出不理想的结果。在实验材料气味组成未知的情况下,或需要进行大规模的群落水平研究中,Propak Q是3种吸附剂中的最佳选择。
在过去的研究中, Raguso和Pellmyr [14]曾指出正己烷作为洗脱溶液更为优异。但在本研究中,洗脱溶液对于实验结果的影响十分有限,两种洗脱溶液的表现类似,这可能与实验材料的不同有关。当吸附剂相同时,无论室内实验还是室外实验,正己烷与二氯甲烷对于各类物质的洗脱效果接近。考虑到相似相溶原理,我们同样更加倾向于极性更低的正己烷作为洗脱溶液。虽然不具有显著性,但在实验中,Propak Q-正己烷组合通常比Propak Q-二氯甲烷组合表现优异。
连接方式同样是影响实验结果的重要因素。闭环法在3种连接方式中表现最差。无论室内实验还是室外实验,闭环法均是3种连接方式中表现最差的方法。在室内实验中,推拉法与循环法在各类物质层面的表现均不具有显著差异。但在室外实验中,推拉法的表现显著优于其他两种方法。这可能是因为顶空空间在密闭的环境下,积蓄的气味物质引起了植物的代谢变化,如负反馈调节。此外,或许是由于过滤器截留了部分气味物质,即使在采取人工气味源的室内实验中,循环法也表现出了偏离真实气味的可能。根据我们的实验结果,推拉法是3种装置中最为优秀的连接方式。同时,推拉法也是最为接近植物自然状态的连接方式。
由于实验条件限制,我们没有对比不同的色谱柱对于实验结果的影响。作为GC-MS的重要组件,色谱柱或许是影响实验结果的一个关键因素。不同的色谱柱对于不同物质的保留效果不同。保留效果较差的物质,往往会在最初溶剂保留的时间内直接流出。这些物质往往彼此之间混杂在一起,或与溶剂混杂在一起,导致无法检测。色谱柱的选择通常与待测物质的种类有关,不同物种的花气味不同,需要使用不同的色谱柱进行检测。在未来进一步的研究中,可以尝试探讨不同色谱柱对于实验结果的影响,以便于选择一个广泛适用的色谱柱,从而帮助群落研究统一标准。
-
图 2 室内实验中5种吸附剂-洗脱溶液组合在不同物质层面的表现
散点位置代表平均值,线条长度代表标准误。不同字母代表在Tukey HSD成对检验中P<0.05。下同。
Figure 2. Performance of five sorbent trap-elution solvent combinations across different substances in indoor experiments
Dot represents average value and line length represents standard error. Different letters indicate significant differences (P<0.05) in the Tukey HSD pairwise test. Same below.
表 1 使用动态顶空吸附法的花气味研究方案差异示例
Table 1 Examples of differences in floral scent research protocols using dynamic headspace collection
表 2 室内或室外实验中不同实验组的实验方案差异
Table 2 Differences in experimental schemes for different experimental groups in indoor or outdoor experiments
实验
Experiment实验组ID
Group ID吸附剂
Sorbent trap洗脱溶液
Elution solvent连接方式
Connection method实验1 1 活性炭 二氯甲烷 循环法 2 活性炭 正己烷 循环法 3 Propak Q 二氯甲烷 循环法 4 Propak Q 正己烷 循环法 5 Tenax TA 正己烷 循环法 实验2 4 Propak Q 正己烷 循环法 6 Propak Q 正己烷 推拉法 7 Propak Q 正己烷 闭环法 实验3 8 Charcoal 二氯甲烷 推拉法 9 Charcoal 正己烷 推拉法 10 Propak Q 二氯甲烷 推拉法 11 Propak Q 正己烷 推拉法 12 Tenax TA 正己烷 推拉法 实验4 13 Propak Q 正己烷 循环法 11 Propak Q 正己烷 推拉法 14 Propak Q 正己烷 闭环法 表 3 不同方法检测大花六道木花气味的实验结果
Table 3 Experimental results of detecting floral scents in Abelia×grandiflora using different methods
实验组
Group物质数字识别号码
CAS number名称
Name参考值
Value标准误
Standard error挥发速率
Emission rate / ng∙g−1∙h−1活性碳-
二氯甲烷100-51-6 苯甲醇 0.61 0.36 116.75 100-52-7 苯甲醛 9.98 6.66 1 913.80 123-35-3 月桂烯 0.06 0.01 12.25 140-11-4 乙酸苄酯 0.16 0.06 31.24 18172-67-3 β-蒎烯 3.03 0.64 580.63 23470-00-0 2-单棕榈酸甘油 0.35 0.35 67.05 3387-41-5 桧烯 0.12 0.04 23.85 5208-59-3 β-波旁烯 0.15 0.05 27.99 60-12-8 苯乙醇 0.74 0.3 141.77 80-56-8 α-蒎烯 11.09 1.86 2 127.34 87-44-5 β-石竹烯 0.39 0.13 74.67 活性碳-
正己烷100-51-6 苯甲醇 0.05 0.03 10.01 100-52-7 苯甲醛 2.23 1.92 428.56 18172-67-3 β-蒎烯 3.08 1.67 591.16 2867-05-2 α-thujene 0.04 0.02 7.08 3387-41-5 桧烯 0.08 0.04 16.24 5208-59-3 β-波旁烯 0.08 0.04 15.04 60-12-8 苯乙醇 0.11 0.09 21.07 72237-36-6 4-己烯-醋酸酯 0.03 0.01 6.57 80-56-8 α-蒎烯 6.94 3.67 1 330.45 Propak Q-
二氯甲烷100-51-6 苯甲醇 0.43 0.2 82.65 100-52-7 苯甲醛 5.69 2.43 1 090.83 119-36-8 水杨酸甲酯 0.06 0.05 10.59 122-78-1 苯乙醛 9.34 3.09 1 791.32 18172-67-3 β-蒎烯 0.92 0.5 177.23 3387-41-5 桧烯 0.02 0.02 4.18 60-12-8 苯乙醇 2.94 1.58 564.48 80-56-8 α-蒎烯 2.15 1.23 411.54 87-44-5 β-石竹烯 0.05 0.03 10.47 Propak Q-
正己烷100-51-6 苯甲醇 0.36 0.09 69.51 100-52-7 苯甲醛 6.07 1.38 1 164.27 119-36-8 水杨酸甲酯 0.05 0.02 9.24 122-78-1 苯乙醛 9.96 2.39 1 909.73 18172-67-3 β-蒎烯 0.81 0.33 155.24 2867-05-2 α-thujene 0.02 0.01 3.46 3387-41-5 桧烯 0.07 0.02 12.58 36653-82-4 十六醇 1.17 1.87 223.88 60-12-8 苯乙醇 2.35 0.97 450.36 80-56-8 α-蒎烯 2.57 1.03 492.12 87-44-5 β-石竹烯 0.07 0.02 13.50 Tenax TA-
正己烷100-51-6 苯甲醇 1.00 0.36 191.97 100-52-7 苯甲醛 16.98 4.82 3 256.74 119-36-8 水杨酸甲酯 0.11 0.02 21.65 122-78-1 苯乙醛 8.40 1.8 1 610.69 18172-67-3 β-蒎烯 1.10 0.28 211.58 2867-05-2 α-thujene 0.02 0.02 3.81 5208-59-3 β-波旁烯 0.19 0.06 37.35 60-12-8 苯乙醇 2.18 0.49 418.78 80-56-8 α-蒎烯 1.82 1.62 348.15 87-44-5 β-石竹烯 0.27 0.15 52.65 闭环法 100-51-6 苯甲醇 0.52 0.14 79.86 100-52-7 苯甲醛 4.18 1.09 641.61 122-78-1 苯乙醛 0.58 0.23 89.67 1686-14-2 α-氧化蒎烯 0.07 0.04 11.33 18172-67-3 β-蒎烯 1.95 2.00 299.25 23470-00-0 2-单棕榈酸甘油 0.58 0.58 89.03 2867-05-2 α-thujene 0.02 0.03 2.90 3779-61-1 反式-β-罗勒烯 0.07 0.07 10.41 4501-58-0 龙脑烯醛 0.09 0.06 13.95 80-56-8 α-蒎烯 3.79 3.63 581.63 循环法 100-51-6 苯甲醇 0.20 0.04 30.68 100-52-7 苯甲醛 7.35 1.08 1 127.83 119-36-8 水杨酸甲酯 0.02 0.01 3.64 122-78-1 苯乙醛 1.55 0.26 237.5 1686-14-2 α-氧化蒎烯 0.03 0.01 4.51 18172-67-3 β-蒎烯 3.15 2.51 482.86 2867-05-2 α-thujene 0.03 0.02 5.00 3387-41-5 桧烯 0.11 0.07 17.01 60-12-8 苯乙醇 0.12 0.05 18.21 80-56-8 α-蒎烯 7.79 5.52 1 195.40 87-44-5 β-石竹烯 0.03 0.01 3.89 注:挥发速率 = (参考值×内参质量) ÷ 采样时间×(进气流速 ÷ 出气流速)。Propak Q-正己烷组合在实验4中代表推拉法。闭环法以及循环法的进气流速及出气流速均为200 mL/min。 Notes: Emission rate = (reference value×internal reference mass) ÷ sampling time×(push rate ÷ pull rate). Propak Q-hexane represents the push-pull method in Experiment 4. Push and pull rates were 200 mL/min in the closed-loop and circulation methods. -
[1] Tholl D,Boland W,Hansel A,Loreto F,Röse USR,Schnitzler JP. Practical approaches to plant volatile analysis[J]. Plant J,2006,45(4):540−560. doi: 10.1111/j.1365-313X.2005.02612.x
[2] Pichersky E,Gershenzon J. The formation and function of plant volatiles:perfumes for pollinator attraction and defense[J]. Curr Opin Plant Biol,2002,5(3):237−243. doi: 10.1016/S1369-5266(02)00251-0
[3] Raguso RA. Wake up and smell the roses:the ecology and evolution of floral scent[J]. Annu Rev Ecol Evol Syst,2008,39:549−569. doi: 10.1146/annurev.ecolsys.38.091206.095601
[4] Schiestl FP. Ecology and evolution of floral volatile-mediated information transfer in plants[J]. New Phytol,2015,206(2):571−577. doi: 10.1111/nph.13243
[5] Rosenstiel TN,Shortlidge EE,Melnychenko AN,Pankow JF,Eppley SM. Sex-specific volatile compounds influence microarthropod-mediated fertilization of moss[J]. Nature,2012,489(7416):431−433. doi: 10.1038/nature11330
[6] Cardé RT,Willis MA. Navigational strategies used by insects to find distant,wind-borne sources of odor[J]. J Chem Ecol,2008,34(7):854−866. doi: 10.1007/s10886-008-9484-5
[7] Menzel R. Memory dynamics in the honeybee[J]. J Comp Physiol A,1999,185(4):323−340. doi: 10.1007/s003590050392
[8] Kantsa A,Raguso RA,Dyer AG,Sgardelis SP,Olesen JM,Petanidou T. Community-wide integration of floral colour and scent in a Mediterranean scrubland[J]. Nat Ecol Evol,2017,1(10):1502−1510. doi: 10.1038/s41559-017-0298-0
[9] Kantsa A,Raguso RA,Lekkas T,Kalantzi OI,Petanidou T. Floral volatiles and visitors:a meta-network of associations in a natural community[J]. J Ecol,2019,107(6):2574−2586. doi: 10.1111/1365-2745.13197
[10] Larue AAC,Raguso RA,Junker RR. Experimental manipulation of floral scent bouquets restructures flower-visitor interactions in the field[J]. J Anim Ecol,2016,85(2):396−408. doi: 10.1111/1365-2656.12441
[11] Bergström G,Appelgren M,Borg-Karlson AK,Groth I,Strömberg S,Strömberg S. Studies on natural odoriferous compounds. XXⅡ. Techniques for the isolation/enrichment of plant volatiles in the analyses of Ophrys orchids (Orchidaceae)[J]. Chem Scr,1980,16(5):173−180.
[12] Ray HA,Stuhl CJ,Gillett-Kaufman JL. Rapid collection of floral fragrance volatiles using a headspace volatile collection technique for GC-MS thermal desorption sampling[J]. J Vis Exp,2019(154):e58928.
[13] Belliardo F,Bicchi C,Cordero C,Liberto E,Rubiolo P,Sgorbini B. Headspace-solid-phase microextraction in the analysis of the volatile fraction of aromatic and medicinal plants[J]. J Chromatogr Sci,2006,44(7):416−429. doi: 10.1093/chromsci/44.7.416
[14] Raguso RA,Pellmyr O. Dynamic headspace analysis of floral volatiles:a comparison of methods[J]. Oikos,1998,81(2):238−254. doi: 10.2307/3547045
[15] Raguso RA,Levin RA,Foose SE,Holmberg MW,McDade LA. Fragrance chemistry,nocturnal rhythms and pollination "syndromes" in Nicotiana[J]. Phytochemistry,2003,63(3):265−284. doi: 10.1016/S0031-9422(03)00113-4
[16] Wei JN,Zhu JW,Kang L. Volatiles released from bean plants in response to agromyzid flies[J]. Planta,2006,224(2):279−287. doi: 10.1007/s00425-005-0212-x
[17] Horiuchi JI,Badri DV,Kimball BA,Negre F,Dudareva N,et al. The floral volatile,methyl benzoate,from snapdragon (Antirrhinum majus) triggers phytotoxic effects in Arabidopsis thaliana[J]. Planta,2007,226(1):1−10. doi: 10.1007/s00425-006-0464-0
[18] Dudareva N,Andersson S,Orlova I,Gatto N,Reichelt M,et al. The nonmevalonate pathway supports both monoterpene and sesquiterpene formation in snapdragon flowers[J]. Proc Natl Acad Sci USA,2005,102(3):933−938. doi: 10.1073/pnas.0407360102
[19] Wang H,Zhou WL,Li Z,Niklas KJ,Sun SC. Plant volatiles mediate evolutionary interactions between plants and tephritid flies and are evolutionarily more labile than non-volatile defenses[J]. J Anim Ecol,2021,90(4):846−858. doi: 10.1111/1365-2656.13414
[20] Zhang WB,Jiang YF,Chen SM,Chen FD,Chen F. Concentration-dependent emission of floral scent terpenoids from diverse cultivars of Chrysanthemum morifolium and their wild relatives[J]. Plant Sci,2021,309:110959. doi: 10.1016/j.plantsci.2021.110959
[21] Haynes KF,Zhao JZ,Latif A. Identification of floral compounds from Abelia grandiflora that stimulate upwind flight in cabbage looper moths[J]. J Chem Ecol,1991,17(3):637−646. doi: 10.1007/BF00982132
[22] Chamberlain K,Khan ZR,Pickett JA,Toshova T,Wadhams LJ. Diel periodicity in the production of green leaf volatiles by wild and cultivated host plants of stemborer moths,Chilo partellus and Busseola fusca[J]. J Chem Ecol,2006,32(3):565−577. doi: 10.1007/s10886-005-9016-5
[23] Friberg M,Schwind C,Raguso RA,Thompson JN. Extreme divergence in floral scent among woodland star species (Lithophragma spp.) pollinated by floral parasites[J]. Ann Bot,2013,111(4):539−550. doi: 10.1093/aob/mct007
[24] Zu PJ,Blanckenhorn WU,Schiestl FP. Heritability of floral volatiles and pleiotropic responses to artificial selection in Brassica rapa[J]. New Phytol,2016,209(3):1208−1219. doi: 10.1111/nph.13652
[25] Saunier A,Blande JD. The effect of elevated ozone on floral chemistry of Brassicaceae species[J]. Environ Pollut,2019,255:113257. doi: 10.1016/j.envpol.2019.113257
[26] Donath J,Boland W. Biosynthesis of acyclic homoterpenes:enzyme selectivity and absolute configuration of the nerolidol precursor[J]. Phytochemistry,1995,39(4):785−790. doi: 10.1016/0031-9422(95)00082-I
[27] Koch T,Krumm T,Jung V,Engelberth J,Boland W. Differential induction of plant volatile biosynthesis in the lima bean by early and late intermediates of the octadecanoid-signaling pathway[J]. Plant Physiol,1999,121(1):153−162. doi: 10.1104/pp.121.1.153
[28] Collignon RM,Swift IP,Zou YF,McElfresh JS,Hanks LM,Millar JG. The influence of host plant volatiles on the attraction of longhorn beetles to pheromones[J]. J Chem Ecol,2016,42(3):215−229. doi: 10.1007/s10886-016-0679-x
[29] Tholl D,Chen F,Petri J,Gershenzon J,Pichersky E. Two sesquiterpene synthases are responsible for the complex mixture of sesquiterpenes emitted from Arabidopsis flowers[J]. Plant J,2005,42(5):757−771. doi: 10.1111/j.1365-313X.2005.02417.x
[30] 李海东,高岩,金幼菊. 珍珠梅花挥发性物质日动态变化的研究[J]. 内蒙古农业大学学报,2004,25(2):54−59. Li HD,Gao Y,Jin YJ. The daily dymamic variances of the vocs releasing from flower of Siberia kirilowii (regel) maxim[J]. Journal of Inner Mongolia Agricultural University,2004,25(2):54−59.
[31] 高群英,高岩,张汝民,杜明利,李刚. 3种菊科植物香气成分的热脱附气质联用分析[J]. 浙江农林大学学报,2011,28(2):326−332. Gao QY,Gao Y,Zhang RM,Du ML,Li G. Aromatic composition in three plant species using TDS-GC/MS[J]. Journal of Zhejiang A& F University,2011,28(2):326−332.
[32] 蔡宙霏,陈雅奇,许馨露,王小东,汪俊宇,等. 4个桂花品种开花进程释放VOCs动态变化分析[J]. 浙江农林大学学报,2017,34(4):608−619. Cai ZF,Chen YQ,Xu XL,Wang XD,Wang JY,et al. Changes of volatile organic compounds released during flowering in four Osmanthus fragrans cultivar groups[J]. Journal of Zhejiang A&F University,2017,34(4):608−619.
[33] 韦赛君,张静,王翔,吕嘉欣,王彬,等. 金钱松林挥发物季节性变化对空气负离子及微生物的影响[J]. 江西农业大学学报,2021,43(6):1316−1326. Wei SJ,Zhang J,Wang X,Lü JX,Wang B,et al. Effects of seasonal variation of volatiles in Pseudolarix amabilis forest on air anion and microorganism[J]. Acta Agriculturae Universitatis Jiangxiensis,2021,43(6):1316−1326.



 下载:
下载: