Overexpression of OsTTG1 affects the epidermal trichome, anthocyanins, and flowering stage in Arabidopsis thaliana (L.) Heynh.
-
摘要:
OsTTG1编码WD40结构域重复蛋白,在水稻(Oryza sativa L.)中与花青素积累有关,但是否影响其他性状尚不清楚。本研究中,我们在拟南芥(Arabidopsis thaliana (L.) Heynh.)突变体ttg1中过表达OsTTG1基因,结果显示,OsTTG1-OE株系的叶片和茎秆上均有花青素积累,种子呈棕褐色,叶片、茎秆、花萼等部位均出现表皮毛。突变体ttg1的开花时间比Col-0和OsTTG1-OE株系早了大约3~5 d,而Col-0和OsTTG1-OE的开花时间没有明显差异。利用RNA-seq技术分析OsTTG1-OE与ttg1在不同时期的差异表达基因(DEGs),发现这些DEGs包括可能与花青素合成相关的基因(MKK9、CYP75B1、TT8、GSTF12、DFR、F3H、CHS、LDOX等)、可能与表皮毛形成相关的基因(SPL15、TCL1、ETC2、SPL4、SPL13A、ETC3、GIS等)以及可能与开花相关的基因(FLC、FT、AGL19、HDA05、LHY等)。研究结果可为了解OsTTG1在水稻中的功能提供基础和借鉴。
Abstract:The OsTTG1 gene encodes a WD40 domain repeat protein, with its knockout in Oryza sativa L. known to affect anthocyanin accumulation. However, whether this gene affects other traits remains unclear. In this study, OsTTG1 was overexpressed in the Arabidopsis thaliana (L.) Heynh. ttg1 mutant. Results showed that overexpression of OsTTG1 (OsTTG1-OE) restored anthocyanin accumulation in leaves and stalks, produced dark brown seeds, and promoted epidermal hair development on leaves, stalks, and calyces. In contrast, the ttg1 mutant exhibited flowering 3–5 d earlier than both the Col-0 and OsTTG1-OE strains, while no significant differences in flowering time were observed between Col-0 and OsTTG1-OE. RNA-seq analysis of differentially expressed genes (DEGs) between OsTTG1-OE and ttg1 at various developmental stages revealed key gene clusters potentially associated with anthocyanin synthesis (MKK9, CYP75B1, TT8, GSTF12, DFR, F3H, CHS, and LDOX), epidermal hair formation (SPL15, TCL1, ETC2, SPL4, SPL13A, ETC3, and GIS), and flowering regulation (FLC, FT, AGL19, HDA5, and LHY). These findings provide an important theoretical basis and reference for understanding the function of OsTTG1 in O. sativa.
-
Keywords:
- OsTTG1 /
- Arabidopsis thaliana /
- Overexpression /
- Epidermal trichome /
- Anthocyanins /
- Flowering stage
-
TRANSPARENT TESTA GLABRA1(TTG1)是一种串连肽重复蛋白[1],含有7个WD40结构域。TTG1基因对植物生长发育具有重要意义,能够参与调控多种生命活动,譬如:调节花青素的积累[2]、表皮毛和根毛的密度[3],影响种子大小、种皮颜色以及种皮粘液的合成[4],调控开花时间[5]等。
花青素作为类黄酮化合物[6],具有较强的抗氧化[7]和抗炎[8]作用。植物中花青素的积累,使植物具有吸引传粉者[9]、免受紫外线或病虫侵害[10]等多种生物学功能。TTG1在花青素合成过程中极为重要,突变体ttg1中花青素的积累受阻[11]。拟南芥(Arabidopsis thaliana (L.) Heynh.)中,花青素转录激活有两种调控方式,一种是不依赖bHLH转录因子的MYB转录因子和WD40蛋白形成的二元复合体协同调控,如:TTG1-GL3/TT8-TT2复合物通过激活DFR、ANS、BAN、TT9和TT12的表达来调控花青素的生物合成[12-14];另一种是MYB转录因子、bHLH转录因子以及WD40蛋白形成三元复合体来协同调控,如:TTG1-TT8/GL3-PAP1/PAP2/MYB113/MYB114复合物通过激活DFR、ANS、BAN、UF3GT的表达来调控花青素的生物合成[15-17]。
表皮毛是植物地上部分表面的附属物,具有减少水分蒸发及病虫侵害的作用[18]。研究表明,R2R3-MYB型转录因子(MYB23、MYB82、GL3)、MYC1编码的bHLH型转录因子[19]、WD40类重复蛋白(TTG1、TT8、GL3、EGL3)[20, 21]、C2H2锌指蛋白家族基因(GIS、GIS2、GIS3、ZFP5、ZFP6、ZFP8)等能够正调控拟南芥表皮毛的发育[22-24];而R3-MYB转录因子(ETC1、ETC2、ETC3、TCL1、TCL2、TRY、CPC等)能够负调控其发育[25]。突变体ttg1具有无表皮毛的特征[11],说明TTG1在表皮毛发育过程中起着关键作用。TTG1能够与R2R3-MYB转录因子中的GL1、MYB23以及bHLH转录因子中的GL3、EGL3相互作用,形成MBW,激活下游基因GL2的表达,从而促进表皮毛的生长发育[26]。TTG1也能够与SPL转录因子中的SPL4或SPL5相互作用,从而影响MBW复合物的转录活性,导致毛状体起始受到抑制[27]。
开花是植物从营养期向生殖期过渡的重要性状。研究发现,ttg1突变体比野生型早开花,TTG1过表达植株则比野生型晚开花[5],表明TTG1能够调控植物的开花时间。FLC是编码MADS-box转录因子的开花抑制基因[28],TTG1位于FLC的上游,Paffendorf 等[5]发现TTG1可以激活FLC的表达,调节开花时间。FT是一种成花素基因[29],通常在叶片中表达,转移到茎尖分生组织,进而诱导开花[14]。FLC通过与FT的启动子区域相结合,可以抑制FT的表达,促使植物形成晚花表型。
TTG1除了能够影响拟南芥的花青素生物合成、表皮毛生长以及开花期外,还能影响其种皮粘液的产生以及根毛密度等[11]。TTG1对种皮粘液的调控也是依靠形成MBW复合物来进行,MBW复合物可以激活TTG2和GL2的表达,进而激活粘液生物合成基因MUM4的表达,导致种皮粘液的产生[30]。TTG1除了可以直接调节粘液生物合成基因的表达,还可以通过调节种子中脂肪酸的积累来间接调节种皮粘液的产生[31]。TTG1参与形成的MBW复合物能够调节植物激素乙烯(ET)的形成[32],进而影响植物根毛密度。
前期研究中,我们从水稻(Oryza sativa L.)中图位克隆了OsTTG1基因,并利用CRISPR/Cas9技术研究了其功能,发现OsTTG1可以调控水稻叶片、叶鞘和种皮等组织部位的花青素生物合成[7]。本研究利用转基因技术在拟南芥突变体ttg1中过表达OsTTG1基因,研究结果旨在探究该基因的其他生物学功能,并为其开发利用提供科学依据。
1. 材料与方法
1.1 材料
拟南芥突变体ttg1购自Arashare(中国拟南芥突变体服务中心)。野生型Col-0和OsTTG1过表达株系OsTTG1-OE由本实验保存。
1.2 材料种植和表型观察
取适量拟南芥种子放入1.5 mL的离心管中,向离心管加入0.1%的琼脂糖溶液,并将其放入4 ℃冰箱中保存3~4 d[33]。将春化处理过的种子均匀地播撒于基质中,在温度为18 ℃~20 ℃、湿度为60%~70%的培养箱中培养。
分别取拟南芥Col-0、ttg1、OsTTG1-OE的种子、植株从根基部开始往上1 cm左右的茎段、以及叶片和花序等材料,放置到体视显微镜下观察,并拍照保存。使用佳能EOS R5相机对莲座期、开花期、结荚期的拟南芥进行拍照。不同基因型的拟南芥在相同条件、相同设置下进行观察及拍照。
1.3 OsTTG1基因的克隆与载体的构建
通过PCR方法克隆目的基因,用琼脂糖凝胶电泳确定目的条带的位置,按照胶回收试剂盒说明书,进行目的片段的回收。PCR引物为CAM-FLAG-
45810 (F:5'-TTTGGAGAGGACACGCTCGAGATGGAGCAGCCCAAGCCG-3';R:5'-GTCATCCTTGTAGTCGAATTCGACCCTGAGAAGCTGGACCTTGT-3')。用EocRⅠ和XhoⅠ对质粒CAM-flag进行双酶切,琼脂糖凝胶电泳检测酶切产物,回收载体大片段对应的条带。将目的DNA片段与线性化载体进行连接,形成重组克隆载体。将连接产物转化大肠杆菌感受态细胞DH5α,使用单菌落PCR进行阳性克隆鉴定。利用Plasmid Mini Kit Ⅰ试剂盒提取测序正确的质粒,采用冻融法直接转化农杆菌GV3101,使用单菌落PCR进行阳性克隆鉴定。单菌落PCR检测的引物均为P(F:5'-AGAAGACGTTCCAACCACG-3';R:5'-CGGTAAGGATCTGAGCTACAC-3')。1.4 拟南芥转基因及转化植株的筛选
将含阳性重组质粒的农杆菌接种于含有抗生素的LB液体培养基中,获得转化液。采用花序侵染法转化拟南芥[34],收集T0代种子。将T0代种子播种于含有抗生素的MS培养基中,筛选具有抗性的拟南芥植株。选取生长健壮的植株移栽至育苗基质中进行培养。待种子成熟后,按单株收集T1代种子,连续培养具有抗性的拟南芥,获得纯合的T3代种子,用于后续实验以及表型鉴定。
1.5 转基因植株PCR鉴定及RT-PCR分析
提取拟南芥野生型和转基因阳性植株的DNA。分别以转基因、野生型植株的DNA、H2O和农杆菌菌液为模板,进行PCR鉴定,引物为45810(F:5'-CTTCACCTGCGAGCTGC-3';R:5'-CTTGTCGTGCGCGATGAG-3')。
对拟南芥野生型、突变体ttg1和OsTTG1-OE株系进行RT-PCR分析。总RNA提取按照 RNeasy Plant Mini kit 说明书进行。使用TaKaRa试剂盒进行反转录,获得cDNA。以ACTIN2为内参,利用RT-PCR检测AtTTG1和OsTTTG1在不同基因型中的表达情况。引物分别为:ACTIN2(F:5'-ACCTTGCTGGACGTGACCTTACTGAT-3';R:5'-GTTGTCTCGTGGATTCCAGCAGCTT-3');TTG1(F:5'-CAACATATGATGGATAATTCAGCTCCAGATTCG-3';R:5'-CAACTTAAGTCAAACTCTAAGGAGCTGCATTTTG-3')以及OsTTG1(F:5'-TTACTCTGAACTCCCCGACCCG-3';R:5'-GTTGGATTCGCTTCGCTTTGCT-3')。
1.6 RNA-seq分析
为进一步挖掘引起OsTTG1-OE表型变化的基因,选取莲座期、抽薹期和结荚期3个关键时期,对ttg1和OsTTG1-OE植株的地上部分进行取样,每个时期、每种基因型取4个重复,共24个样品,进行转录组测序。
提取24个样品的总RNA,利用Nanodrop 2000对RNA的浓度和纯度进行检测,用琼脂糖凝胶电泳检测RNA的完整性,使用Agilent 2100测定RIN值。将检测合格的样品进行文库构建,确保文库质量合格,然后选择Illumina平台,进行上机测序。
1.7 生物信息学分析流程
使用TopHat 2软件将得到的Clean data与指定的参考基因组进行序列比对,获得Mapped data。参考基因组版本为TAIR10,来源于网站http://plants.ensembl.org/Arabidopsis_thaliana/Info/Index,同时对测序的结果进行质量评估。使用DESeq 2软件进行差异表达基因(Differentially expressed genes, DEGs)分析,筛选阈值为:|log2FC|≥1,且 padjust<0.05。结合GraphPad Prism 5.0软件和在线网站(https://www.bioinformatics.com.cn/)等进行作图分析。
2. 结果与分析
2.1 植物表达载体的构建和遗传转化拟南芥
用EocRⅠ和XhoⅠ双酶切质粒CAM-flag,回收载体大片段。将目的DNA片段与线性化载体连接,连接产物转化大肠杆菌感受态细胞DH5α,获得了阳性克隆。
利用试剂盒提取测序正确的重组质粒,采用冻融法直接转化农杆菌GV3101。经抗性平板筛选,菌落PCR进行阳性克隆鉴定,发现可扩增出明亮单一的条带,且与预期片段大小相符,可用于遗传转化实验。
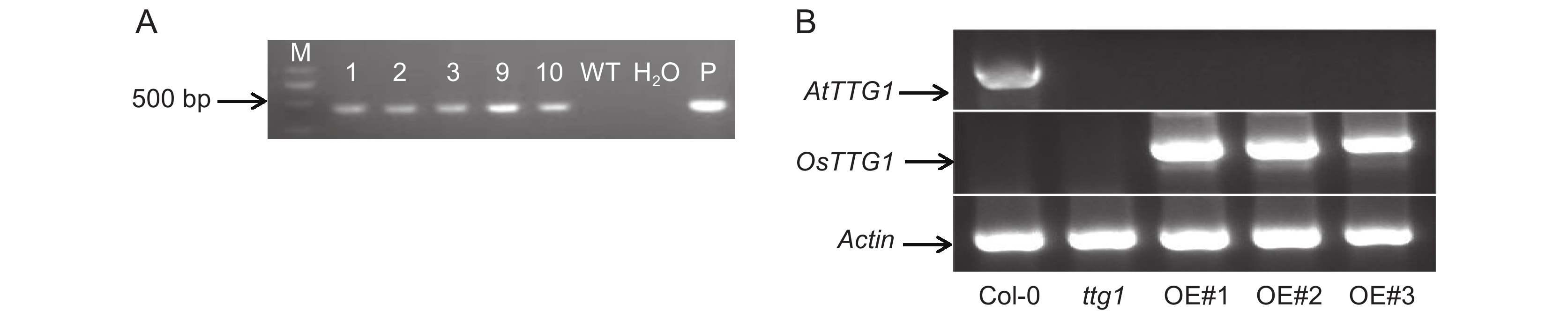
将含阳性重组质粒的农杆菌接种于含抗生素的LB液体培养基中,制备转化液。采用花序侵染法侵染拟南芥突变体ttg1,获得了T0代转基因植株种子。将T0代种子进行抗性筛选,直到获得转基因纯合体株系。PCR检测验证了OsTTG1在转基因植株中的表达(图1:A),获得OsTTG1-OE拟南芥。利用RT-PCR检测OsTTG1在野生型、突变体以及过表达植株中的表达量,发现OsTTG1在过表达植株中稳定高表达(图1:B)。
2.2 拟南芥种子及植株表型分析
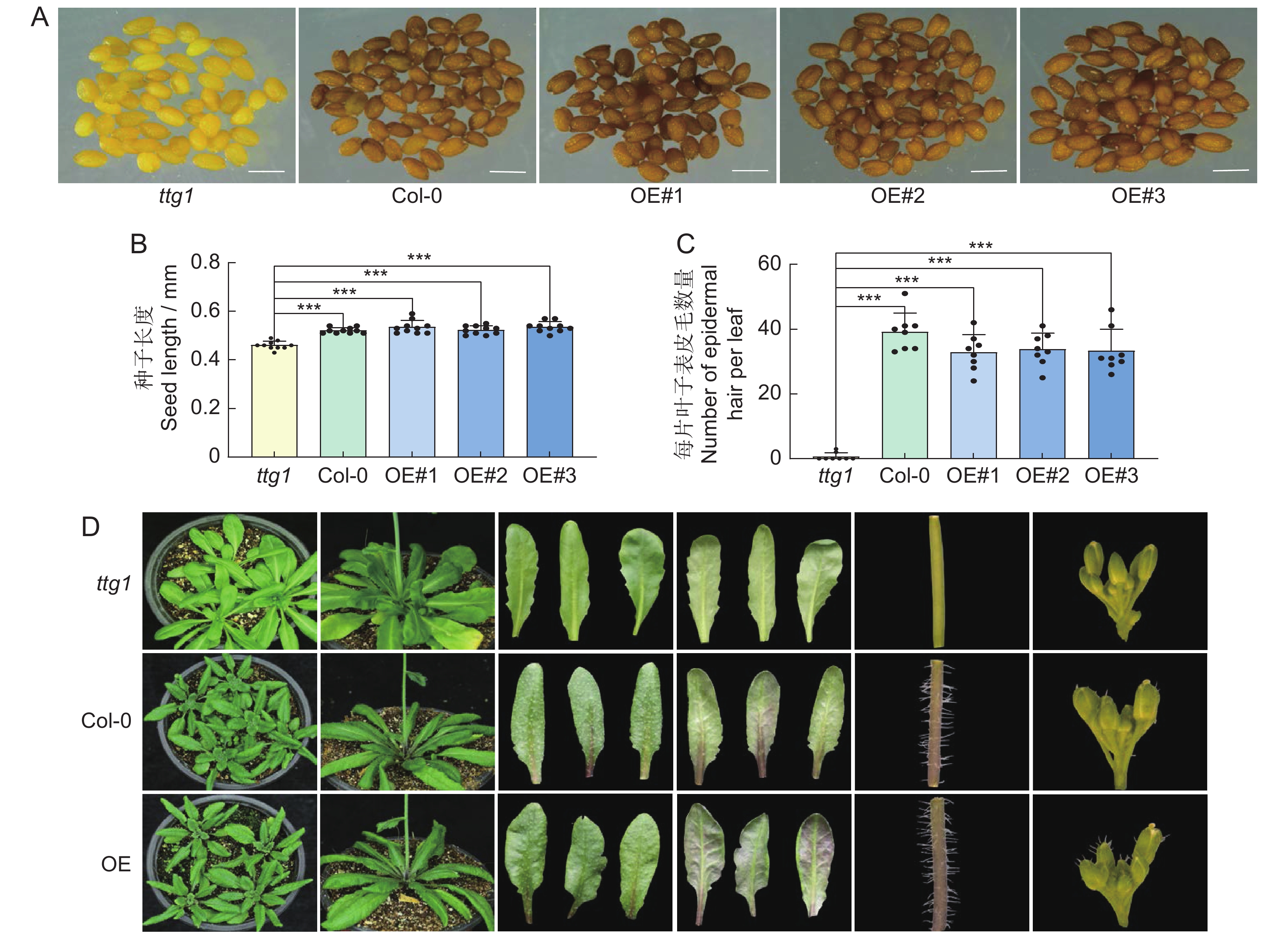
随机选取拟南芥3种基因型的成熟种子,在体式显微镜下观察种子形态。发现Col-0和OsTTG1-OE的种皮呈棕褐色,OsTTG1-OE的种皮颜色比野生型稍浅。突变体ttg1的种皮为浅黄色。取不同基因型的拟南芥种子各10粒,在体视显微镜下测量种子长度。结果显示,突变体ttg1的种子平均长度为0.46 mm,野生型为0.52 mm,OsTTG1-OE为0.53 mm,说明过表达OsTTG1后,拟南芥的种子大小受到影响(图2:A、B)。
选取苗龄10 d的拟南芥植株第1片真叶,在体视显微镜下观察表皮毛的密度,统计不同基因型拟南芥叶片上的表皮毛。结果显示,野生型拟南芥第1片真叶上表皮毛在35根左右,OsTTG1-OE在32根左右,突变体ttg1则几乎没有表皮毛(图2:C)。野生型和OsTTG1-OE植株的叶片、茎秆及花序上均有表皮毛,突变体ttg1则没有。此外,突变体ttg1几乎没有花青素的积累,过表达OsTTG1拟南芥株系则在叶片、茎等部位均有花青素的积累(图2:D)。
对不同基因型拟南芥的开花期进行观察,发现突变体ttg1的开花时间比Col-0和OsTTG1转基因株系提前3~5 d。Col-0和OsTTG1-OE的开花时间没有明显差异(图3),说明OsTTG1也能够影响拟南芥的开花时间。
2.3 RNA-seq分析结果
2.3.1 转录组测序分析
对拟南芥突变体ttg1和OsTTG1-OE株系共24个样品进行RNA-seq分析,共获得167.02 Gb 的Clean data,各样品的 Clean data均在6.01 Gb以上,Q30在93.51%以上,GC值均在46.01%以上。将各样品的Clean reads与参考基因组进行序列比对,发现匹配率在94.44%~96.47%。
2.3.2 差异表达基因统计分析
经统计,3个时期共得到
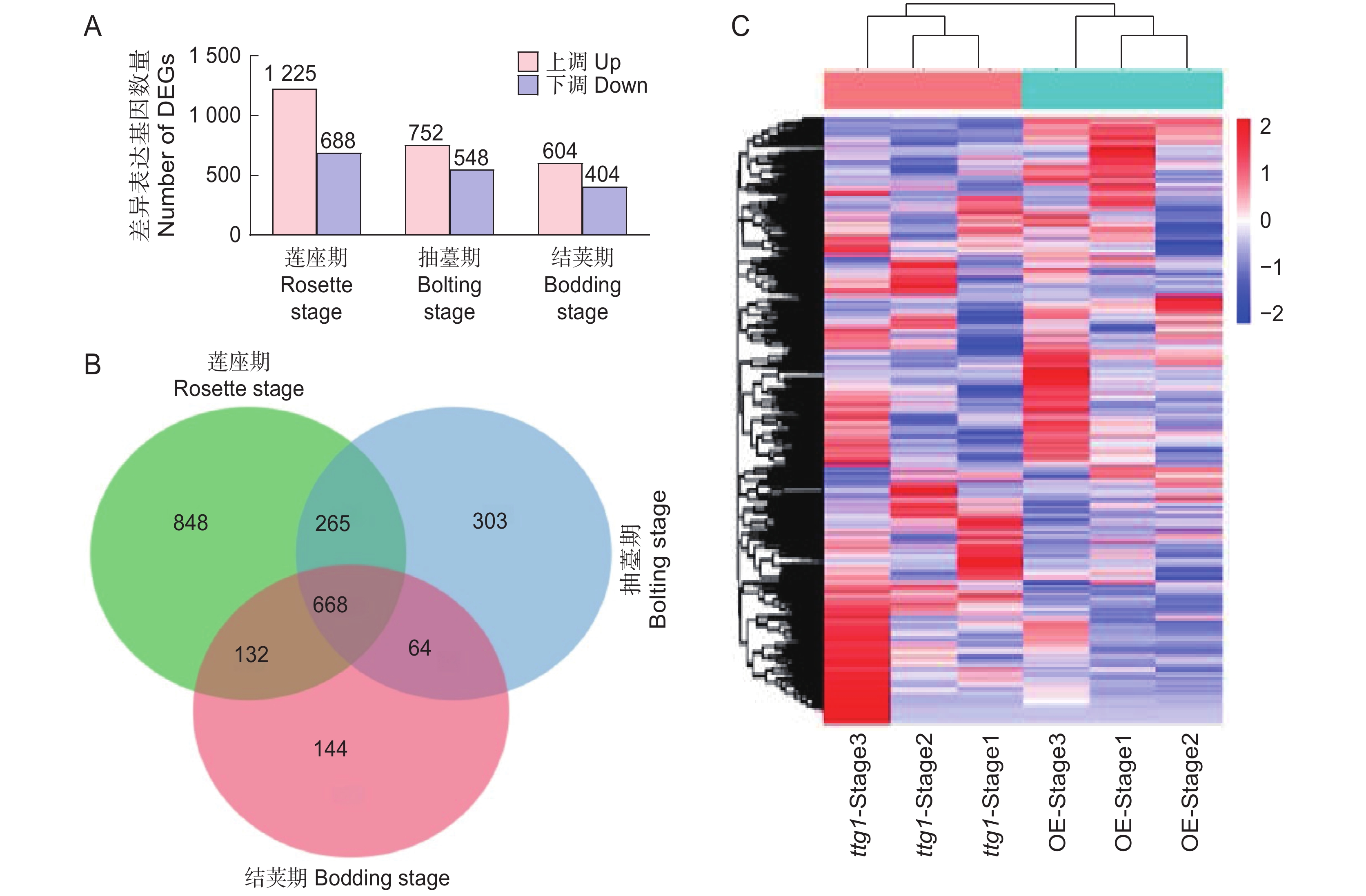
2424 个DEGs 。在莲座期突变体ttg1和OsTTG1-OE中筛选到1 913个DEGs,其中上调基因1 225个,包括可能与花青素积累有关的基因(MKK9、CYP75B1、GSTF12、DFRA、LDOX)、可能与表皮毛形成有关的基因(ETC2、SPL4、SPL3A),以及可能与调控开花有关的基因(FLC、HDA5)等;下调基因688个,包括可能与表皮毛形成有关的基因(SPL15、TCL1、ETC3)、可能与调控开花有关的基因(FT、AGL19、LHY)等。在抽薹期筛选到的DEGs为1 300个,其中上调基因752个,包括可能与花青素积累有关的基因(CYP75B1、TT8、GSTF12、F3H、CHS、DFRA、LDOX)、可能与表皮毛形成相关的基因(ETC2、SPL3A、GIS)等;下调基因548个,其中包括可能与表皮毛形成有关的基因ETC3。在结荚期筛选到差异表达基因1 008个,其中上调基因604个,包括可能与花青素积累有关的基因DFRA、LDOX,可能与表皮毛形成相关的基因ETC2、SPL3A;下调基因404个,包括可能与表皮毛形成相关的基因ETC3(图4:A)。对获得的DEGs进行分析,发现3个时期共有的DEGs为668个(图4:B)。对3个时期的DEGs进行层次聚类分析,发现多数在莲座期下调的基因,在抽薹期也下调,但在结荚期则上调;而在莲座期上调的基因,在其他两个时期则大多为下调(图4:C)。![]() 图 4 突变体ttg1与OsTTG1-OE株系3个时期的差异表达基因A:上调基因与下调基因统计;B:DEGs的韦恩图;C:DEGs的表达水平聚类热图。Stage1:莲座期;Stage2:抽薹期;Stage3:结荚期,下同。Figure 4. DEGs across three periods in Arabidopsis thaliana mutant ttg1 and OsTTG1-OEA: Statistical analysis of up-regulated and down-regulated genes; B: Venn diagram of DEGs; C: Heatmap of DEG expression levels. Stage 1: Rosette stage; Stage 2: Bolting stage; Stage 3: Bodding stage, same below.
图 4 突变体ttg1与OsTTG1-OE株系3个时期的差异表达基因A:上调基因与下调基因统计;B:DEGs的韦恩图;C:DEGs的表达水平聚类热图。Stage1:莲座期;Stage2:抽薹期;Stage3:结荚期,下同。Figure 4. DEGs across three periods in Arabidopsis thaliana mutant ttg1 and OsTTG1-OEA: Statistical analysis of up-regulated and down-regulated genes; B: Venn diagram of DEGs; C: Heatmap of DEG expression levels. Stage 1: Rosette stage; Stage 2: Bolting stage; Stage 3: Bodding stage, same below.2.3.3 差异表达基因GO(Gene ontology, GO)富集分析
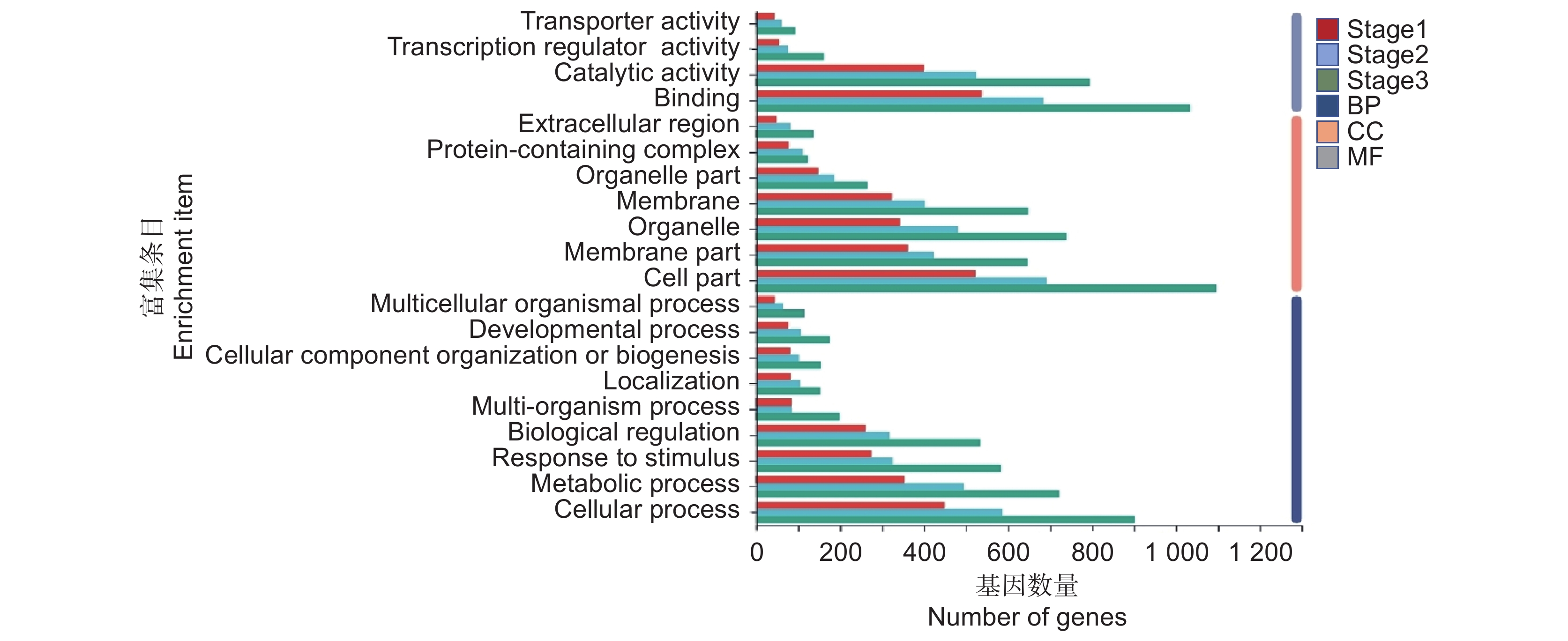
对所有DEGs进行基因本体富集分析,发现在分子功能(Molecular function,MF)相关条目中,催化活性(GO: 0003824)、转录调节剂活性(GO: 0140110)、复合蛋白(GO: 0005488)等条目有较多的DEGs富集。在细胞组分(Cellular component,CC)相关条目中,膜部分(GO: 0044425)、细胞部分(GO: 0044464)、细胞器(GO: 0043226)等条目有较多的DEGs富集。在生物进程(Biological processes,BP)相关条目中,生物调节(GO: 0065007)、代谢过程(GO: 0008152)等条目有较多DEGs富集(图5)。在3个时期中,DEGs在催化活性、转录调节剂活性、代谢过程等相关条目均有较多富集。
3. 讨论
花青素是高等植物中的次生代谢产物,在抗逆、防御病虫害、育花、育种等方面发挥着重要作用[35]。花青素是在PAL、CHS、F3H、CHI、DFR、LDOX、UFGT等多种酶的催化下,在多种转录因子的调控下合成的[36]。在拟南芥中,当WD40的TTG1和bHLH的TT8、GL3或者EGL3与R2R3-MYB相互作用时,花青素的合成被激活。TTG1参与形成的MBW复合物能够直接与DFR、F3H、TT8、TTG2和ANS等基因的启动子结合,调控基因的表达。本研究中,水稻OsTTG1可以修复拟南芥突变体ttg1无花青素积累的表型缺陷。表明OsTTG1具有影响植株花青素积累的作用。RNA-seq分析发现了4个与花青素合成有关的酶,其中DFR是花青素合成途径中的关键酶,TTG1会影响DFR的功能,诱导DFR的表达,拟南芥突变体ttg1中DFR的催化受阻,花青素合成受到影响[37]。在拟南芥突变体ttg1中过表达OsTTG1后,发现3个时期的转基因植株中DFR的表达水平均比突变体ttg1高,说明OsTTG1可能也像TTG1一样能够诱导DFR的表达,影响花青素的积累。TT8属于bHLH转录因子,其能够与TT2(MYB)、TTG1(WD40)蛋白形成稳定的三元复合物,调控花青素合成途径中后期结构基因的表达,还能够通过正负反馈调节自身的表达,进而促进花青素的合成[38]。本研究中TT8基因的表达上调,说明OsTTG1或许也能与TT8及TT2形成复合物,调控花青素的合成。
表皮毛是拟南芥的一个重要性状,而突变体ttg1的表皮毛生长发育受阻,整个植株几乎没有表皮毛。本研究中,在拟南芥突变体ttg1中过表OsTTG1,可以修复突变体ttg1无表皮毛的表型缺陷,表明OsTTG1具有影响表皮毛形成的作用。RNA-seq分析发现,在抽薹期时,转基因植株中GIS的表达量显著高于突变体植株。GIS能够正调控拟南芥表皮毛的发育[22]。这说明OsTTG1可能通过调控GIS的表达来影响拟南芥表皮毛的形成。TCL1在拟南芥表皮毛形成过程中起着负调控的作用,AtTCL1过表达拟南芥植株的表皮毛形成被抑制[33]。我们发现,在莲座期时,转基因植株中GIS的表达量显著低于突变体植株,这说明OsTTG1可能对TCL1基因的表达量有影响,进而影响了莲座期表皮毛的形成。ETC2和TCL1一样,都是影响表皮毛形成的R3-MYB型负调控因子,但本研究发现,转基因植株中ETC2在3个时期的表达均显著上调。有研究指出,MBW对表皮毛的生长发育有正向调控作用,使R3-MYB型负调控因子TRY、CPC受到激活,使得MYB正向调控因子被取代,最后形成无活性的GY/CPC-GL3/EGL3-TTG1复合物[39]。我们猜测,在OsTTG1的影响下,MBW也能激活ETC2的表达,最终形成无活性的ETC2-GL3/EGL3-TTG1复合物,因此,ETC2的上调表达并没有抑制表皮毛的形成。
开花期是决定植物分布和季节适应性的重要农艺性状之一。本研究在拟南芥突变体ttg1中过表达OsTTG1基因,发现多个开花相关的基因只在莲座期表达量有差异,而在开花期的突变体ttg1和OsTTG1-OE植株中没有差异,说明OsTTG1可能会直接影响开花期,或者像TTG1一样可以调控下游生物合成相关的基因[17]。FLC是一个开花抑制基因,该基因表达上调会促使植株形成晚花表型[40],FLC的上调表达能够使拟南芥开花延迟。FT是拟南芥中的一种成花素,在花的形成过程中起着重要的作用。FT[29]和AGL19[41]基因的过表达均会导致拟南芥提前开花。本研究发现在莲座期时,转基因植株中FLC的表达量显著高于突变体植株,而FT和AGL19的表达量则显著下调。与开花相关的基因的表达量只在莲座期有差异,说明这些基因在植株抽薹前就能发挥功能。这3个基因的表达可能均受OsTTG1的影响,进而影响OsTTG1-OE植株的开花时间。有研究表明,TTG1过表达植株比野生型开花晚[5]。然而,本研究发现OsTTG1-OE植株的开花时间与野生型并没有明显差异。同时,我们发现在转基因植株中HDA5的表达量显著高于突变体植株。前人报道认为HDA5是一个正调控开花的基因,hda5突变体比野生型晚开花[42],与我们的研究结果刚好相反。因此,我们猜测OsTTG1可能会影响HDA5的表达,进而影响植株的开花时间。
在拟南芥突变体ttg1背景下,过表达OsTTG1株系的表型得到恢复,表明OsTTG1影响花青素生物合成、表皮毛形成及开花时间等性状。此外,TTG1对植株的根毛密度[43]、根长[44]、种皮黏液质[45]等也具有一定的影响。本研究中,RNA-seq分析发现的DEGs中也包括与氮素吸收利用、耐盐、抗病等相关的基因,因此,OsTTG1是否对上述性状也有影响还需进一步研究。
-
图 4 突变体ttg1与OsTTG1-OE株系3个时期的差异表达基因
A:上调基因与下调基因统计;B:DEGs的韦恩图;C:DEGs的表达水平聚类热图。Stage1:莲座期;Stage2:抽薹期;Stage3:结荚期,下同。
Figure 4. DEGs across three periods in Arabidopsis thaliana mutant ttg1 and OsTTG1-OE
A: Statistical analysis of up-regulated and down-regulated genes; B: Venn diagram of DEGs; C: Heatmap of DEG expression levels. Stage 1: Rosette stage; Stage 2: Bolting stage; Stage 3: Bodding stage, same below.
-
[1] Airoldi CA,Hearn TJ,Brockington SF,Webb AAR,Glover BJ. TTG1 proteins regulate circadian activity as well as epidermal cell fate and pigmentation[J]. Nat Plants,2019,5(11):1145−1153. doi: 10.1038/s41477-019-0544-3
[2] Broun P. Transcriptional control of flavonoid biosynthesis:a complex network of conserved regulators involved in multiple aspects of differentiation in Arabidopsis[J]. Curr Opin Plant Biol,2005,8(3):272−279. doi: 10.1016/j.pbi.2005.03.006
[3] Tominaga-Wada R,Ishida T,Wada T. New insights into the mechanism of development of Arabidopsis root hairs and trichomes[J]. Int Rev Cell Mol Biol,2011,286:67−106.
[4] Oppenheimer DG,Herman PL,Sivakumaran S,Esch J,Marks MD. A myb gene required for leaf trichome differentiation in Arabidopsis is expressed in stipules[J]. Cell,1991,67(3):483−493. doi: 10.1016/0092-8674(91)90523-2
[5] Paffendorf BAM,Qassrawi R,Meys AM,Trimborn L,Schrader A. TRANSPARENT TESTA GLABRA 1 participates in flowering time regulation in Arabidopsis thaliana[J]. PeerJ,2020,8:e8303. doi: 10.7717/peerj.8303
[6] Wang JY,Zhang CH,Li YS. Genome-wide identification and expression profiles of 13 key structural gene families involved in the biosynthesis of rice flavonoid scaffolds[J]. Genes,2022,13(3):410. doi: 10.3390/genes13030410
[7] Yang XH,Wang JR,Xia XZ,Zhang ZQ,He J, et al. OsTTG1,a WD40 repeat gene,regulates anthocyanin biosynthesis in rice[J]. Plant J,2021,107(1):198−214.
[8] Du SL,Wang ZW,Chen Y,Tan Y,Li X,et al. Coleoptile purple line regulated by A-P gene system is a valuable marker trait for seed purity identification in hybrid rice[J]. Rice Sci,2022,29(5):451−461. doi: 10.1016/j.rsci.2022.07.005
[9] Miller R,Owens SJ,Rørslett B. Plants and colour:flowers and pollination[J]. Opt Laser Technol,2011,43(2):282−294. doi: 10.1016/j.optlastec.2008.12.018
[10] Dixon RA,Achnine L,Kota P,Liu CJ,Reddy MSS,Wang LJ. The phenylpropanoid pathway and plant defence: a genomics perspective[J]. Mol Plant Pathol,2002,3(5):371−390. doi: 10.1046/j.1364-3703.2002.00131.x
[11] Koornneef M. The complex syndrome of ttg mutanis[J]. Arabidopsis Inf Serv,1981,18:45−51.
[12] Gonzalez A,Zhao MZ,Leavitt JM,Lloyd AM. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/MYB transcriptional complex in Arabidopsis seedlings[J]. Plant J,2008,53(5):814−827. doi: 10.1111/j.1365-313X.2007.03373.x
[13] Petroni K,Tonelli C. Recent advances on the regulation of anthocyanin synthesis in reproductive organs[J]. Plant Sci,2011,181(3):219−229. doi: 10.1016/j.plantsci.2011.05.009
[14] Zhang BP,Schrader A. TRANSPARENT TESTA GLABRA 1-dependent regulation of flavonoid biosynthesis[J]. Plants (Basel),2017,6(4):65. doi: 10.3390/plants6040065
[15] Wei ZL,Cheng YL,Zhou CC,Li D,Gao X,et al. Genome-wide identification of direct targets of the TTG1-bHLH-MYB complex in regulating trichome formation and flavonoid accumulation in Arabidopsis thaliana[J]. Int J Mol Sci,2019,20(20):5014. doi: 10.3390/ijms20205014
[16] Xu WJ,Grain D,Bobet S,Le Gourrierec J,Thévenin J,et al. Complexity and robustness of the flavonoid transcriptional regulatory network revealed by comprehensive analyses of MYB-bHLH-WDR complexes and their targets in Arabidopsis seed[J]. New Phytol,2014,202(1):132−144. doi: 10.1111/nph.12620
[17] Baudry A,Heim MA,Dubreucq B,Caboche M,Weisshaar B,Lepiniec L. TT2,TT8,and TTG1 synergistically specify the expression of BANYULS and proanthocyanidin biosynthesis in Arabidopsis thaliana[J]. Plant J,2004,39(3):366−380. doi: 10.1111/j.1365-313X.2004.02138.x
[18] 柳蕾,孙健,吴殿星,舒小丽. 水稻光叶性状及表皮毛发育研究进展[J]. 核农学报,2015,29(11):2110−2116. doi: 10.11869/j.issn.100-8551.2015.11.2110 Liu L,Sun J,Wu DX,Shu XL. Advances in studying on glabrous rice and the development of trichomes[J]. Journal of Nuclear Agricultural Sciences,2015,29(11):2110−2116. doi: 10.11869/j.issn.100-8551.2015.11.2110
[19] Kirik V,Lee MM,Wester K,Herrmann U,Zheng ZG,et al. Functional diversification of MYB23 and GL1 genes in trichome morphogenesis and initiation[J]. Development,2005,132(7):1477−1485. doi: 10.1242/dev.01708
[20] Zhang F,Gonzalez A,Zhao MZ,Payne CT,Lloyd A. A network of redundant bHLH proteins functions in all TTG1-dependent pathways of Arabidopsis[J]. Development,2003,130(20):4859−4869. doi: 10.1242/dev.00681
[21] Payne CT,Zhang F,Lloyd AM. GL3 encodes a bHLH protein that regulates trichome development in Arabidopsis through interaction with GL1 and TTG1[J]. Genetics,2000,156(3):1349−1362. doi: 10.1093/genetics/156.3.1349
[22] An LJ,Zhou ZJ,Su S,Yan A,Gan YB. GLABROUS INFLORESCENCE STEMS (GIS) is required for trichome branching through gibberellic acid signaling in Arabidopsis[J]. Plant Cell Physiol,2012,53(2):457−469. doi: 10.1093/pcp/pcr192
[23] Gan YB,Liu C,Yu H,Broun P. Integration of cytokinin and gibberellin signalling by Arabidopsis transcription factors GIS,ZFP8 and GIS2 in the regulation of epidermal cell fate[J]. Development,2007,134(11):2073−2081. doi: 10.1242/dev.005017
[24] Zhou ZJ,An LJ,Sun LL,Gan YB. ZFP5 encodes a functionally equivalent GIS protein to control trichome initiation[J]. Plant Signal Behav,2012,7(1):28−30. doi: 10.4161/psb.7.1.18404
[25] 刘艳霞,王娟,兰海燕. 基因调控网络调节植物表皮毛发育的研究进展[J]. 分子植物育种,2017,15(4):1362−1370. Liu YX,Wang J,Lan HY. Advance in gene regulatory network of plant trichome development controlling[J]. Molecular Plant Breeding,2017,15(4):1362−1370.
[26] Masucci JD,Rerie WG,Foreman DR,Zhang M,Galway ME,et al. The homeobox gene GLABRA 2 is required for position-dependent cell differentiation in the root epidermis of Arabidopsis thaliana[J]. Development,1996,122(4):1253−1260. doi: 10.1242/dev.122.4.1253
[27] Ioannidi E,Rigas S,Tsitsekian D,Daras G,Alatzas A,et al. Trichome patterning control involves TTG1 interaction with SPL transcription factors[J]. Plant Mol Biol,2016,92(6):675−687. doi: 10.1007/s11103-016-0538-8
[28] Helliwell CA,Wood CC,Robertson M,James Peacock W,Dennis ES. The Arabidopsis FLC protein interacts directly in vivo with SOC1 and FT chromatin and is part of a high-molecular-weight protein complex[J]. Plant J,2006,46(2):183−192. doi: 10.1111/j.1365-313X.2006.02686.x
[29] Zheng R,Meng XB,Hu QL,Yang B,Cui GC,et al. OsFTL12,a member of FT-like family,modulates the heading date and plant architecture by florigen repression complex in rice[J]. Plant Biotechnol J,2023,21(7):1343−1360. doi: 10.1111/pbi.14020
[30] Western TL,Young DS,Dean GH,Tan WL,Samuels AL,Haughn GW. MUCILAGE-MODIFIED4 encodes a putative pectin biosynthetic enzyme developmentally regulated by APETALA2,TRANSPARENT TESTA GLABRA1,and GLABRA2 in the Arabidopsis seed coat[J]. Plant Physiol,2004,134(1):296−306. doi: 10.1104/pp.103.035519
[31] Shi L,Katavic V,Yu YY,Kunst L,Haughn G. Arabidopsis glabra2 mutant seeds deficient in mucilage biosynthesis produce more oil[J]. Plant J,2012,69(1):37−46. doi: 10.1111/j.1365-313X.2011.04768.x
[32] Qiu YP,Tao R,Feng Y,Xiao ZN,Zhang D,et al. EIN3 and RSL4 interfere with an MYB-bHLH-WD40 complex to mediate ethylene-induced ectopic root hair formation in Arabidopsis[J]. Proc Natl Acad Sci USA,2021,118(51):e2110004118. doi: 10.1073/pnas.2110004118
[33] Tian HN,Wang XL,Guo HY,Cheng YX,Hou CJ,et al. NTL8 regulates trichome formation in Arabidopsis by directly activating R3 MYB genes TRY and TCL1[J]. Plant Physiol,2017,174(4):2363−2375. doi: 10.1104/pp.17.00510
[34] Zhang XR,Henriques R,Lin SS,Niu QW,Chua NH. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method[J]. Nat Protoc,2006,1(2):641−646. doi: 10.1038/nprot.2006.97
[35] Koes R,Verweij W,Quattrocchio F. Flavonoids:a colorful model for the regulation and evolution of biochemical pathways[J]. Trends Plant Sci,2005,10(5):236−242. doi: 10.1016/j.tplants.2005.03.002
[36] 贾赵东,马佩勇,边小峰,杨清,郭小丁,谢一芝. 植物花青素合成代谢途径及其分子调控[J]. 西北植物学报,2014,34(7):1496−1506. doi: 10.7606/j.issn.1000-4025.2014.07.1496 Jia ZD,Ma PY,Bian XF,Yang Q,Guo XD,Xie YZ. Biosynthesis metabolic pathway and molecular regulation of plants anthocyanin[J]. Acta Botanica Boreali-Occidentalia Sinica,2014,34(7):1496−1506. doi: 10.7606/j.issn.1000-4025.2014.07.1496
[37] 马旭. miR159-MYB65-DFR参与番茄花青素合成调控分析[D]. 哈尔滨:东北林业大学,2023:12−15. [38] Baudry A,Caboche M,Lepiniec L. TT8 controls its own expression in a feedback regulation involving TTG1 and homologous MYB and bHLH factors,allowing a strong and cell-specific accumulation of flavonoids in Arabidopsis thaliana[J]. Plant J,2006,46(5):768−779. doi: 10.1111/j.1365-313X.2006.02733.x
[39] 曹敏,张璐,高新梅,张艮邦,李文强,郭万里. 植物表皮毛发育分子调控机制的研究进展[J]. 安徽农业科学,2013,41(10):4231−4235. doi: 10.3969/j.issn.0517-6611.2013.10.001 Cao M,Zhang L,Gao XM,Zhang GB,Li WQ,Guo WL. Research progress of molecular regulation mechanism in the development of plant trichomes[J]. Journal of Anhui Agricultural Sciences,2013,41(10):4231−4235. doi: 10.3969/j.issn.0517-6611.2013.10.001
[40] Takahashi Y,Teshima KM,Yokoi S,Innan H,Shimamoto K. Variations in Hd1 Proteins,Hd3a promoters,and Ehd1 expression levels contribute to diversity of flowering time in cultivated rice[J]. Proc Natl Acad Sci USA,2009,106(11):4555−4560. doi: 10.1073/pnas.0812092106
[41] Krogan NT,Hogan K,Long JA. APETALA2 negatively regulates multiple floral organ identity genes in Arabidopsis by recruiting the co-repressor TOPLESS and the histone deacetylase HDA19[J]. Development,2012,139(22):4180−4190. doi: 10.1242/dev.085407
[42] Luo M,Tai R,Yu CW,Yang SG,Chen CY,et al. Regulation of flowering time by the histone deacetylase HDA5 in Arabidopsis[J]. Plant J,2015,82(6):925−936. doi: 10.1111/tpj.12868
[43] Grierson C,Nielsen E,Ketelaarc T,Schiefelbein J. Root hairs[J]. Arabidopsis Book,2014(12):e0172.
[44] 周卫丰,史春阳,葛永胜,丁艳,胡训霞,等. 水稻耐低磷根系形态重塑基因挖掘及功能分析[J]. 扬州大学学报(农业与生命科学版),2022,43(3):1−11. Zhou WF,Shi CY,Ge YS,Ding Y,Hu XX,et al. Gene mining and functional analysis of root morphological remodeling tolerant to low phosphorus in rice[J]. Journal of Yangzhou University (Agricultural and Life Science Edition),2022,43(3):1−11.
[45] 曹婧,徐栋生,黄代红,袁军文,赵娟,等. 抱茎独行菜种皮粘液质相关基因TTG1的克隆、表达分析及功能鉴定[J]. 植物科学学报,2014,32(4):371−382. Cao J,Xu DS,Huang DH,Yuan JW,Zhao J,et al. Cloning,characterization,and functional analysis of seed coat mucilage-related gene TTG1 from Lepidium perfoliatum[J]. Plant Science Journal,2014,32(4):371−382.



 下载:
下载: