Identification of MYB gene family and functional analysis of ElMYB114 in lipid synthesis of Euphorbia lathyris L.
-
摘要:
MYB转录因子广泛参与植物的代谢和种子发育等生命过程。为探究其在续随子(Euphorbia lathyris L.)油脂合成及积累过程中的调控作用,本研究对续随子MYB转录因子进行了全基因组鉴定,分析了其基因结构、编码蛋白理化性质、启动子顺式元件以及时空表达谱,并克隆了ElMYB114基因的编码序列,将其转入烟草(Nicotiana tabacum L.),进一步鉴定该基因的生物学功能。结果显示:(1)全基因组鉴定获得199个续随子MYB基因,命名为ElMYB1~ElMYB199,编码蛋白均具有SANT结构域;(2)ElMYB114编码的蛋白定位于细胞核;(3)荧光定量qRT-PCR分析结果表明,ElMYB114基因在种子发育后期的表达量最高;(4)与转空载对照相比,异源表达ElMYB114基因的烟草株系,其叶片总油脂含量分别提高了3.7%和4.2%,种子总脂含量分别提高了11.0%和10.7%,表明过表达ElMYB114基因可提高植物组织的总油脂积累。研究为深入解析MYB介导的续随子油脂生物合成调控网络奠定了基础。
Abstract:MYB transcription factors play pivotal roles in plant metabolism and seed development. This study conducted a comprehensive investigation into the regulatory functions of these transcription factors in lipid synthesis and accumulation in Euphorbia lathyris L.. The analysis included genome-wide identification of MYB transcription factors, characterization of gene structures, physicochemical properties of encoded proteins, distribution of promoter cis-acting elements, and spatiotemporal expression patterns. The ElMYB114 coding sequence was cloned and genetically transformed into tobacco (Nicotiana tabacum L.) to characterize its biological function. Genome-wide identification revealed 199 MYB genes in E. lathyris, designated ElMYB1 to ElMYB199, all encoding proteins with SANT domains. The protein encoded by ElMYB114 was localized to the nucleus. Quantitative fluorescence qRT-PCR analysis showed that ElMYB114 expression peaked during the late stage of seed development. Overexpression of ElMYB114 in transgenic tobacco lines led to a 3.7% and 4.2% increase in total oil content in leaves and an 11.0% and 10.7% increase in total lipid content in seeds compared to the empty vector control. These findings suggest that ElMYB114 enhances carbon flux within the heterologous host toward lipid synthesis pathways, thereby promoting lipid accumulation in plant tissues. This study provides foundational insights into the MYB-mediated regulatory networks governing oil biosynthesis in E. lathyris.
-
续随子(Euphorbia lathyris L.)种子中油分含量为45%左右,包括油酸(C18∶1)、棕榈酸(C16∶0)、亚油酸(C18∶2)、α-亚麻酸(C18∶3)等,其中油酸的含量高达83%左右[1]。李昌珠等[2]研究发现,可将理想柴油替代品的分子式表示为C19H36O2。续随子种子油的脂肪酸成分以C16和C18为主,与理想柴油替代品的分子组成相似,是生产生物柴油的理想原料。生物柴油作为一种新型可再生的绿色能源,可用于取代一般石化基柴油[3]。
近年来,植物油脂合成过程中的许多酶和基因已被鉴定,而调控油脂代谢的转录因子报道较少。在植物转录因子家族中,参与油脂代谢调控的主要有AP2、B3、NF-Y、Dof、MYB、MYC类基因家族。作为植物中最大的转录因子家族之一,MYB转录因子在种子油脂合成过程中发挥重要作用[4, 5]。如,AtMYB96通过激活拟南芥(Arabidopsis thaliana (L.) Heynh.)种子中DGAT1和PDAT1的表达来调节三酰甘油的积累[6],AtMYB76显著促进拟南芥种子和叶片中脂肪族芥子油苷的形成[7],而MYB123通过抑制油脂合成通路上多个基因的表达来抑制种子油脂的积累[8, 9]。Luo等[10]在乌拉尔图小麦(Triticum urartu Tum.)中发现了R2R3-MYB家族中的TuODORANT1基因,将其在普通小麦(T. aestivum L.)中过表达,能使成熟籽粒的总SSP(种子贮藏蛋白)水平下降。拟南芥AtMYB96被认为是调控脂肪酸链延伸的关键因子,通过结合AtFAE1基因的特定启动子而促进长链脂肪酸的合成[11]。拟南芥AtMYB5基因功能缺失突变体myb5-1的种子脂肪酸含量显著高于野生型[12]。
上述研究表明,MYB转录因子的表达与植物油脂合成等生物学过程密切相关,但目前关于续随子MYB转录因子的鉴定及功能分析鲜有报道。本研究通过对续随子MYB转录因子家族进行全基因组鉴定、生物信息学及表达特性分析,并通过烟草(Nicotiana tabacum L.)遗传转化,分析MYB转录因子在续随子油脂合成过程中的调控功能,以期为借助基因手段提高续随子油脂品质及产量提供理论基础。
1. 材料与方法
1.1 实验材料
供试材料续随子来源于山西农业大学林学院产学研实训基地,分别采集根、茎、叶样品。花取自续随子盛花期,种子取自3个不同发育时期(S1:花后15 d,S2:花后30 d,S3:花后45 d),样品采集后立即置于液氮速冻,然后存于−80 ℃冰箱,用于提取总RNA。
本研究所用大肠杆菌DH5α感受态、根癌农杆菌GV-3101、植物过表达载体pCAMBIA1303和pCAMBIA1300均来源于山西农业大学农学院李润植实验室。引物合成及DNA测序均由北京擎科生物科技有限公司完成。
1.2 研究方法
1.2.1 续随子MYB基因家族鉴定及生物信息学分析
为获得续随子MYB基因信息,首先在pfam数据库下载MYB基因家族结构域的隐马尔科夫模型文件,使用hmmer软件对续随子蛋白数据库进行比对搜索。同时,利用AtMYB蛋白序列作为检索序列,以续随子基因组数据为基础,进行BLAST比对。对两种方法获得的结果进行筛选,通过NCBI-CDD分析ElMYB蛋白的保守结构域,剔除无SANT结构域的蛋白序列。根据文献[13]报道的方法对MYB转录因子进行分类;在ExPasy网站(https://web.expasy.org/protparam/)中分析预测基因编码蛋白的分子量、等电点、氨基酸数目等理化性质;利用TBtools预测基因在染色体上的位置,并进行启动子分析;利用WoLF PSORT(https://wolfpsort.hgc.jp/)在线工具预测蛋白的亚细胞定位。
1.2.2 qRT-PCR分析
根据续随子种子油脂含量的变化趋势,从转录组数据(未发表)筛选出发育种子中表达呈上升趋势的基因,获得6个MYB转录因子。从续随子基因组数据(未发表)中获取MYB基因的CDS序列,根据其在染色体上的分布位置分别命名为ElMYB33、ElMYB63、ElMYB100、ElMYB111、ElMYB114和ElMYB188。使用NCBI网站设计qRT-PCR引物、内参基因ElActin[14]引物和定量引物(表1)。按照Trizol(杭州新景生物公司)试剂盒说明书提取续随子不同组织(根、茎、叶、花、S1、S2、S3时期种子)的总RNA,反转录成cDNA,保存于−20 ℃冰箱,用于后续的qRT-PCR分析和基因克隆。用染料法荧光定量预混试剂盒(AQ601,TransGen Biotech,中国)进行qRT-PCR检测,反应体系为10 μL,包含:模板0.5 μL,2 × PerfectStart ®Green qPCR SuperMix 5 μL,正反向引物(10 μmol/L)各0.2 μL,Nuclease-free Water 4.1 μL。反应程序为:94 ℃ 30 s;再94 ℃ 5 s,58 ℃ 15 s,72 ℃ 10 s,共40个循环。每个样品3次生物学重复,采用2−∆∆Ct法计算基因的相对表达水平。差异显著性分析采用SPSS 26软件,用邓肯检验分析组间差异性。
表 1 引物信息Table 1. Primer information引物名称
Primer name引物序列(5'→3')
Primer sequence (5'→3')用途
ApplicationElAction-F ATGTATGTCGCCATTCAAGCCGTTC 内参 ElAction-R TCATCAGAGCATCAGTAAGGTCACG ElMYB33-F TGCATGCTAGATGGGGGAAC 实时荧光定量PCR ElMYB33-R TGTCGCAGTTTTCGGGTACT ElMYB63-F ATTCGAGTTCCAGCGCTACG ElMYB63-R GATCCATCCGAGTTCGCACA ElMYB100-F CACCGCAAGGACCGATAACT ElMYB100-R ATATGCCGATACCAGGGGGT ElMYB111-F GGACGAGATGTCGCAATGGA ElMYB111-R TAACACGTGGCTTTGGACGA ElMYB114-F TCGAGGAATGTGGTGGTGAC ElMYB114-R AGGGTTGCTCTCCACACTTG ElMYB188-F AACGTTACTCCTCAAGCCCG ElMYB188-R CTGAGGAGGCAATTGAGCCA ElMYB114-1303-F ATGACCGCTTGCTGGACTCG 基因克隆 ElMYB114-1303-R TCACATTGGGGGGAAGTTATAGTT ElMYB114-1300-F ATGACCGCTTGCTGGACTCG ElMYB114-1300-R CATTGGGGGGAAGTTATAGTTTTG 1.2.3 续随子ElMYB114基因表达载体的构建
根据续随子基因组数据,得到ElMYB114的完整CDS序列,以KpnⅠ和XbaⅠ为酶切位点,通过Primer Primer 5.0软件设计引物ElMYB114-1303-F和ElMYB114-1303-R(表1),用高保真酶扩增目的基因,将其连接到pCAMBIA1303载体上,转化DH5α大肠杆菌感受态后,在含卡那霉素的LB固体培养基上进行筛选,过夜培养后,挑取若干个单克隆摇菌12 h,以菌液为模板进行PCR鉴定,阳性单菌落提取质粒,并通过双酶切进行验证。
1.2.4 续随子ElMYB114的亚细胞定位
通过亚克隆构建pCAMBIA1300-ElMYB114植物表达载体,设计含有KpnⅠ和XbaⅠ酶切位点的引物(表1)。将重组质粒35S::ElMYB114-GFP转入农杆菌中,将含有重组表达载体的侵染液注射到6周龄的本氏烟草(N. benthamiana Domin)健康叶片中,注射后标记位置,暗培养48 h,培养条件为温度25 ℃、空气湿度70%。暗培养后的烟草,用打孔器选择标记部位且长势良好、无破损的叶片,用DAPI试剂处理。在激光共聚焦显微镜下,观察荧光信号的位置。
1.2.5 烟草遗传转化及表达分析
将构建的pCAMBIA1303-ElMYB114质粒转入根癌农杆菌GV3101感受态细胞,挑取单克隆,用引物ElMYB114-1303-F和ElMYB114-1303-R进行PCR鉴定,检测是否为阳性,具体步骤参考高慧玲[15]的方法。通过叶盘法获得转基因烟草植株后,提取叶片DNA和RNA,进行PCR验证,进一步筛选出阳性植株。
分别提取烟草野生型和转基因阳性植株叶片的RNA,反转录成cDNA,以Actin为内参基因,其他步骤同1.2.2,检测ElMYB114基因在烟草中的表达水平。
1.2.6 烟草叶片和种子总油脂的提取和测定
采用氯仿-甲醇法,提取转ElMYB114基因烟草植株叶片和种子中的总油脂,具体步骤参考罗涛等[16]的方法。
2. 结果与分析
2.1 续随子ElMYB家族鉴定
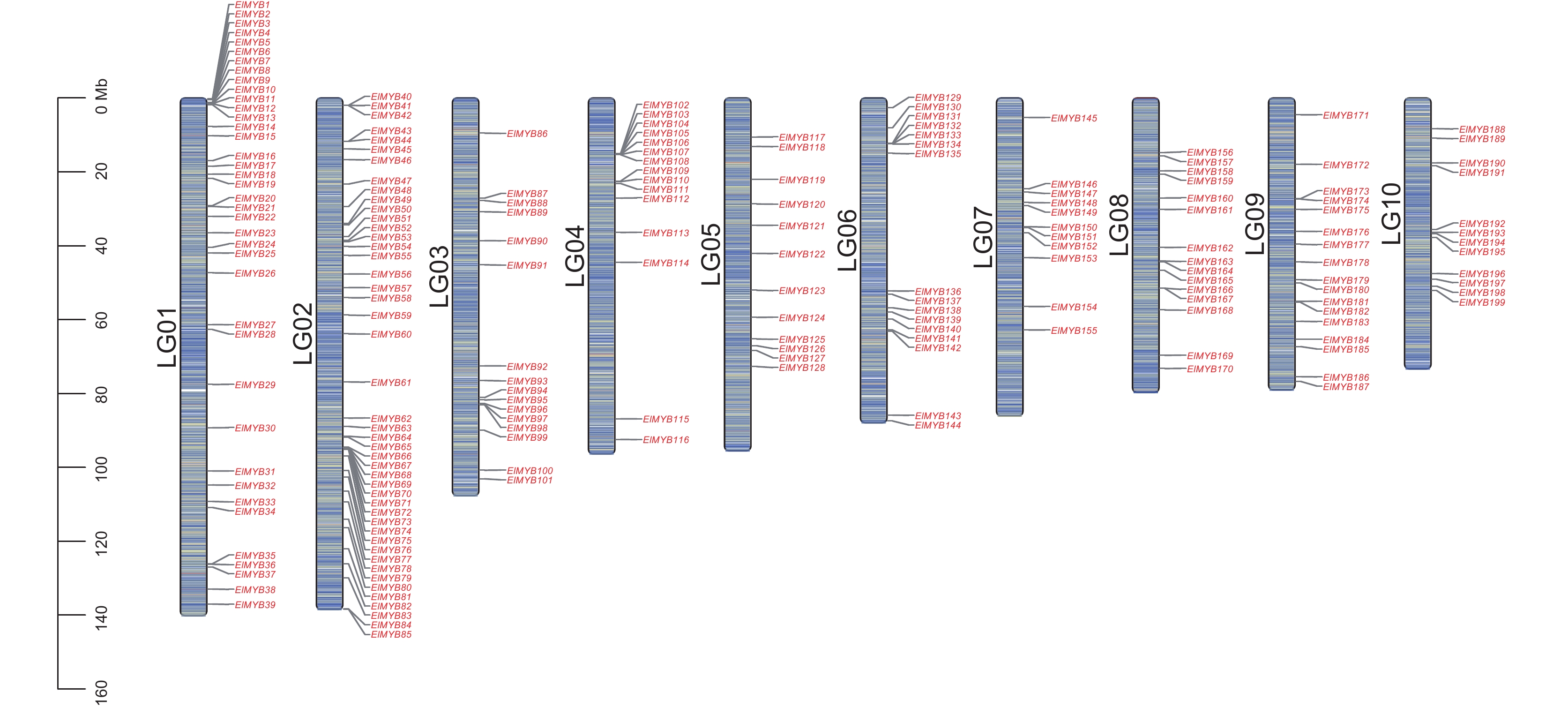
经筛选,本研究从续随子中共鉴定出199个ElMYB蛋白编码基因。分析续随子ElMYB家族各成员的染色体定位信息,发现这些基因不均匀地分布于1~10号染色体上(图1)。其中,2号染色体上分布数量最多,为45个,1号染色体上分布有39个,其他8条染色体上各有10~16个。根据基因在染色体上的位置,将其分别命名为ElMYB1~ElMYB199。
2.2 ElMYB家族的分类及理化性质分析
根据拟南芥MYB转录因子的分类依据和MYB结构域的数目,本研究将续随子MYB转录因子分为4种类型:MYB-related、R2R3-MYB、3R-MYB、4R-MYB。理化性质分析结果表明(表2),续随子199个ElMYB家族蛋白的相对分子质量在8.229~219.856 kD,氨基酸数目在71~2 026 aa,等电点在4.25~9.98。其中,116个为酸性蛋白,83个为碱性蛋白。稳定蛋白有8个(不稳定指数II<40),其余均为不稳定蛋白(II>40)。平均疏水指数均小于0,为亲水性蛋白。MYB-related类型的蛋白相对分子质量、氨基酸数目、不稳定指数、亲水性系数最大。亚细胞定位预测结果表明,续随子MYB蛋白均位于细胞核。
表 2 续随子ElMYB家族蛋白的基本理化性质Table 2. Basic information of ElMYB family proteins蛋白类型
Protein type数量
Quantity分子量
Molecular
weight / kD氨基酸数
Number of amino acids等电点
Theoretical pI不稳定指数
Instability index / (II)亲水性系数
GRAVY亚细胞定位
Subcellular
localizationMYB-related 78 8.23~219.86 72~2 026 4.25~9.93 32.06~89.20 −1.316~−0.137 细胞核 R2R3-MYB 115 12.34~177.75 105~1 619 4.62~9.98 35.43~81.68 −1.220~−0.319 细胞核 3R-MYB 5 39.08~119.47 330~1 081 5.26~9.00 43.07~60.47 −0.642~−1.220 细胞核 4R-MYB 1 118.07 1 043 6.94 55.65 −0.828 细胞核 合计 199 8.23~219.86 72~2 026 4.25~9.98 32.06~89.20 −1.316~−0.137 细胞核 2.3 启动子顺式作用元件分析
对ElMYB家族基因上游2 000 bp的启动子序列进行顺式作用元件在线分析,预测基因的潜在功能,结果见表3。续随子ElMYB基因启动子包含的功能元件有基本元件CAAT-box和TATA-box,厌氧诱导必需元件443个,光响应元件2 090个,低温响应元件140个,胁迫相关响应元件464个,激素应答元件963个,应激元件91个,同时还有许多MYB结合位点、MBS(与干旱诱导有关的MYB结合位点)和MYC结合位点。此外,还有许多功能未知的顺式作用元件。
表 3 续随子ElMYB基因上游启动子顺式作用元件Table 3. Cis-acting elements in the upstream promoter of ElMYB genes of Euphorbia lathyris顺式作用元件
Cis-acting element核心序列
Core sequence功能
FunctionWRE3 CCACCT 损伤诱导元件 LTR CCGAAA 低温响应元件 MYB CAACAG MYB结合位点 Myc TCTCTTA MYC结合位点 MRE AACCTAA 与光反应有关的MYB结合位点 WUN-motif TTATTACAT 创伤反应元件 STRE AGGGG 热休克、营养饥饿和低pH诱导响应元件 GATA-motif GATAGGA 光响应元件 CAAT-box CAAT 启动子和增强子区域的共同顺式作用元件 TC-rich repeats GTTTTCTTAC 参与防御和应激反应的顺式作用元件 GT1-motif GGTTAA 光响应元件 Box 4 ATTAAT 参与光反应的保守DNA模块的一部分 MYB-like sequence TAACCA MYB结合位点 ABRE ACGTG 脱落酸响应元件 ABRE3a TACGTG 脱落酸响应元件 AAGAA-motif GAAAGAA 脱落酸响应元件 ABRE4 CACGTA 脱落酸响应元件 TATA-box TATAAATA 启动子基本元件 P-box CCTTTTG 赤霉素响应元件 Myb-binding site CAACAG MYB结合位点 ARE AAACCA 厌氧响应元件 G-box TACGTG 光响应相关的顺式作用元件 TCA-element CCATCTTTTT 水杨酸反应涉及的顺式作用元件 3-AF3 bind site CACTATCTAAC 光应答 A-box CCGTCC α-淀粉酶启动子保守序列 ABRE2 CCACGTGG 脱落酸响应元件 AT1-motif AATTATTTTTTATT 光应答 AE-box AGAAACTT 光响应模块 ATCT-motif AATCTAATCC 部分光反应元件 as-1 TGACG 压力响应元件 CAT-box GCCACT 与分生组织表达相关的顺式作用元件 TCA TCATCTTCAT 水杨酸响应元件 TGA-box TGACGTAA 部分生长素响应元件 MBS CAACTG 与干旱诱导有关的MYB结合位点 2.4 ElMYB蛋白的基序分析
利用MEME软件对续随子ElMYB家族蛋白的保守结构域进行分析,共鉴定出10个保守基序(附图1
1 ))。每个MYB转录因子家族成员均具有1个MYB家族典型的保守基序Motif 1,具有两个MYB结构域的R2R3-MYB转录因子几乎都包含Motif 1~Motif 3;大部分MYB-related类蛋白包含Motif 1和Motif 3;3R-MYB和4R-MYB均含有Motif 1~Motif 3、Motif 5和Motif 9,但在4R-MYB转录因子中Motif 9重复出现,每个Motif在不同基因上的相对位置是一致的。2.5 ElMYB基因的组织特异性表达
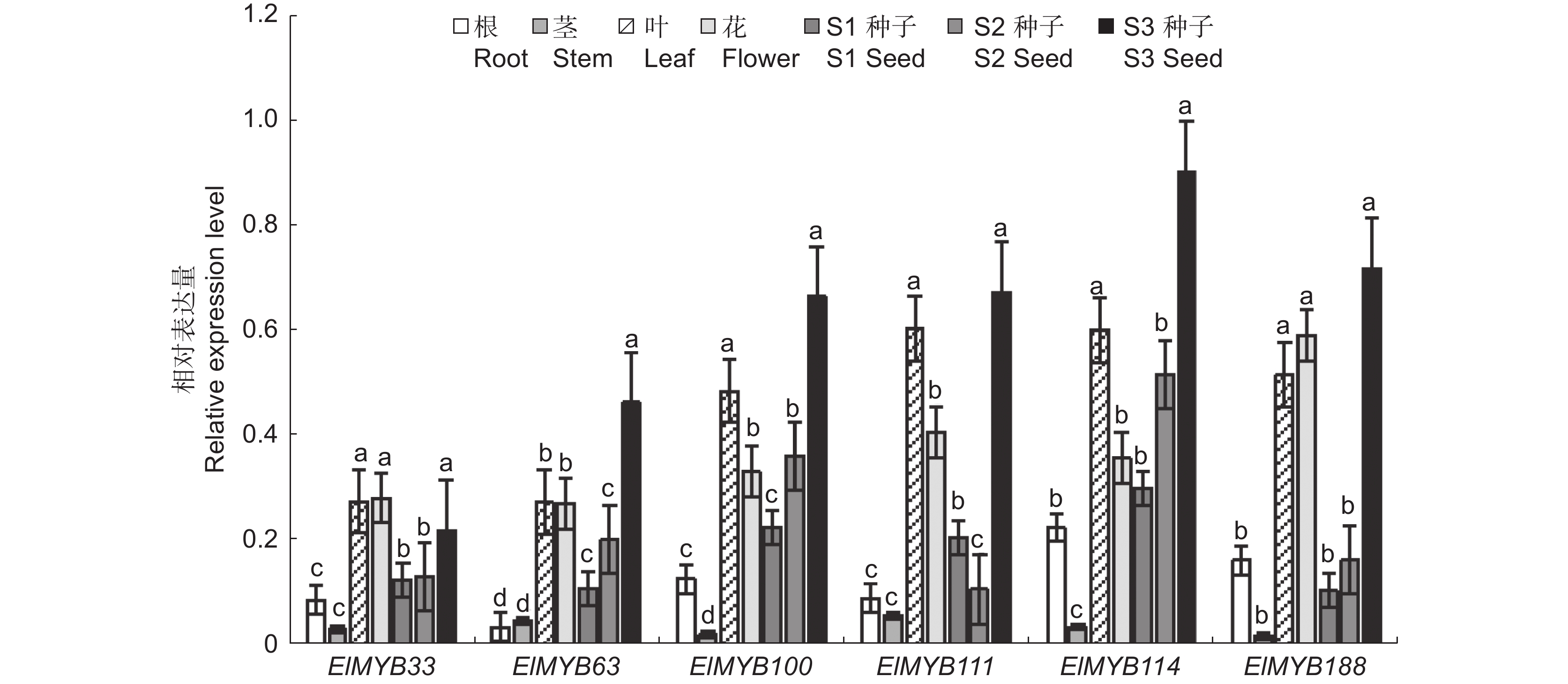
根据转录组数据,选取种子发育时期表达量呈上升趋势的6个基因,通过qRT-PCR检测其在根、茎、叶、花、S1、S2、S3时期种子中的表达量。结果发现,ElMYB33和ElMYB63在不同组织及种子不同发育时期的表达量都较低,ElMYB111、ElMYB100、ElMYB114和ElMYB188在花和叶中的表达量较高,ElMYB114基因在S3时期种子中的表达量最高,除了ElMYB111基因的表达量在种子发育时期呈先降后升趋势外,其余5个基因的表达量均呈上升趋势(图2),与转录组数据基本一致。因此,本研究选择在种子发育后期表达量最高的ElMYB114基因进行后续实验。
2.6 续随子ElMYB114基因克隆和烟草遗传转化
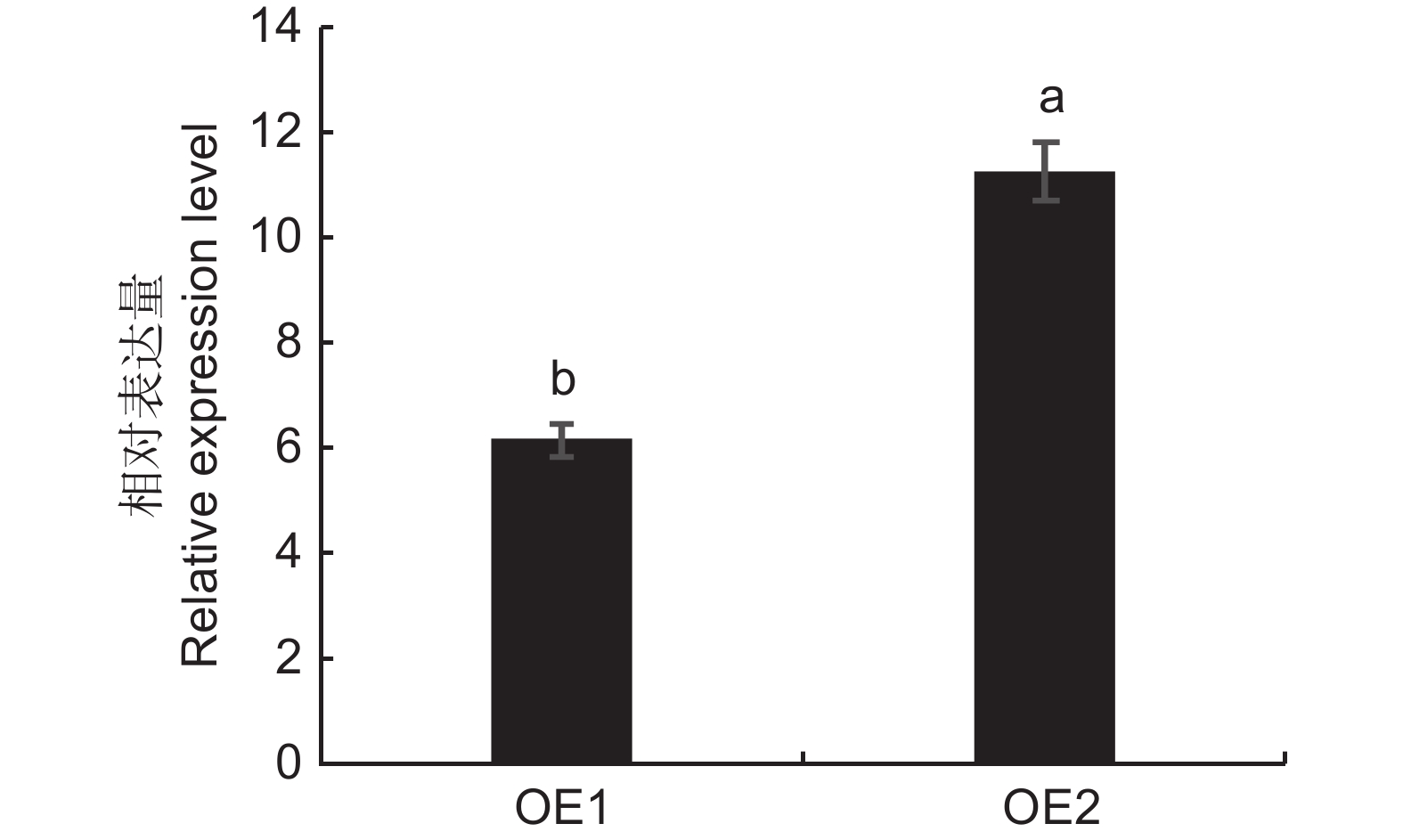
ElMYB114基因在续随子种子油脂储藏期的表达量最高。本研究以续随子种子发育时期的cDNA混样为模板,使用高保真酶扩增该基因,构建了植物表达载体pCAMBIA1303-ElMYB114,转化根癌农杆菌GV3101感受态细胞后,通过叶盘法将其转入烟草,筛选阳性转基因植株,炼苗后移土培养。利用荧光定量qRT-PCR,检测ElMYB114基因在两株转基因烟草叶片中的表达量,发现其在OE2株系中的表达量最高(图3)。
2.7 ElMYB114的亚细胞定位分析
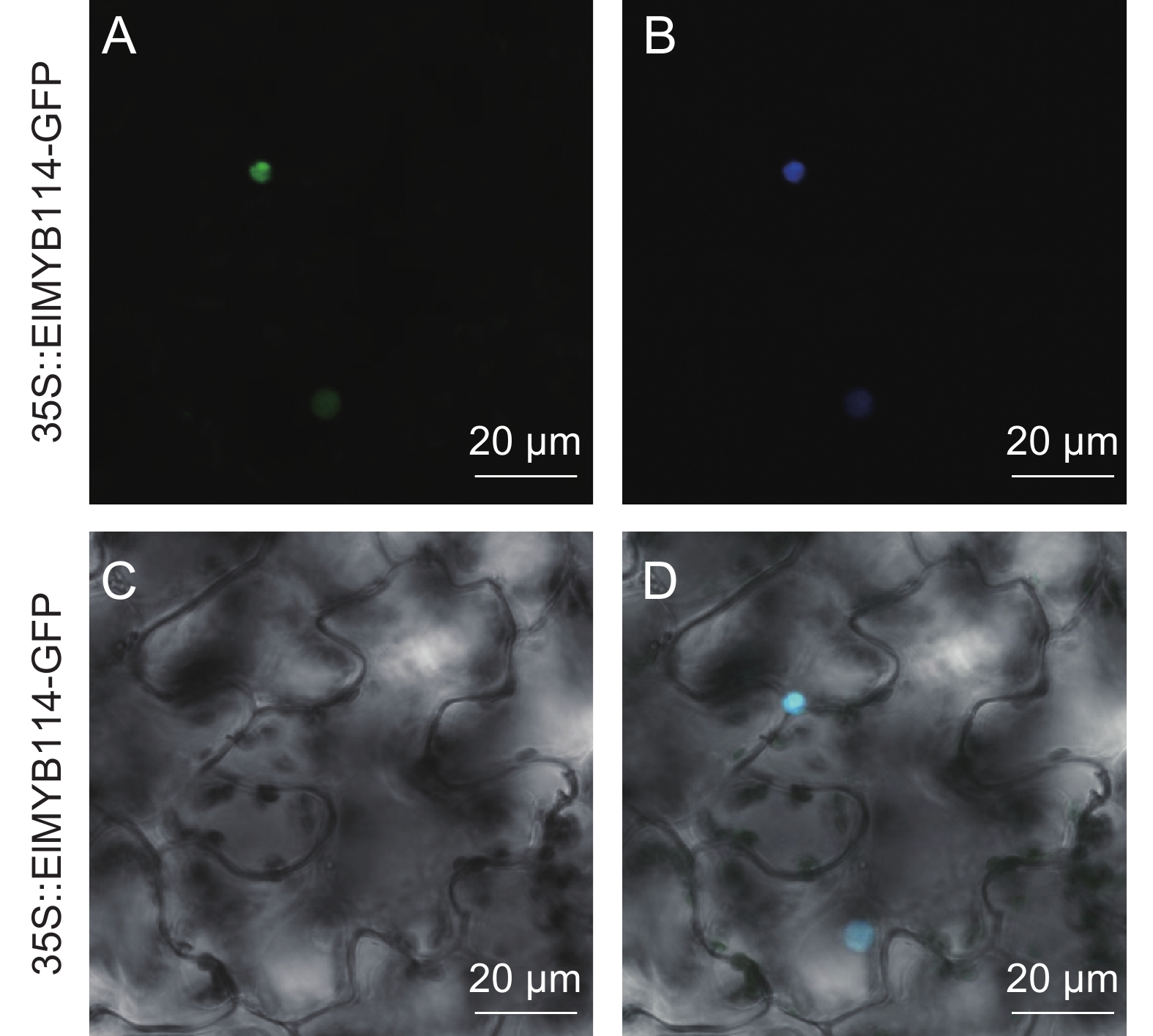
将携带pCAMBIA1300-ElMYB114重组质粒的农杆菌液注入健康的烟草叶片中,暗培养48 h后,用DAPI对侵染部位进行染色处理,在激光共聚焦显微镜下观察荧光信号的位置,发现ElMYB114蛋白在细胞核中表达(图4),与预测的亚细胞定位结果相一致。
2.8 过表达ElMYB114基因促进烟草叶片和种子总油脂的积累
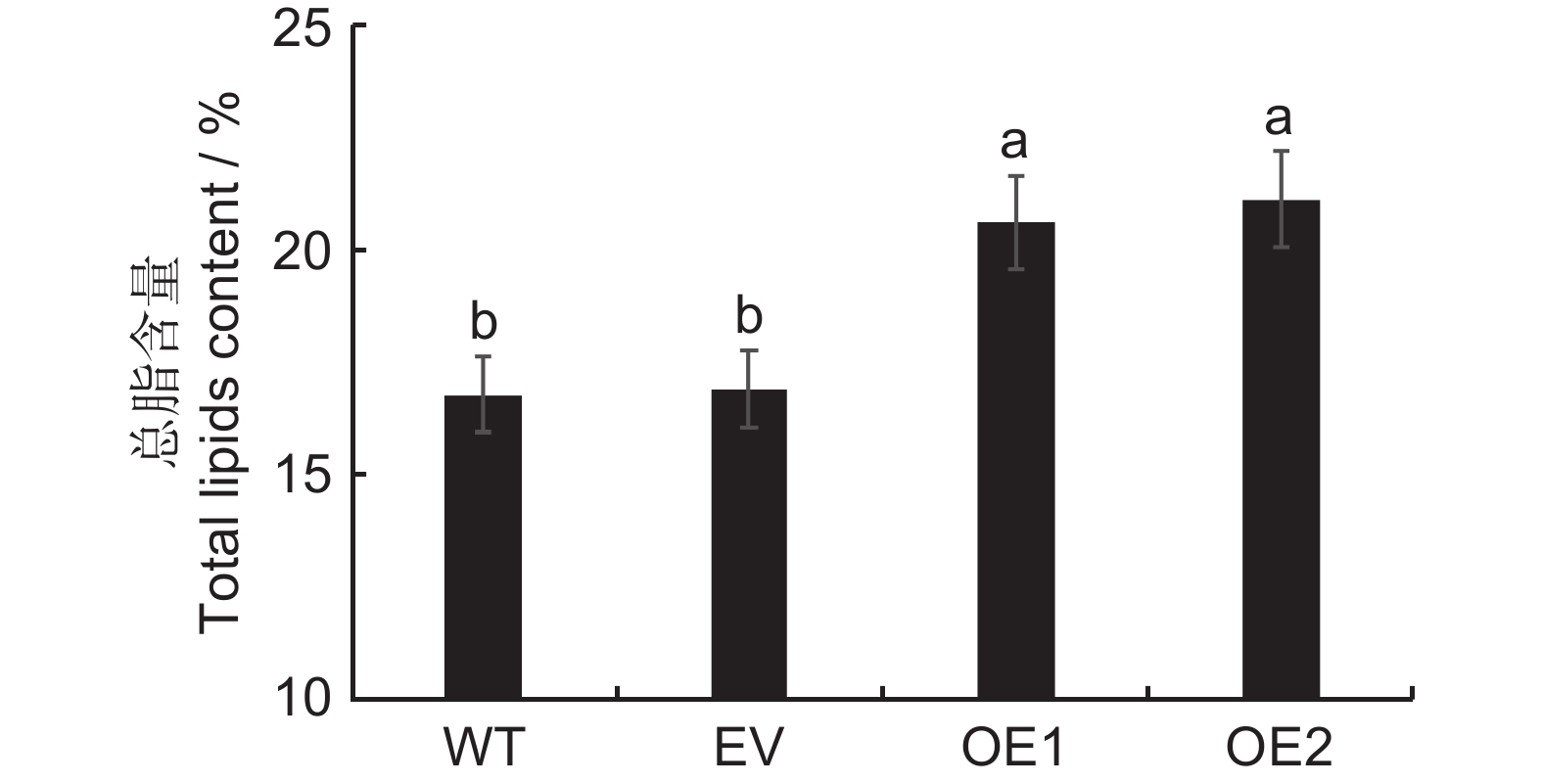
检测烟草野生型和两个转基因株系OE1、OE2叶片及种子的总脂含量。结果表明,野生型与转空载对照植株的叶片总脂没有差异;与转空载对照相比,两个转基因株系叶片的脂肪酸含量分别提高了3.7%和4.2%,差异显著(图5)。
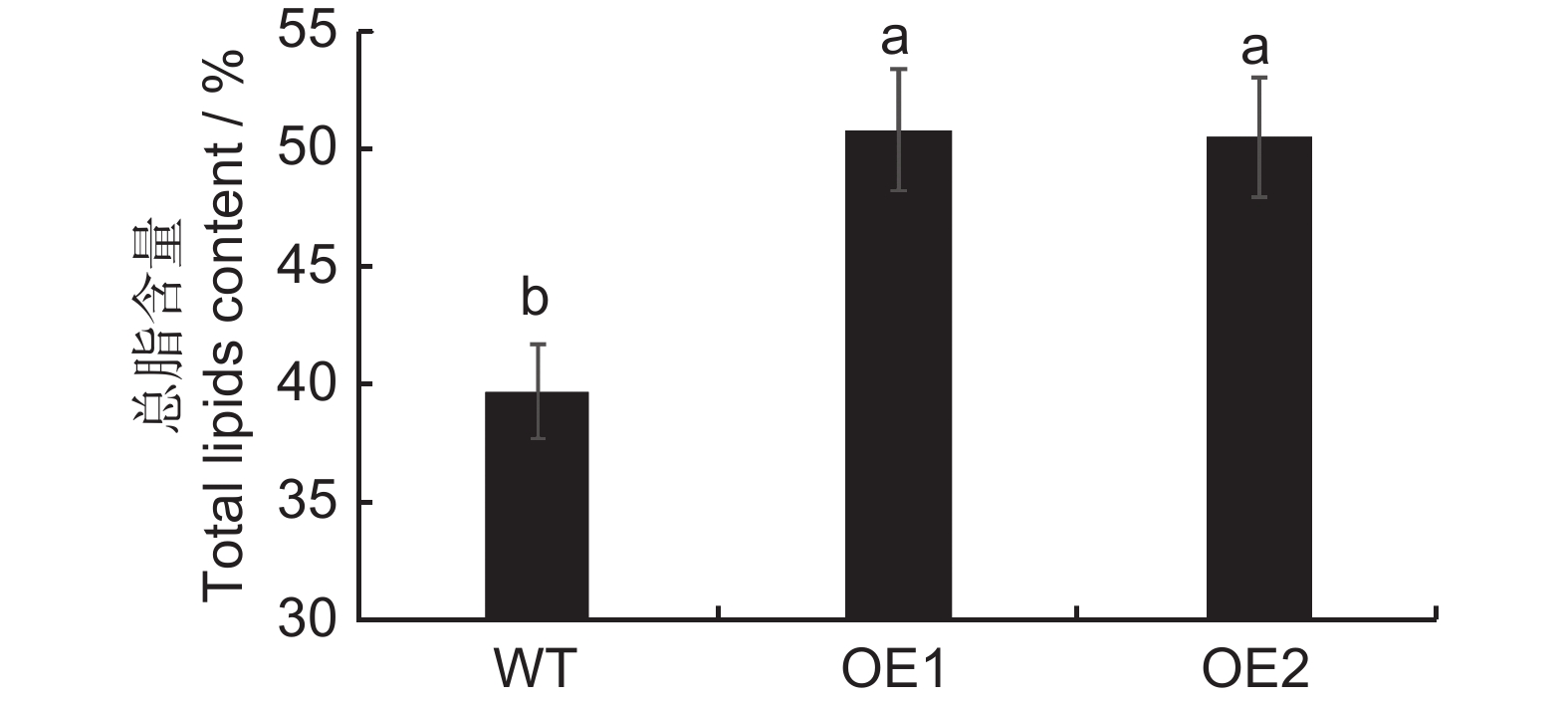
测定烟草野生型和转基因株系种子的总脂,结果显示,野生型烟草种子的总脂含量为39.8%,而两个转基因株系的种子总脂含量分别为50.8%和50.5%,与野生型相比,分别提升了11.0%和10.7%,差异显著(图6)。
3. 讨论
续随子是生产生物柴油的理想原料之一。MYB转录因子目前已在许多植物中被鉴定出来,包括玉米(Zea mays L.)[17]、大豆(Glycine max (L.) Merr.)[18]、蓖麻(Ricinus communis L.)[19]等。研究表明,MYB转录因子在种子油脂快速积累过程中发挥重要调节作用。
在植物MYB转录因子家族中,基因重复事件可以促进基因家族的扩张[20]。Cao等[21]发现,大戟科MYB基因家族在进化过程中发生了片段重复或全基因组重复事件,导致了基因组数目增加,且不同物种中数目变化不一致。本研究从续随子的基因组数据中共鉴定出199个MYB转录因子,包含78个MYB-related、115个R2R3-MYB、5个3R-MYB、1个4R-MYB,这与报道的大戟科其他物种MYB转录因子的数量相差较大,如油桐(Vernicia fordii (Hemsl.) Airy Shaw)中MYB转录因子家族成员至少有149个[22],巴西橡胶树(Hevea brasiliensis (Willd. ex A. Juss.) Muell. Arg.)MYB家族成员有141个[23]。本研究发现,续随子1~10号染色体上均分布着关系紧密的基因簇,推测可能出现过基因串联复制事件,从而导致基因家族成员数目扩大,正如紫花苜蓿(Medicago sativa L.)[24]中发生的一样。续随子ElMYB114基因启动子区域存在许多激素响应元件,表明激素可能作为重要调控信号参与续随子的发育和基因诱导过程[25]。MYB转录因子与MYB元件结合,对调控植物逆境胁迫响应起重要作用[26]。譬如,和续随子ElMYB114同属S10亚族的拟南芥MYB39转录因子参与盐驯化机制[27]。因此,推测续随子ElMYB114基因可能也参与逆境胁迫响应过程。研究表明,基因的表达模式通常可为其功能研究提供重要参考[28]。牛听风等[29]发现不同发育时期的续随子种子油含量呈动态变化模式,花后22~43 d是油脂积累的关键时期。本研究基于续随子转录组数据,选择与种子油脂积累趋势基本一致且表达显著上调的6个基因(ElMYB33、ElMYB63、ElMYB100、ElMYB111、ElMYB114、ElMYB188),进行qRT-PCR分析,结果发现ElMYB114基因在续随子的各个组织中均有表达,且在种子发育后期的表达量显著高于其他基因。这表明,在种子油脂储藏期,ElMYB114可能会通过调控相关基因的表达来控制油脂的合成与积累。
前人研究证实,具有两个重复结构域的R2R3-MYB型转录因子不仅能够直接或间接地参与脂肪酸链的伸长,还可以提高植物的抗逆性和促进种子中油脂的积累,如MYB89[5]、MYB96、MYB92等[30-33]。将外源基因转入受体细胞并实现稳定表达和遗传的转基因技术是鉴定基因功能的有效方法[34]。本研究发现,续随子ElMYB114属于R2R3-MYB型转录因子,通过烟草遗传转化方法鉴定ElMYB114基因的功能,发现两个转基因株系叶片的总油脂含量分别提高了3.7%和4.2%,且其种子中油脂含量也显著提高(分别增加了11.0%和10.7%),表明过表达ElMYB114基因对烟草种子的油脂含量有较大影响,研究结果为利用MYB基因提高续随子种子油的含量奠定了基础。
本研究发现,过表达ElMYB114基因的烟草株系中,种子中总脂含量较叶片的变化更大,总脂含量在两种组织中积累模式的差异可能是不同器官间的生理和代谢差异所导致,但与大豆[35]、亚麻荠(Camelina sativa (L.) Crantz)[36]等植物相比,续随子种子中的总油脂含量增加不多。推测油脂合成可能存在复杂的调控机制,许多MYB转录因子通过直接或间接调控油脂合成过程中的关键酶或基因的表达,从而促进种子脂肪酸的合成。如,MYB89通过调控WRI1、L1L和脂肪酸合成关键基因来调控种子脂肪酸的累积[5],而共表达MYB96A和DGAT1C基因可显著提高亚麻荠的种子油含量[36]。
综上所述,本研究鉴定获得了199个续随子MYB基因,推测其中ElMYB114基因对种子的物质代谢过程起重要调控作用。研究结果显示,ElMYB114蛋白定位于细胞核,在烟草中过表达ElMYB114基因,转基因株系叶片和种子中的总油脂含量均高于野生型,表明ElMYB114基因的表达可促进种子总油脂的积累。
1 如需查阅附图内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 引物信息
Table 1 Primer information
引物名称
Primer name引物序列(5'→3')
Primer sequence (5'→3')用途
ApplicationElAction-F ATGTATGTCGCCATTCAAGCCGTTC 内参 ElAction-R TCATCAGAGCATCAGTAAGGTCACG ElMYB33-F TGCATGCTAGATGGGGGAAC 实时荧光定量PCR ElMYB33-R TGTCGCAGTTTTCGGGTACT ElMYB63-F ATTCGAGTTCCAGCGCTACG ElMYB63-R GATCCATCCGAGTTCGCACA ElMYB100-F CACCGCAAGGACCGATAACT ElMYB100-R ATATGCCGATACCAGGGGGT ElMYB111-F GGACGAGATGTCGCAATGGA ElMYB111-R TAACACGTGGCTTTGGACGA ElMYB114-F TCGAGGAATGTGGTGGTGAC ElMYB114-R AGGGTTGCTCTCCACACTTG ElMYB188-F AACGTTACTCCTCAAGCCCG ElMYB188-R CTGAGGAGGCAATTGAGCCA ElMYB114-1303-F ATGACCGCTTGCTGGACTCG 基因克隆 ElMYB114-1303-R TCACATTGGGGGGAAGTTATAGTT ElMYB114-1300-F ATGACCGCTTGCTGGACTCG ElMYB114-1300-R CATTGGGGGGAAGTTATAGTTTTG 表 2 续随子ElMYB家族蛋白的基本理化性质
Table 2 Basic information of ElMYB family proteins
蛋白类型
Protein type数量
Quantity分子量
Molecular
weight / kD氨基酸数
Number of amino acids等电点
Theoretical pI不稳定指数
Instability index / (II)亲水性系数
GRAVY亚细胞定位
Subcellular
localizationMYB-related 78 8.23~219.86 72~2 026 4.25~9.93 32.06~89.20 −1.316~−0.137 细胞核 R2R3-MYB 115 12.34~177.75 105~1 619 4.62~9.98 35.43~81.68 −1.220~−0.319 细胞核 3R-MYB 5 39.08~119.47 330~1 081 5.26~9.00 43.07~60.47 −0.642~−1.220 细胞核 4R-MYB 1 118.07 1 043 6.94 55.65 −0.828 细胞核 合计 199 8.23~219.86 72~2 026 4.25~9.98 32.06~89.20 −1.316~−0.137 细胞核 表 3 续随子ElMYB基因上游启动子顺式作用元件
Table 3 Cis-acting elements in the upstream promoter of ElMYB genes of Euphorbia lathyris
顺式作用元件
Cis-acting element核心序列
Core sequence功能
FunctionWRE3 CCACCT 损伤诱导元件 LTR CCGAAA 低温响应元件 MYB CAACAG MYB结合位点 Myc TCTCTTA MYC结合位点 MRE AACCTAA 与光反应有关的MYB结合位点 WUN-motif TTATTACAT 创伤反应元件 STRE AGGGG 热休克、营养饥饿和低pH诱导响应元件 GATA-motif GATAGGA 光响应元件 CAAT-box CAAT 启动子和增强子区域的共同顺式作用元件 TC-rich repeats GTTTTCTTAC 参与防御和应激反应的顺式作用元件 GT1-motif GGTTAA 光响应元件 Box 4 ATTAAT 参与光反应的保守DNA模块的一部分 MYB-like sequence TAACCA MYB结合位点 ABRE ACGTG 脱落酸响应元件 ABRE3a TACGTG 脱落酸响应元件 AAGAA-motif GAAAGAA 脱落酸响应元件 ABRE4 CACGTA 脱落酸响应元件 TATA-box TATAAATA 启动子基本元件 P-box CCTTTTG 赤霉素响应元件 Myb-binding site CAACAG MYB结合位点 ARE AAACCA 厌氧响应元件 G-box TACGTG 光响应相关的顺式作用元件 TCA-element CCATCTTTTT 水杨酸反应涉及的顺式作用元件 3-AF3 bind site CACTATCTAAC 光应答 A-box CCGTCC α-淀粉酶启动子保守序列 ABRE2 CCACGTGG 脱落酸响应元件 AT1-motif AATTATTTTTTATT 光应答 AE-box AGAAACTT 光响应模块 ATCT-motif AATCTAATCC 部分光反应元件 as-1 TGACG 压力响应元件 CAT-box GCCACT 与分生组织表达相关的顺式作用元件 TCA TCATCTTCAT 水杨酸响应元件 TGA-box TGACGTAA 部分生长素响应元件 MBS CAACTG 与干旱诱导有关的MYB结合位点 -
[1] 危文亮,金梦阳,马冲,冯顺山. 续随子油脂肪酸组成分析[J]. 中国油脂,2007,32(5):70−71. doi: 10.3321/j.issn:1003-7969.2007.05.020 Wei WL,Jin MY,Ma C,Feng SS. Fatty acid composition analysis of Euphorbia lathyris L. seed oil[J]. China Oils and Fats,2007,32(5):70−71. doi: 10.3321/j.issn:1003-7969.2007.05.020
[2] 李昌珠,吴红,肖志红,李力. 工业油料植物资源高值化利用研究进展[J]. 湖南林业科技,2014,41(6):106−111. doi: 10.3969/j.issn.1003-5710.2014.06.026 Li CZ,Wu H,Xiao ZH,Li L. Research progress of industrial oil plant resources in high-valued application[J]. Hunan Forestry Science & Technology,2014,41(6):106−111. doi: 10.3969/j.issn.1003-5710.2014.06.026
[3] 林正芳,王伟. 我国生物柴油产业发展现状及战略选择[J]. 化学工业,2013,31(9):20−22. doi: 10.3969/j.issn.1673-9647.2013.09.006 Lin ZF,Wang W. The development status and strategic choices of biodiesel industry in China[J]. Chemical Industry,2013,31(9):20−22. doi: 10.3969/j.issn.1673-9647.2013.09.006
[4] Singh R,Low ETL,Ooi LCL,Ong-Abdullah M,Nookiah R,et al. The oil palm VIRESCENS gene controls fruit colour and encodes a R2R3-MYB[J]. Nat Commun,2014,5(1):4106. doi: 10.1038/ncomms5106
[5] Li D,Jin CY,Duan SW,Zhu YN,Qi SH,et al. MYB89 transcription factor represses seed oil accumulation[J]. Plant Physiol,2017,173(2):1211−1225. doi: 10.1104/pp.16.01634
[6] Lee HG,Kim H,Suh MC,Kim HU,Seo PJ. The MYB96 transcription factor regulates triacylglycerol accumulation by activating DGAT1 and PDAT1 expression in Arabidopsis seeds[J]. Plant Cell Physiol,2018,59(7):1432−1442.
[7] Duan SW,Jin CY,Li D,Gao CH,Qi SH,et al. MYB76 inhibits seed fatty acid accumulation in Arabidopsis[J]. Front Plant Sci,2017,8:226.
[8] Chen MX,Wang Z,Zhu YN,Li ZL,Hussain N,et al. The effect of TRANSPARENT TESTA2 on seed fatty acid biosynthesis and tolerance to environmental stresses during young seedling establishment in Arabidopsis[J]. Plant Physiol,2012,160(2):1023−1036. doi: 10.1104/pp.112.202945
[9] Wang Z,Chen MX,Chen TL,Xuan LJ,Li ZL, et al. TRANSPARENT TESTA2 regulates embryonic fatty acid biosynthesis by targeting FUSCA3 during the early developmental stage of Arabidopsis seeds[J]. Plant J,2014,77(5):757−769.
[10] Luo GB,Shen LS,Song YH,Yu K,Ji JJ,et al. The MYB family transcription factor TuODORANT1 from Triticum urartu and the homolog TaODORANT1 from Triticum aestivum inhibit seed storage protein synthesis in wheat[J]. Plant Biotechnol J,2021,19(9):1863−1877. doi: 10.1111/pbi.13604
[11] Lee HG,Park BY,Kim HU,Seo PJ. MYB96 stimulates C18 fatty acid elongation in Arabidopsis seeds[J]. Plant Biotechnol Rep,2015,9(3):161−166. doi: 10.1007/s11816-015-0352-9
[12] Cheng TH,Zhao P,Ren YR,Zou J,Sun MX. AtMIF1 increases seed oil content by attenuating GL2 inhibition[J]. New Phytol,2021,229(4):2152−2162. doi: 10.1111/nph.17016
[13] Dubos C,Stracke R,Grotewold E,Weisshaar B,Martin C,Lepiniec L. MYB transcription factors in Arabidopsis[J]. Trends Plant Sci,2010,15(10):573−581. doi: 10.1016/j.tplants.2010.06.005
[14] 李春霞. 续随子三个候选内参基因的克隆及液泡膜Na + /H + 逆向转运蛋白的表达分析[D]. 南京:南京师范大学,2013:1−56. [15] 高慧玲. 亚麻荠CsDGAT3基因的克隆及功能分析[D]. 晋中:山西农业大学,2020:16−18. [16] 罗涛,王计平,高慧玲,崔红利,李润植. 亚麻荠FUS3转录因子的鉴定及功能分析[J]. 西北植物学报,2022,42(12):2003−2012. doi: 10.7606/j.issn.1000-4025.2022.12.2003 Luo T,Wang JP,Gao HL,Cui HL,Li RZ. Identification and functional analysis of FUS3 transcription factor in Camelina sativa (L.) Crantz[J]. Acta Botanica Boreali-Occidentalia Sinica,2022,42(12):2003−2012. doi: 10.7606/j.issn.1000-4025.2022.12.2003
[17] Chen YH,Cao YY,Wang LJ,Li LM,Yang J,Zou MX. Identification of MYB transcription factor genes and their expression during abiotic stresses in maize[J]. Biol Plant,2018,62(2):222−230. doi: 10.1007/s10535-017-0756-1
[18] He YX,Dong YS,Yang XD,Guo DQ,Qian XY,et al. Functional activation of a novel R2R3-MYB protein gene,GmMYB68,confers salt-alkali resistance in soybean (Glycine max L.)[J]. Genome,2020,63(1):13−26. doi: 10.1139/gen-2018-0132
[19] Liu YY,Wang XY,Li ZJ,Tu J,Lu YN,et al. Regulation of capsule spine formation in castor[J]. Plant Physiol,2023,192(2):1028−1045. doi: 10.1093/plphys/kiad149
[20] Manzoor MA,Li GH,Abdullah M,Wang H,Han WL,et al. Genome-wide investigation and comparative analysis of MATE gene family in Rosaceae species and their regulatory role in abiotic stress responses in Chinese pear (Pyrus bretschneideri)[J]. Physiol Plant,2021,173(3):1163−1178. doi: 10.1111/ppl.13511
[21] Cao YP,Fan TT,Wang LH,Zhang L,Li YL. Large-scale analysis of putative Euphorbiaceae R2R3-MYB transcription factors identifies a MYB involved in seed oil biosynthesis[J]. BMC Plant Biol,2023,23(1):145. doi: 10.1186/s12870-023-04163-5
[22] 冉舵. 油桐MYB转录因子家族的鉴定与功能特征研究[D]. 长沙:中南林业科技大学,2019:11. [23] 林贤桂. 巴西橡胶树MYB基因家族的克隆鉴定[D]. 海口:海南大学,2018:33. [24] 任明辉,张雨蓬,许涛,朱慧森,岑慧芳. 紫花苜蓿R2R3-MYB亚家族鉴定与干旱胁迫下的表达分析[J]. 草地学报,2023,31(4):972−983. Ren MH,Zhang YP,Xu T,Zhu HS,Cen HF. Identification and expression analyses of R2R3-MYB subfamily in alfalfa under drought stress[J]. Acta Agrestia Sinica,2023,31(4):972−983.
[25] 郭晋艳,郑晓瑜,邹翠霞,李秋莉. 植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J]. 生物技术通报,2011(4):16−20,30. Guo JY,Zheng XY,Zou CX,Li QL. Research progress of cis-elements of abiotic stress inducible promoters and associated transcription factors[J]. Biotechnology Bulletin,2011(4):16−20,30.
[26] 陈俊,王宗阳. 植物MYB类转录因子研究进展[J]. 植物生理与分子生物学学报,2002,28(2):81−88. Chen J,Wang ZY. Progress in the study of plant MYB transcription factors[J]. Journal of Plant Physiology and Molecular Biology,2002,28(2):81−88.
[27] 王繁华. MAPK6调控MYB39和ERF109转录因子参与拟南芥盐驯化的机制研究[D]. 济南:山东师范大学,2020:1−90. [28] Li JB,Luan YS,Liu Z. Overexpression of SpWRKY1 promotes resistance to Phytophthora nicotianae and tolerance to salt and drought stress in transgenic tobacco[J]. Physiol Plant,2015,155(3):248−266. doi: 10.1111/ppl.12315
[29] 牛听风,葛丽萍,苏云婷,王壮琳,李润植. 续随子转录因子ElWRI1的鉴定及功能分析[J]. 植物科学学报,2023,41(4):458−466. doi: 10.11913/PSJ.2095-0837.22250 Niu TF,Ge LP,Su YT,Wang ZL,Li RZ. Identification and functional analysis of Euphorbia lathyris L. transcription factor ElWRI1[J]. Plant Science Journal,2023,41(4):458−466. doi: 10.11913/PSJ.2095-0837.22250
[30] 宋雷,范成明,陈宇红,张新永,胡赞民. 植物油脂合成的分子调控机制[J]. 分子植物育种,2016,14(8):2178−2187. Song L,Fan CM,Chen YH,Zhang XY,Hu ZM. The molecular regulation mechanism of the plant lipid biosynthesis[J]. Molecular Plant Breeding,2016,14(8):2178−2187.
[31] Raffaele S,Vailleau F,Léger A,Joubès J,Miersch O,et al. A MYB transcription factor regulates very-long-chain fatty acid biosynthesis for activation of the hypersensitive cell death response in Arabidopsis[J]. Plant Cell,2008,20(3):752−767. doi: 10.1105/tpc.107.054858
[32] Seo PJ,Lee SB,Suh MC,Park MJ,Go YS,Park CM. The MYB96 transcription factor regulates cuticular wax biosynthesis under drought conditions in Arabidopsis[J]. Plant Cell,2011,23(3):1138−1152. doi: 10.1105/tpc.111.083485
[33] To A,Joubès J,Thueux J,Kazaz S,Lepiniec L,Baud S. AtMYB92 enhances fatty acid synthesis and suberin deposition in leaves of Nicotiana benthamiana[J]. Plant J,2020,103(2):660−676. doi: 10.1111/tpj.14759
[34] 王关林,方宏筠. 植物基因工程[M]. 北京:科学出版社,2009:4−7. [35] Liu YF,Li QT,Lu X,Song QX,Lam SM,et al. Soybean GmMYB73 promotes lipid accumulation in transgenic plants[J]. BMC Plant Biol,2014,14:73. doi: 10.1186/1471-2229-14-73
[36] Kim RJ,Kim HU,Suh MC. Development of camelina enhanced with drought stress resistance and seed oil production by co-overexpression of MYB96A and DGAT1C[J]. Ind Crops Prod,2019,138:111475. doi: 10.1016/j.indcrop.2019.111475
-
其他相关附件
-
PDF格式
惠生娟 附图1 C 2R-MYB家族 点击下载(37KB) -
PDF格式
惠生娟 附图1 A 1R-MYB家族 点击下载(19KB) -
PDF格式
惠生娟 附图1 B 3R和4R-MYB家族 点击下载(6KB)
-



 下载:
下载: