Research progress on spray-induced gene silencing technology in the field of plant fungal disease control
-
摘要:
喷施诱导的基因沉默(Spray-induced gene silencing,SIGS)技术是基于植物-病菌分子互作机理,以跨界RNAi技术为基础,通过在植物表面喷施靶向沉默病菌致病基因的核酸试剂,提升植物防病能力,抵御病害侵染的高效绿色植物病害防控技术。该技术具备靶向性强、防效高、环境兼容性好、开发简便等诸多优势,有望大幅度替换化学农药的使用,对国家可持续农业的健康发展具有重大战略意义。本文阐明了SIGS技术的原理,总结了近年来该技术在植物真菌病害防控方面的应用进展,介绍了多种可提升SIGS效率的递送系统,并针对该技术的发展瓶颈问题和应用前景进行了分析和展望。
Abstract:Spray-induced gene silencing (SIGS) is an innovative and sustainable plant disease control technology that leverages the mechanisms of plant-pathogen molecular interactions and cross-kingdom RNA interference (RNAi). By applying nucleic acid reagents designed to target and silence pathogenic genes onto plant surfaces, SIGS enhances plant resistance to pathogens. This technology offers several advantages, including high specificity, exceptional prevention efficiency, environmental compatibility, and simple development. SIGS holds the potential to significantly reduce reliance on chemical fungicides, representing strategic advancement for sustainable agriculture. This paper elucidates the underlying principles of SIGS technology, summarizes the recent applications of SIGS in plant fungal disease control, introduces various delivery systems that enhance its efficiency, and discusses current challenges and future prospects for its broader implementation.
-
Keywords:
- Spray-induced gene silencing /
- Fungal diseases /
- Delivery system
-
真菌病害是植物病害最常见的类型(约占70%~80%)。真菌病害的发生严重影响全球作物、水果的生产及粮食安全,目前植物真菌病害的防治策略主要依赖于田间管理、化学农药喷施、抗病育种和转基因植株创制。然而,长期施用传统杀菌剂,会导致病菌产生耐药性,或发生农药残留等问题。常规抗病育种技术存在选育周期长、抗性易丧失和病害爆发风险大等问题,而转基因植株在短期内推广及上市也面临着困难。实现植物真菌病害的绿色防控对保障我国粮食安全和农业可持续发展具有重大意义。
喷施诱导基因沉默(Spray-induced gene silencing,SIGS)技术是一种新型的基因沉默技术,将体外合成的靶向病菌致病因子的双链RNA(double-stranded RNA,dsRNA)喷施于植物表面,可抑制病菌致病基因的表达,从而实现病害的绿色防控。近年来,该技术在研究寄主植物与真菌互作模式、防治真菌引起的植物病害方面得到了高度重视和广泛应用。利用SIGS技术靶向阻断病原菌致病基因的功能,从而达到降低植物真菌病害危害这一思路被证实是可实施且极具发展前景的。从抗病机理的角度出发,针对性地开发出高效稳定的靶向沉默病原菌致病基因的核酸试剂,将极大地促进病害绿色防控进程[1]。本文主要介绍了SIGS技术的原理,该技术在植物真菌病害防治方面的应用实例及最新开发的多种可增强SIGS功效的递送系统的研究进展,并对后期实际应用中可能遇到的问题进行了展望。
1. SIGS技术的原理
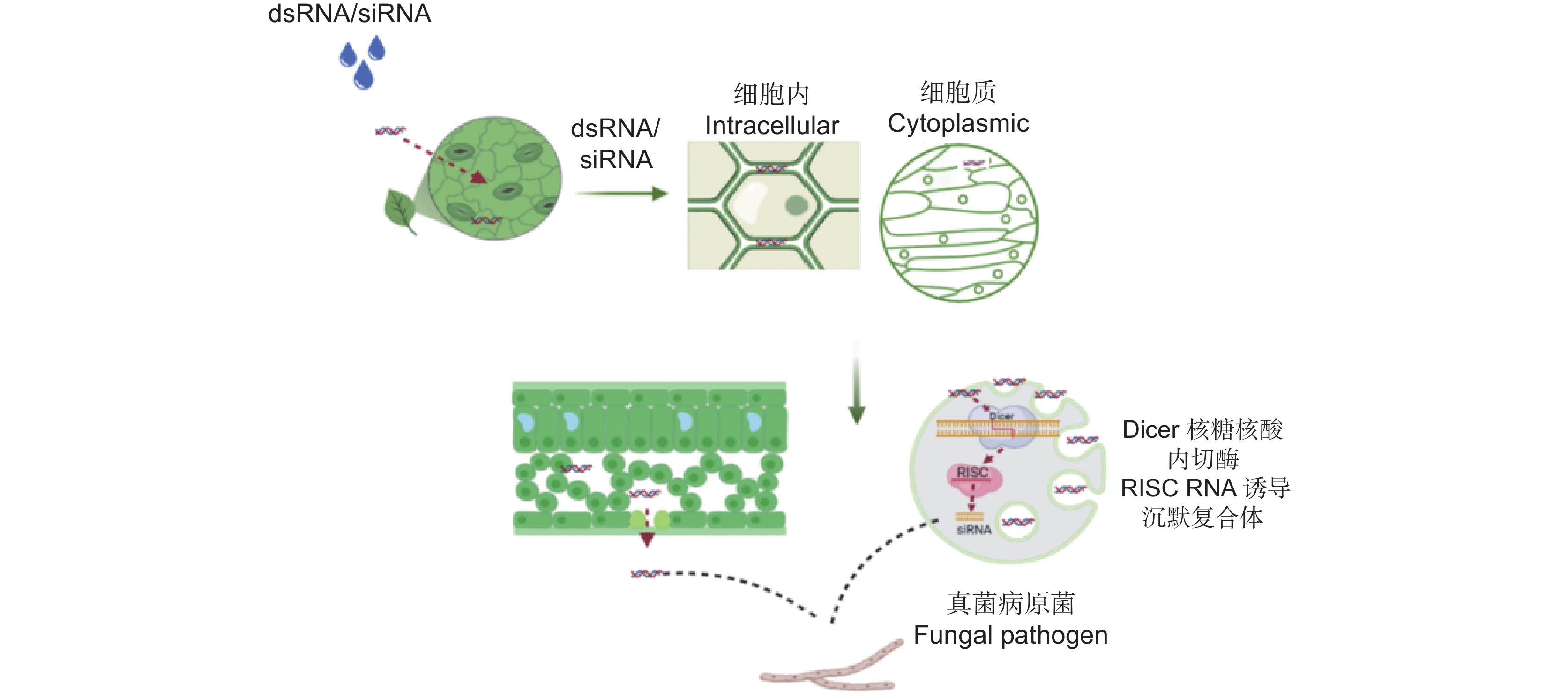
微生物界曾普遍认为植物和病原菌的互作体系中没有基因组及RNA的交换,因为在病菌侵染时,植物及病原菌的基因组及RNA被两套完整的被膜及胞质阻隔[2]。但是,近年来随着对小RNA生物学功能研究的逐步深入,发现小RNA在植物与病原菌互作中具有关键调节功能[3]。He等[4]鉴定了拟南芥(Arabidopsis thaliala (L.) Heynh)中的几种RNA结合蛋白,Argonaute1(AGO1)、RNA螺旋酶(RHs),AGO1、RH11和RH37选择性地与siRNA富集的囊泡结合,表明它们有助于将siRNA选择性地装载到囊泡中。Weiberg等[5]证明拟南芥细胞可以释放出外囊泡,将dsRNA传递到灰霉菌中。
基于小RNA穿梭转运机制的重要理论突破,逐渐发展了以跨界RNAi技术为基础的SIGS技术。其原理是植物吸收了外部喷施的靶向病原菌致病基因的dsRNA后,Dicer-like蛋白将病菌的靶标dsRNA随机剪切成长度为21~24 nt的小RNA(siRNA或miRNA)[6];当受到病菌侵染时,植物直接以dsRNA的形式,或将dsRNA剪切成siRNAs转运至病菌体内,结合到特定的靶标Argonaute(AGO)效应蛋白上,从而达到目标转录本沉默的目的[7],抑制病菌的侵染和扩展(图1)。SIGS技术具有靶向性高、不残留、靶点丰富及可灵活设计等优势。研发SIGS对应的dsRNA所需的时间比培育转基因植物短,能够相对快速地应对新入侵的真菌病害,并且不会像化学农药一样引起环境污染及作物残留等问题,极大地拓宽了RNAi技术在植物病害方面的应用[8]。
2. SIGS 技术在植物真菌病害防控领域的研究进展
2.1 单一靶点dsRNA喷施SIGS技术的应用
自SIGS问世以来,最开始多被用于虫害相关的防治中,但是越来越多的实验证明SIGS技术可用于植物真菌病害的防治,并具备广阔的应用前景(表1)。早在2013 年,Mumbanza等[9]就通过喷施体外合成的dsRNA验证了腺苷酸环化酶(Adenylate cyclase,AC)可作为有效抑制香蕉(Musa nana Lour.)黑斑病和枯萎病的潜在靶点,显著抑制其孢子萌发。Forster等[10]发现外源喷施MpCHS(几丁质合成酶)-dsRNA可抑制茶壳球孢菌(Macrophomina phaseolina Goid.)的生长,使病菌对茶(Camellia sinensis (L.) O. Ktze.)的致病力下降。王妍等[11]以烟草(Nicotiana tabacum L.)靶斑病菌的内切多聚半乳糖醛酸酶(EndoPGs)和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)为靶点,设计并合成dsRNA-endoPGs和dsRNA-RMK1,对烟草离体叶片和大田植株喷施,发现施药后7、14、21 d烟草靶斑病防效均高于50%。郗奕滔等[12]合成靶向暹罗炭疽菌高渗透性甘油促分裂原活化蛋白激酶(High osmolarity glycerol mitogen-activated protein kinase,HOG-MAPK)途径关键成员CsSCS7的dsRNA,喷施后能够影响菌落生长及分生孢子的萌发从而阻断病原菌的侵染途径。Song等[13]针对丹参(Salvia miltiorrhiza Bunge)根腐病的专化型尖刀镰孢菌,设计了RdRp(RNA依赖性RNA聚合酶)的dsRNA,喷施后可有效减少丹参的根部症状。Ouyang等[14]针对引起番茄(Lycopersicon esculentum Mill.)枯萎病的尖孢镰刀菌专化型FolRDR1基因(RNA依赖性RNA聚合酶1基因)设计了dsRNA,在菌株和番茄组织中均观察到FolRDR1-dsRNA 的有效摄取,证实在感染前外源施用dsRNA可显著缓解番茄枯萎病症状。Gu等[15]通过在叶片上喷施小麦(Triticum aestivum L.)隐匿柄锈菌TaCRK2基因(正调控超敏反应细胞死亡过程)的dsRNA实现了对小麦叶锈病的控制。单一靶点的SIGS技术制备简便、喷施简单,但筛选的靶基因是否为关键致病基因会直接影响病害的防控效果。
表 1 喷施诱导的基因沉默在植物真菌病害防治方面的研究进展Table 1. Research progress of spray-induced gene silencing in the control of plant fungal diseases寄主植物
Host病原菌
Pathogen靶标基因
Target gene基因功能
Gene function抗性表现
Resistance参考文献
Reference桃金娘
Rhodomyrtus tomentosa. (Ait.) Hassk桃金娘锈病菌 eEF1A 翻译延伸因子1A 感染前喷施可预防发病,感染后喷施可降低发病程度 [21] 小麦
Triticum aestivum L.禾谷丝核菌 CYP51 羊毛甾醇14α-去甲基化酶 抑制病菌侵染 [22] 辣椒
Capsicum annuum L.辣椒疫霉 RXLR1
RXLR4RXLR效应分子 病斑显著减小 [23] 小麦 禾谷镰刀菌 Myo5-8 标肌球蛋白编码基因 病斑显著减小 [24] 水稻
Oryza sativa L.稻瘟病菌 Cyt-B 编码线粒体基因组中的细胞色素b基因 抑制稻瘟病菌附着胞形成,病斑减小 [25] 番茄
Solanum lycopersicum L.尖孢镰刀菌 Sly-miR398a microRNA miR398家族基因 植株萎蔫情况得到改善,病斑面积减少 [26] 棉花
Gossypium hirsutum L.大丽轮枝菌 Vd ST1-Vd
ST65糖转运蛋白基因 菌丝穿透力减弱,
难以形成侵染结构[27] 小麦 亚洲镰刀菌 Myo5-8 核糖核酸内切酶 有效减少病斑面积 [28] 番茄 尖孢镰刀菌专化型 FolRDR1 RNA依赖性 RNA聚合酶1 显著缓解植株感病症状 [14] 小麦 黄色镰刀菌 TRI5 单端孢霉烯毒素基因 在麦叶和麦穗上喷施能抑制镰刀菌的生长,起到防治作用 [29] 小麦 禾顶囊壳禾谷变种 gdo 龙胆酸1,2-双加氧酶(Gentisate 1,2-dioxygenase,GDO) 抑制菌株生长,
显著降低病斑大小[30] 棉花 大丽轮枝菌 VdSSR1 VdSSR1是一个毒性因子,可以与植物RNA转运复合体TREX的关键组分ALY家族蛋白互作,阻止其与UAP56等TREX组分的组装 可有效减小枯斑的大小,植株萎蔫的程度减小 [31] 苹果
Malus pumila Mill.苹果黑星菌 CIN1、CE5、VICE12、VICE16 CE5 碳水化合物酯酶5、
候选效应子 Cellophane-induced protein 1 precursor (CIN1) gene减少病原菌的菌丝生长和孢子产生,有效阻断侵染途径 [32] 马铃薯
Solanum tuberosum L.马铃薯致病疫霉菌 SDH、EF-1α、GPI-HAM344、PLD-3、HSP-90 山梨糖醇脱氢酶、翻译延伸因子1-α、磷脂酶-D和糖基磷脂酰肌醇锚定的酸性丝氨酸-苏氨酸富集蛋白 菌丝生长和孢子形成受到抑制,病害程度和基因表达量显著降低 [33] 洋葱
Allium cepa L.
玫瑰
Rosa spp.
草莓
Fragaria × ananassa Duch.
甜椒
Capsicum frutescens L.
樱桃
Cerasus pseudocerasus (Lindl.) G. Don)
芒果
Mangifera indica L.
葡萄
Vitis vinifera L.
鹰嘴豆
Cicer arietinum L.灰霉菌 erg 13、erg 11、 erg1、BcVDS 3个基因均为麦角甾醇通路基因,磷酸肌醇磷酸酶抑制因子,可调节分泌膜转运,负责维持膜的流动性、通透性以及膜相关酶的活性 病斑减少,与杀菌剂复合喷施可显著降低杀菌剂的用量 [34, 35] 2.2 多靶点dsRNA混合喷施SIGS技术的应用
一种真菌可能同时引起多种植物病害,将同一种致病菌的关键生长发育及致病基因的dsRNA喷施到不同植株表面,可同时实现对多种植物的病害防控,大大缩减专性防治药剂的研发困难及时间。例如禾谷镰孢菌能侵染小麦、大麦(Hordeum vulgare L.)、水稻(Oryza sativa L.)、燕麦(Arena sativa L.)等禾谷类作物;运用SIGS技术同时沉默禾谷镰孢菌编码细胞色素P450[16]、几丁质合成酶[17]、蛋白激酶[18]等重要基因可极大降低该菌株的致病性。
此外,多靶点的dsRNA混合喷施,可进一步提升对病菌致病性的抑制作用。Yang等[19]证实,单独喷施Chs7(几丁质合酶7)、Gls(葡聚糖合成酶)和Pkc(蛋白激酶C)对应的dsRNA可抑制菌丝生长,在小麦叶片中病斑减少率为48%~58%;同时喷施2 种dsRNA(Chs7/Gls、Chs7/Pkc或Gls/Pkc)组合的叶片病变面积为5.18%~7.43%,与对照组相比减少62%~70%。更重要的是,喷施3种 dsRNA(Chs7、Gls和Pkc)的组合病变面积为3.73%,减少78%。Alba等[20]针对杀真菌剂靶标的基因,如β型微管蛋白-2(β-tubulin2,tub2)、组氨酸激酶Ⅲ类-1 (Histidine kinase class Ⅲ,bos1)和琥珀酸脱氢酶亚基B(Subunit B of the succinatedehydrogenase,sdhB)等编码与灰霉病菌的毒力/致病性有关的蛋白基因设计了10个 dsRNA,结果表明不同dsRNA的组合应用显著影响了灰霉菌的生长发育,证明了SIGS技术在灰霉病防治方面的潜力。
3. 提高SIGS技术应用效率的辅助方法
植物组织及真菌菌丝吸收dsRNA的效率是决定SIGS技术应用效率的一大重要因素,喷施于植物表面的dsRNA可通过两种途径进入真菌细胞:一是可直接被真菌细胞吸收;二是在被植物细胞吸收后,产生siRNA并转运至真菌细胞中发挥作用。两种途径作用机制不尽相同,值得进一步研究。由于植物体内dsRNA的半衰期较短,因此dsRNA先进入植物细胞再被真菌细胞吸收可能是SIGS技术发挥作用的主要方式。Gu等[36]发现植物吸收dsRNA后,能够通过剪切dsRNA来生成大量次级siRNA,这些siRNA进入真菌细胞并诱导基因沉默,并且继续生成大量siRNA进行进一步的基因沉默。
限制SIGS技术应用的一个关键因素就是dsRNA/siRNA的降解和进入植株及菌丝的效率问题。研究表明,在田间喷施后其半衰期仅为48 h[37],在野外田间环境极易降解,所以提高dsRNA/siRNA的有效时长是SIGS技术进一步发展亟待解决的关键问题。现阶段主要有两种方法可提高dsRNA/siRNA进入植株及菌丝的效率:(1)对植物进行物理或化学预处理,加强植株对环境中的dsRNA/siRNA的吸收效率。Thakre等[38]对番茄叶片进行6种佐剂/表面活性剂处理,发现植物油与阴离子有机硅化合物的组合能提升植物对dsRNA的吸收效率;同时发现紫外激光佐剂促进了dsRNA在番茄脉管系统中的传递。Yao等[39]发现当黑暗下生长的幼苗接受远红光信号诱导时,会促进远红光受体光敏色素A(PhyA)在幼苗的子叶中的积累,促进子叶打开,从而使叶片对植物外源siRNA的吸收效率大大提高,但是该方法会对植物产生伤害。(2)递送系统:将dsRNA/siRNA装载在多种功能的纳米载体内再通过纳米载体将其运送至植物体内,该方法可以有效解决代谢速率、递送效率、内体逃逸、毒副作用、稳定性等一系列的问题。下面我们主要介绍改进的dsRNA/siRNA递送系统以及产业化制备。
3.1 dsRNA/siRNA递送系统
3.1.1 食物来源递送系统
食物来源的负载被证实可以应用于SIGS技术中,载体无毒且价格便宜。Wang等[40]利用水果和蔬菜的细胞成分模拟植物RNA转移囊泡,并将葡萄柚(Citrus paradisi Macf)汁中含有的脂质(构成细胞膜和外泌体的大部分分子)组装成小壳,命名为“类外泌体的纳米载体”,用于封装递送dsRNA/siRNA。
3.1.2 纳米递送系统
对dsRNA或siRNA进行纳米材料和有机化合物负载,或者装载后采取有机膜包囊、有益真菌作为载体,可使dsRNA或siRNA更容易通过病原菌与寄主的互作体系进入病菌中,进而对相应靶标基因进行沉默。
(1)单一纳米递送系统
dsRNA/siRNA结构简单,植物宿主细胞内很多酶都可以将其降解,并且siRNA带负电荷难以通过细胞膜,易导致SIGS效率低。纳米递送系统可以很好地解决这些问题。颜沁等[41]分析了壳聚糖、鱼精蛋白、碳量子点等纳米材料对dsRNA的稳定性及吸收效率的影响,通过静电作用将纳米材料与dsRNA负载结合。Balodi等[42]发现壳聚糖、聚乙烯亚胺等纳米材料对dsRNA的负载量较高,壳聚糖复合物等纳米材料可以提高纹枯病菌对dsRNA的吸收效率。Sundaresha等[33]通过纳米粘土进行聚合物物理交联的策略构建了dsRNA进入植株的新方法。此外,有一些负载本身对病原菌的生长及产孢具有抑制作用。例如Kostov等[43]发现碳量子点(Carbon quantum dots,CQDs)可抑制灰葡萄孢菌、链格孢菌和尖孢镰刀菌的生长,还可以增强外源dsRNA引起的疫霉菌基因沉默的能力,CQDs与dsRNA的混合物增加了RNAi效率,导致发育中的孢子囊中靶基因的转录水平显著降低。Wang等[44]组装了一种结构简单、成本低廉的纳米材料 星状阳离子聚合物(Star polycation,SPc),通过氢键、范德华力和静电吸附等分子间作用力装载药物,形成稳定复合体,解决了疫霉菌属dsRNA吸收效率低下的问题。
除此之外还有很多其他功能的纳米负载,如由3,4,9,10-苝四甲酰二亚胺(PDI),作为发色团与NPs(颗粒材料结构中至少有一个维度小于100 nm)组装后,形成以阳离子聚合物为外壳,以聚苯树枝状聚合物为内壳[45]的负载,可以定位dsRNA,为研究dsRNA或siRNA的传输途径与传输机制的研究奠定材料基础[34]。
Bioclay粘土纳米片材料在dsRNA负载中也发挥了极大的作用。其中层状双氢氧化合物(Layered double hydroxides,LDH)是一种层状氢氧化物粘土纳米片,Jain等[46]的研究显示该物质能够有效携带dsRNA并促进其进入植物细胞,同时具有缓释功能,在数周内可有效保护dsRNA免受降解。
(2)金属纳米递送系统
银、金、铜、锌和钛等金属的纳米颗粒也被证实可作为dsRNA进入植物细胞的负载。Li等[47]开发出金属和双金属纳米颗粒携带siRNA,可提升其稳定性及缓释时间;同时发现无机纳米颗粒与金属纳米可以复合负载,在无机纳米颗粒进入病菌后,锌、铜、金和银等金属可破坏病原体的细胞壁或膜[48],从而使载体更容易通过细胞膜及细胞壁。但金属纳米颗粒还不能装载dsRNA,因为dsRNA较长难以被装载,Chaud等[49]构建了可以同时装载多种药物和dsRNA的纳米载体,实现多种dsRNA的复合装载或者dsRNA的协同作用。
(3)包被纳米递送系统
为了将dsRNA输送到靶基因,可将纳米材料进行包被处理,减少在运输途中的干扰或是被病原菌-植物互作体系中分泌的酶降解。细胞膜包被纳米颗粒(CNPs)是一类新兴的纳米载体。Fang等[50]通过细胞获得CNP膜材料,运用裂解、纯化、超声以及微流体混合等技术涂覆在合成纳米材料核心周围,细胞膜包被的纳米颗粒具有典型的核壳结构,更稳定且更高效。阳离子脂质体也可作为dsRNA的载体,通过带正电荷的阳离子脂质与带负电荷的dsRNA之间的静电相互作用形成脂复合物,该方法的优点是脂质与囊泡的亲和性较好,在传递的过程中更容易通过细胞膜[51]。在合成由纳米材料组成的dsRNA时,一般通过在纳米材料的阳离子带电颗粒和dsRNA的磷酸基团之间形成静电相互作用来实现稳定性,因此,这种纳米颗粒dsRNA复合物带有净正电荷,当喷施在植物表面时易嵌入带负电荷的细胞膜表面以及其他细胞实体上,植物吸收率高[52]。
(4)复合纳米递送系统
随着各种纳米材料的使用,新兴的纳米材料及其与其他材料的复合载体展现了极大的发展潜力。Ag@dsRNA@GO的银纳米材料被证实可以减少番茄中黄单胞菌的影响[53]。由TiO2制成的纳米材料也有很广泛的应用,以其为载体的siRNA在防治樱花(Cerasus sp (Matsum.) Yu et Li.)穿孔病和其他斑点病时展现了强大的抗菌性能。此外,应用于番茄中的铈纳米颗粒对枯萎病防效明显[54],Huang等[55]建立了基于沸石咪唑酸框架-8(ZIF-8)和RNA干扰(RNAi)技术的pH值响应型多功能纳米农药体系,可以同时递送小干扰RNA(siRNA)和植物生长调节剂。
3.1.3 有益菌递送系统
除了无机负载外,还可以借助环境中存在的有益菌将dsRNA/siRNA转进有益菌中,使环境中持续保有该dsRNA/siRNA。Islam[56]利用根际有益真菌哈茨木霉作为负载,发现根际有益微生物的原位繁殖在维持dsRNA的稳定性和可持续性方面效果最佳,同时可通过微生物扩繁实现对整个种植区的覆盖,不需要反复喷施,从而大大减少了喷施诱导的基因沉默在实际应用中的困难。值得注意的是,该方法有一个弊端需要规避,若携带的dsRNA为真菌基因组内广泛存在的生长发育重要基因,则会导致有益微生物的死亡。
3.2 dsRNA/siRNA的产业化制备及应用
限制SIGS技术应用的另一个要点是dsRNA的制备,实验室合成双链dsRNA需要依赖T7 RNA 聚合酶,但是该方法价格昂贵并且无法大量制备。为了解决该问题,Feng等[57]建立了基于大肠杆菌的无核小细胞生产和封装dsRNA的平台,构造了一种大肠杆菌突变体可产生大量RNase-Ⅲ活性受损的小细胞,将质粒转化入这种大肠杆菌突变体可以稳定表达地dsRNA。如今最常用的方法是构建对应基因的大肠杆菌表达系统,多使用L4440载体,载体上含有T7聚合酶元件,可以在IPTG的诱导下稳定生成dsRNA,再通过构建的大肠杆菌表达系统,大批量生产dsRNA。该方法使用范围广,载体易于构建,同时大大降低了合成dsRNA的成本[58]。
4. SIGS 技术的展望
作为一种新兴的植物病害防控技术,SIGS已被广泛应用于多种植物真菌病害的防治研究,并展现出了良好的应用前景。然而,仍有许多方面需要进一步改善和优化。病原菌对环境中喷施的dsRNA的吸收效率及吸收后的基因沉默效率是SIGS技术应用的关键,但不同病原菌从环境中摄取dsRNA的能力是不同的,病原物吸收外界dsRNA和siRNA的机制也并未明确。不同真菌对dsRNA的吸收效率差异很大,例如灰霉菌、核盘菌和立枯丝核菌吸收环境中dsRNA的效率较高,而大丽轮枝菌效率较低,炭疽菌则几乎不吸收环境中的dsRNA[58]。前期的研究表明,卵菌和疫霉菌对环境及植物体内的dsRNA的吸收效率较高,而卵菌及疫霉菌的细胞壁成分及结构与真菌略有不同,推测可能是细胞壁的差异,导致不同真菌对环境dsRNA的摄取效率不同。但是dsRNA进入真菌细胞的机制还未可知。研究表明,植物可以通过囊泡将自身dsRNA运输至真菌体内并导致基因沉默[59]。所以明确植物真菌病害中寄主与病原菌对dsRNA的吸收效率及沉默效率是SIGS技术应用的要点。
此外,虽然RNAi技术的原理已经基本明确,但是SIGS技术中siRNA的运输及其与AGO蛋白的结合方法还未有报道,植物体内仅有10~20种AGO蛋白,不同类型的dsRNA与AGO蛋白的选择性结合机制也未知,结合后AGO蛋白是如何将siRNA运输到对应的目的基因的位置进而引发RNAi现象,这些问题都限制着SIGS技术的应用,也限制了纳米负载的进一步发展,值得深入探究。
目前,美国环境保护署(EPA)已批准登记了世界首款喷施型RNA生物农药。SIGS技术除了在植物真菌病害方向具有良好价值外,也在植物病毒病害、植物细菌病害和增加作物产量和质量方面具有重大应用前景。该技术的发展有望大幅度减少或替代化学农药的使用,极大地促进化学农药的减量增效,对国家可持续农业的健康发展具有重大的战略意义。
-
表 1 喷施诱导的基因沉默在植物真菌病害防治方面的研究进展
Table 1 Research progress of spray-induced gene silencing in the control of plant fungal diseases
寄主植物
Host病原菌
Pathogen靶标基因
Target gene基因功能
Gene function抗性表现
Resistance参考文献
Reference桃金娘
Rhodomyrtus tomentosa. (Ait.) Hassk桃金娘锈病菌 eEF1A 翻译延伸因子1A 感染前喷施可预防发病,感染后喷施可降低发病程度 [21] 小麦
Triticum aestivum L.禾谷丝核菌 CYP51 羊毛甾醇14α-去甲基化酶 抑制病菌侵染 [22] 辣椒
Capsicum annuum L.辣椒疫霉 RXLR1
RXLR4RXLR效应分子 病斑显著减小 [23] 小麦 禾谷镰刀菌 Myo5-8 标肌球蛋白编码基因 病斑显著减小 [24] 水稻
Oryza sativa L.稻瘟病菌 Cyt-B 编码线粒体基因组中的细胞色素b基因 抑制稻瘟病菌附着胞形成,病斑减小 [25] 番茄
Solanum lycopersicum L.尖孢镰刀菌 Sly-miR398a microRNA miR398家族基因 植株萎蔫情况得到改善,病斑面积减少 [26] 棉花
Gossypium hirsutum L.大丽轮枝菌 Vd ST1-Vd
ST65糖转运蛋白基因 菌丝穿透力减弱,
难以形成侵染结构[27] 小麦 亚洲镰刀菌 Myo5-8 核糖核酸内切酶 有效减少病斑面积 [28] 番茄 尖孢镰刀菌专化型 FolRDR1 RNA依赖性 RNA聚合酶1 显著缓解植株感病症状 [14] 小麦 黄色镰刀菌 TRI5 单端孢霉烯毒素基因 在麦叶和麦穗上喷施能抑制镰刀菌的生长,起到防治作用 [29] 小麦 禾顶囊壳禾谷变种 gdo 龙胆酸1,2-双加氧酶(Gentisate 1,2-dioxygenase,GDO) 抑制菌株生长,
显著降低病斑大小[30] 棉花 大丽轮枝菌 VdSSR1 VdSSR1是一个毒性因子,可以与植物RNA转运复合体TREX的关键组分ALY家族蛋白互作,阻止其与UAP56等TREX组分的组装 可有效减小枯斑的大小,植株萎蔫的程度减小 [31] 苹果
Malus pumila Mill.苹果黑星菌 CIN1、CE5、VICE12、VICE16 CE5 碳水化合物酯酶5、
候选效应子 Cellophane-induced protein 1 precursor (CIN1) gene减少病原菌的菌丝生长和孢子产生,有效阻断侵染途径 [32] 马铃薯
Solanum tuberosum L.马铃薯致病疫霉菌 SDH、EF-1α、GPI-HAM344、PLD-3、HSP-90 山梨糖醇脱氢酶、翻译延伸因子1-α、磷脂酶-D和糖基磷脂酰肌醇锚定的酸性丝氨酸-苏氨酸富集蛋白 菌丝生长和孢子形成受到抑制,病害程度和基因表达量显著降低 [33] 洋葱
Allium cepa L.
玫瑰
Rosa spp.
草莓
Fragaria × ananassa Duch.
甜椒
Capsicum frutescens L.
樱桃
Cerasus pseudocerasus (Lindl.) G. Don)
芒果
Mangifera indica L.
葡萄
Vitis vinifera L.
鹰嘴豆
Cicer arietinum L.灰霉菌 erg 13、erg 11、 erg1、BcVDS 3个基因均为麦角甾醇通路基因,磷酸肌醇磷酸酶抑制因子,可调节分泌膜转运,负责维持膜的流动性、通透性以及膜相关酶的活性 病斑减少,与杀菌剂复合喷施可显著降低杀菌剂的用量 [34, 35] -
[1] Mann CWG,Sawyer A,Gardiner DM,Mitter N,Carroll BJ,et al. RNA-based control of fungal pathogens in plants[J]. Int J Mol Sci,2023,24(15):12391. doi: 10.3390/ijms241512391
[2] Baulcombe DC. VIGS,HIGS and FIGS:small RNA silencing in the interactions of viruses or filamentous organisms with their plant hosts[J]. Curr Opin Plant Biol,2015,26:141−146. doi: 10.1016/j.pbi.2015.06.007
[3] Kamath RS,Martinez-Campos M,Zipperlen P,Fraser AG,Ahringer J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans[J]. Genome Biol,2000,2(1):research0002.1. doi: 10.1186/gb-2000-2-1-research0002
[4] He BY,Cai Q,Qiao LL,Hang CY,Wang SM,et al. RNA-binding proteins contribute to small RNA loading in plant extracellular vesicles[J]. Nat Plants,2021,7(3):342−352. doi: 10.1038/s41477-021-00863-8
[5] Weiberg A,Wang M,Lin FM,Zhao HW,Zhang ZH,et al. Fungal small RNAs suppress plant immunity by hijacking host RNA interference pathways[J]. Science,2013,342(6154):118−123.
[6] Hammond SM,Caudy AA,Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA[J]. Nat Rev Genet,2001,2(2):110−119. doi: 10.1038/35052556
[7] Devers EA,Brosnan CA,Sarazin A. Albertini D,Amsler AC,et al. Movement and differential consumption of short interfering RNA duplexes underlie mobile RNA interference[J]. Nat Plants,2020,6(7):789−799. doi: 10.1038/s41477-020-0687-2
[8] Hoang BTL,Fletcher SJ,Brosnan CA,Ghodke AB,Manzie N,Mitter N. RNAi as a foliar spray:efficiency and challenges to field applications[J]. Int J Mol Sci,2022,23(12):6639. doi: 10.3390/ijms23126639
[9] Mumbanza FM,Kiggundu A,Tusiime G,Tushemereirwe WK,Niblett C,Bailey A. In vitro antifungal activity of synthetic dsRNA molecules against two pathogens of banana,Fusarium oxysporum f. sp. cubense and Mycosphaerella fijiensis[J]. Pest Manag Sci,2013,69(10):1155−1162. doi: 10.1002/ps.3480
[10] Forster H,Shuai B. Exogenous siRNAs against chitin synthase gene suppress the growth of the pathogenic fungus Macrophomina phaseolina[J]. Mycologia,2020,112(4):699−710. doi: 10.1080/00275514.2020.1753467
[11] 王妍,郭依,汪汉成,蔡刘体,安梦楠,等. dsRNA-endoPGs和dsRNA-RMK1介导的RNAi对烟草靶斑病的抑制作用[J]. 烟草科技,2023,56(12):1−6. Wang Y,Guo Y,Wang HC,Cai LT,An MN,et al. Inhibition effects of RNAi mediated by dsRNA-endoPGs and dsRNA-RMK1 on tobacco target spot disease[J]. Tobacco Science & Technology,2023,56(12):1−6.
[12] 郗奕滔,龙熙平,严靖婷,宋苗,林春花,缪卫国. 逞罗炭疽菌CsSCS7基因功能分析[C]//中国植物病理学会2023年学术年会论文集. 泰安:中国植物病理学会,2023:1. [13] Song LY,Zhong RR,Guan ZZ,Huang LN,Wang GL,et al. Molecular characterization of the first Partitivirus from a causal agent of Salvia miltiorrhiza dry rot[J]. J Fungi (Basel),2024,10(3):179. doi: 10.3390/jof10030179
[14] Ouyang SQ,Ji HM,Feng T,Luo SJ,Cheng L,Wang N. Artificial trans-kingdom RNAi of FolRDR1 is a potential strategy to control tomato wilt disease[J]. PLoS Pathog,2023,19(6):e1011463. doi: 10.1371/journal.ppat.1011463
[15] Gu J,Sun JW,Liu N,Sun XZ,Liu CJ,et al. A novel cysteine-rich receptor-like kinase gene,TaCRK2,contributes to leaf rust resistance in wheat[J]. Mol Plant Pathol,2020,21(5):732−746. doi: 10.1111/mpp.12929
[16] Koch A,Kumar N,Weber L,Keller H,Imani J,Kogel KH. Host-induced gene silencing of cytochrome P450 lanosterol C14α-demethylase-encoding genes confers strong resistance to Fusarium species[J]. Proc Natl Acad Sci USA,2013,110(48):19324−19329 doi: 10.1073/pnas.1306373110
[17] Cheng W,Song XS,Li HP,Cao LH,Sun K,et al. Host-induced gene silencing of an essential chitin synthase gene confers durable resistance to Fusarium head blight and seedling blight in wheat[J]. Plant Biotechnol J,2015,13(9):1335−1345. doi: 10.1111/pbi.12352
[18] Pareek M,Rajam MV. RNAi-mediated silencing of MAP kinase signalling genes (Fmk1,Hog1,and Pbs2) in Fusarium oxysporum reduces pathogenesis on tomato plants[J]. Fungal Biol,2017,121(9):775−784 doi: 10.1016/j.funbio.2017.05.005
[19] Yang P,Yi SY,Nian JN,Yuan QS,He WJ,et al. Application of double-strand RNAs targeting chitin synthase,glucan synthase,and protein kinase reduces Fusarium graminearum spreading in wheat[J]. Front Microbiol,2021,12:660976. doi: 10.3389/fmicb.2021.660976
[20] Alba LL,Alejandra VF,Alejandro PG,Dolores FO. The potential of the RNAi technology,via SIGS,in the control of Botrytis cinerea in horticultural crops[EB/OL]. [2023-01-24]. https://hdl.handle.net/10630/25261
[21] Degnan RM,Shuey LS,Radford-Smith J,Gard iner DM,Carroll BJ,et al. Double-stranded RNA prevents and cures infection by rust fungi[J]. Commun Biol,2023,6(1):1234. doi: 10.1038/s42003-023-05618-z
[22] 成永杰. 基因沉默方法在禾谷丝核菌基因功能研究中的应用[D]. 荆州:长江大学,2022:23. [23] 林梦兰. 辣椒疫霉RXLR效应分子HIGS和SIGS靶标的筛选[D]. 福州:福建农林大学,2020:56. [24] 效雪梅. 禾谷镰刀菌药敏性相关基因及其调控研究[D]. 南京:南京农业大学,2020:35. [25] 丁绍晨. 抑制稻瘟病菌的人工小分子RNA的筛选及机制研究[D]. 南京:南京农业大学,2020:57. [26] 成璐. 基于跨界Sly-miR398a的RNAi新型生物制剂研发与应用[D]. 扬州:扬州大学,2023:47. [27] 陈丽华. 棉花黄萎病菌糖代谢相关基因VdST和VdPT1的功能及RNAi研究[D]. 石河子:石河子大学,2023:27. [28] Gu KX,Wei R,Sun YD,Duan XX,Gao J, et al. Point mutations of Dicer2 conferred Fusarium asiaticum resistance to RNAi-related biopesticide[J/OL]. [2023-12-24]. https://doi.org/10.1016/j.jia.2023.10.024.
[29] Tretiakova P,Voegele RT,Soloviev A,Link TI. Successful silencing of the mycotoxin synthesis gene TRI5 in Fusarium culmorum and observation of reduced virulence in VIGS and SIGS experiments[J]. Genes,2022,13(3):395. doi: 10.3390/genes13030395
[30] 董振杰,麦艳娜,夏晴,马超,田修斌,等. gdo基因RNAi对小麦全蚀病菌的影响[J]. 河南农业科学,2019,48(11):105−111. Dong ZJ,Mai YN,Xia Q,Ma C,Tian XB,et al. Effects of RNA interference of gdo on Gaeumannomyces graminis,the wheat take-all fungus[J]. Journal of Henan Agricultural Science,2019,48(11):105−111.
[31] Zhu YT,Zhao M,Li TT,Wang LZ,Liao CL,et al. Interactions between Verticillium dahliae and cotton:pathogenic mechanism and cotton resistance mechanism to Verticillium wilt[J]. Front Plant Sci,2023,14:1174281. doi: 10.3389/fpls.2023.1174281
[32] Barbara DJ,Roberts AL,Xu XM. Virulence characteristics of apple scab (Venturia inaequalis) isolates from monoculture and mixed orchards[J]. Plant Pathol,2008,57(3):552−561. doi: 10.1111/j.1365-3059.2007.01781.x
[33] Sundaresha S,Sharma S,Bairwa A,Tomar M,Kumar R,et al. Spraying of dsRNA molecules derived from Phytophthora infestans,along with nanoclay carriers as a proof of concept for developing novel protection strategy for potato late blight[J]. Pest Manag Sci,2022,78(7):3183−3192. doi: 10.1002/ps.6949
[34] Duanis-Assaf A,Galsurker O,Davydov O,Maurer D,Feygenberg O,et al. Double-stranded RNA targeting fungal ergosterol biosynthesis pathway controls Botrytis cinerea and postharvest grey mould[J]. Plant Biotechnol J,2022,20(1):226−237. doi: 10.1111/pbi.13708
[35] Niño-Sánchez J,Sambasivam PT,Sawyer A,Hamby R,Chen A,et al. BioClayTM prolongs RNA interference-mediated crop protection against Botrytis cinerea[J]. J Integr Plant Biol,2022,64(11):2187−2198. doi: 10.1111/jipb.13353
[36] Gu KX,Song XS,Xiao XM,Duan XX,Wang JX, et al. A β2-tubulin dsRNA derived from Fusarium asiaticum confers plant resistance to multiple phytopathogens and reduces fungicide resistance[J]. Pestic Biochem Physiol,2019,153:36−46.
[37] 彭月,张海南,韩召军. 稻田中dsRNA的残留动态模拟分析[J]. 南京农业大学学报,2022,45(1):56−63. doi: 10.7685/jnau.202104012 Peng Y,Zhang HN,Han ZJ. Simulation analysis of dsRNA residue dynamics in paddy fields[J]. Journal of Nanjing Agricultural University,2022,45(1):56−63. doi: 10.7685/jnau.202104012
[38] Thakre N,Carver M,Paredes-Montero JR,Mondal M,Hu JH,et al. UV-LASER adjuvant-surfactant-facilitated delivery of mobile dsRNA to tomato plant vasculature and evidence of biological activity by gene knockdown in the potato psyllid[J]. Pest Manag Sci,2024,80(4):2141−2153. doi: 10.1002/ps.7952
[39] Yao XH,Fang K,Qiao K,Xiong JW,Lan JY,et al. Cooperative transcriptional regulation by ATAF1 and HY5 promotes light-induced cotyledon opening in Arabidopsis thaliana[J]. Sci Signal,2024,17(817):eadf7318. doi: 10.1126/scisignal.adf7318
[40] Wang QL,Zhuang XY,Mu JY,Deng ZB,Jiang H,et al. Delivery of therapeutic agents by nanoparticles made of grapefruit-derived lipids[J]. Nat Commun,2013,4:1867. doi: 10.1038/ncomms2886
[41] 颜沁,兰驰,牛冬冬. 基于跨界RNAi防治水稻纹枯病的研究[C]//植物病理科技创新与绿色防控——中国植物病理学会2021年学术年会论文集. 贵阳:中国植物病理学会,2021:1. [42] Balodi R,Gogoi R,Bisht S,Singh S,Singh SK. Antifungal activity of chitosan against Rhizoctonia solani f. sp. sasakii[J]. Appl Biochem Microbiol,2023,59(3):323−329. doi: 10.1134/S000368382303002X
[43] Kostov K,Andonova-Lilova B,Smagghe G. Inhibitory activity of carbon quantum dots against Phytophthora infestans and fungal plant pathogens and their effect on dsRNA-induced gene silencing[J]. Biotechnol Biotechnol Equip,2022,36(1):949−959. doi: 10.1080/13102818.2022.2146533
[44] Wang YX,Li MS,Ying JH,Shen J,Dou DL,et al. High-efficiency green management of potato late blight by a self-assembled multicomponent nano-bioprotectant[J]. Nat Commun,2023,14(1):5622. doi: 10.1038/s41467-023-41447-8
[45] Geng KX,Zhang Y,Zhao X,Zhang WL,Guo XH,et al. Fluorescent nanoparticle-RNAi-mediated silencing of sterol carrier protein-2 gene expression suppresses the growth,development,and reproduction of Helicoverpa armigera[J]. Nanomaterials,2023,13(2):245. doi: 10.3390/nano13020245
[46] Jain RG,Fletcher SJ,Manzie N,Robinson KE,Li P,et al. Foliar application of clay-delivered RNA interference for whitefly control[J]. Nat Plants,2022,8(5):535−548. doi: 10.1038/s41477-022-01152-8
[47] Li MS,Sun XW,Yin MZ,Shen J,Yan S. Recent advances in nanoparticle-mediated co-delivery system:a promising strategy in medical and agricultural field[J]. Int J Mol Sci,2023,24(6):5121. doi: 10.3390/ijms24065121
[48] Vigneswari S,Amelia TSM,Hazwan MH,Mouriya GK,Bhubalan K,et al. Transformation of biowaste for medical applications:incorporation of biologically derived silver nanoparticles as antimicrobial coating[J]. Antibiotics,2021,10(3):229. doi: 10.3390/antibiotics10030229
[49] Chaud M,Souto EB,Zielinska A,Severino P,Batain F,et al. Nanopesticides in agriculture:benefits and challenge in agricultural productivity[J]. Toxics,2021,9(6):131. doi: 10.3390/toxics9060131
[50] Fang RH,Gao WW,Zhang LF. Targeting drugs to tumours using cell membrane-coated nanoparticles[J]. Nat Rev Clin Oncol,2023,20(1):33−48. doi: 10.1038/s41571-022-00699-x
[51] Zhu KY,Palli SR. Mechanisms,applications,and challenges of insect RNA interference[J]. Annu Rev Entomol,2020,65(1):293−311. doi: 10.1146/annurev-ento-011019-025224
[52] Mamta B,Rajam MV. RNAi technology:a new platform for crop pest control[J]. Physiol Mol Biol Plants,2017,23(3):487−501. doi: 10.1007/s12298-017-0443-x
[53] Mujtaba M,Wang DP,Carvalho LB,Oliveira JL,do Espirito Santo Pereira A,et al. Nanocarrier-mediated delivery of miRNA,RNAi,and CRISPR-Cas for plant protection:current trends and future directions[J]. ACS Agric Sci Technol,2021,1(5):417−435. doi: 10.1021/acsagscitech.1c00146
[54] Pan XH,Nie DY,Guo XP,Xu SS,Zhang DY,et al. Effective control of the tomato wilt pathogen using TiO2 nanoparticles as a green nanopesticide[J]. Environ Sci:Nano,2023,10(5):1441−1452.
[55] Huang WL,Wang MJ,Hu ZX,Yang TZ,Pei HL,Zhang F. Multifunctional metal-organic framework with pH-response for co-delivery of prochloraz and siRNA to synergistic control pathogenic fungi[J]. Colloids Surf A:Physicochem Eng Asp,2023,670:131563. doi: 10.1016/j.colsurfa.2023.131563
[56] Islam MT,Davis Z,Chen LS,Englaender J,Zomorodi S,et al. Minicell-based fungal RNAi delivery for sustainable crop protection[J]. Microb Biotechnol,2021,14(4):1847−1856. doi: 10.1111/1751-7915.13699
[57] Feng K,Li W,Tang XY,Luo J,Tang F. Termicin silencing enhances the toxicity of Serratia marcescens Bizio (SM1) to Odontotermes formosanus (Shiraki)[J]. Pestic Biochem Physiol,2022,185:105120. doi: 10.1016/j.pestbp.2022.105120
[58] Qiao LL,Lan C,Capriotti L,Ah-Fong A,Nino Sanchez J,et al. Spray-induced gene silencing for disease control is dependent on the efficiency of pathogen RNA uptake[J]. Plant Biotechnol J,2021,19(9):1756−1768. doi: 10.1111/pbi.13589
[59] Gebremichael DE,Haile ZM,Negrini F,Sabbadini S,Capriotti L,et al. RNA interference strategies for future management of plant pathogenic fungi:prospects and challenges[J]. Plants (Basel),2021,10(4):650. doi: 10.3390/plants10040650



 下载:
下载:
