Bioinformatics analysis of the MTP gene family in Amaranthus hypochondriacus L. and expression characteristics under cadmium stress
-
摘要:
MTP(Metal tolerance protein)又称CDF(Cation diffusion facilitator),是与金属离子转运相关的一类蛋白。为了研究千穗谷(Amaranthus hypochondriacus L.)MTP基因家族的序列特征和进化关系,预测其不同成员的功能和调控机制,我们以最新的千穗谷基因组为参考,鉴定出9个MTP家族成员,分为Zn-CDF(3个)、Zn/Fe-CDF(4个)、Mn-CDF(4个)3个亚族。所有家族成员均具有MTP转运蛋白的典型结构域Cation_efflux,部分成员还包含1个ZT_dimer结构域。染色体定位显示,9个MTP基因分布在7条染色体上。Cd胁迫下,AhMTP7和AhMTP9在根和叶中的表达均被抑制,AhMTP6在叶中被抑制,在根中却被诱导;其余6个MTP基因均受Cd诱导表达,AhMTP2、AhMTP3仅在叶中被诱导,AhMTP5仅在根中被诱导。顺式作用元件分析结果显示,AhMTP启动子中存在多个逆境响应、生长发育和激素信号的顺式作用元件。miRNA预测分析结果表明,15个miRNA靶向7个AhMTP成员。
Abstract:Metal tolerance protein (MTP), also known as cation diffusion facilitator (CDF), is a metal ion transport-related protein. To study the sequence characteristics and evolutionary relationships of the MTP gene family in Amaranthus hypochondriacus L., and to predict the functions and regulatory mechanisms of its members, we took the latest A. hypochondriacus genome as a reference and identified a total of nine members of the A. hypochondriacus MTP family. According to their sequence characteristics, they were divided into three subgroups: Zn-CDF (3), Zn/Fe-CDF (4), and Mn-CDF (4). All family members contained a cation_efflux domain, a typical feature of MTP transporters, with some also containing a ZT_dimer domain. Chromosome mapping showed that the nine MTP genes were distributed on seven chromosomes. Under cadmium (Cd) stress, the expression levels of AhMTP7 and AhMTP9 were inhibited in both leaves and roots, while the expression level of AhMTP6 was inhibited in leaves but induced in roots. The expression levels of the other six AhMTPs were induced by Cd, with AhMTP2 and AhMTP3 only induced in leaves, and AhMTP5 only induced in roots. Promoter cis-acting element analysis identified several cis-acting elements in the AhMTP promoter for stress response, growth and development, and hormone signaling. MicroRNA (miRNA) prediction analysis showed that 15 miRNAs targeted seven AhMTPs.
-
Keywords:
- Amaranthus hypochondriacus /
- MTP /
- Gene expression /
- Metal stress /
- Gene families
-
锌(Zn)、钴(Co)、铁(Fe)、锰(Mn)和铜(Cu)等是植物生长发育所必需的微量元素,低水平下对维持植物生物学功能具有重要意义,但过量时会引起毒害作用[1]。同时,其他非必需元素,如镉(Cd)、银(Ag)、铅(Pb)和汞(Hg)等在低浓度时也会对植物产生毒害作用。因此,植物进化出一系列吸收、转运、螯合和封存机制来应对金属离子的胁迫。目前,一些与阳离子转运相关的蛋白质家族已经被鉴定,如重金属ATP酶(Heavy metal ATPase)、NARMP(Natural resistance associated macrophage protein)、MTP(Metal tolerance protein,MTP)及ZIP转运蛋白(ZRT-IRT like protein)等[2, 3],其中MTP家族在植物响应重金属胁迫过程中起关键作用。
MTP也被称为CDF(Cation diffusion facilitator)转运蛋白,其主要功能是将植物体内的金属离子转运到液泡,以保持细胞中的金属稳态,从而维持植物的正常生长发育。常见的金属阳离子如Cd2 + 、Co2 + 、Zn2 + 、Mn2 + 和Fe2 + 都可以被MTP转运。MTP蛋白的数目因物种而异,目前,在拟南芥(Arabidopsis thaliana (L.) Heynh.)[4]、水稻(Oryza sativa L.)[5]、小麦(Triticum aestivum L.)[6]、甜橙(Citrus sinensis L.)[7]、毛果杨(Populus trichocarpa Torr. & Gray)[8]、蒺藜苜蓿(Medicago truncatula L.)[9]和黄瓜(Cucumis sativus L.)[10]等物种中分别鉴定到12、10、20、12、22、12、10个MTP基因。根据离子转运特性,可将MTP家族分为Zn-CDF、Zn/Fe-CDF和Mn-CDF 3个亚族,根据序列相似性又可进一步分为7组,即组1、组5~9以及组12。其中,组1、5和12属于Zn-CDF亚族;组6、7属于Zn/Fe-CDF亚族;组8、9属于Mn-CDF亚族[4]。大多数MTPs包含4~6个跨膜结构域和1个C端阳离子流出域(Cation_efflux)[11],部分MTPs还包括1个锌离子转运二聚体(Zinc transporter dimerization domain,ZT_dimer)。
拟南芥的12个MTP成员中,AtMTP1和AtMTP3均属于Zn-CDF亚族,且均聚在组1。研究表明,AtMTP1和AtMTP3可以转运高浓度Zn2 + 和Co2 + 离子到液泡中[12, 13]。水稻OsMTP1也属于组1,实验证明在烟草(Nicotiana tabacum L.)中过表达OsMTP1可以提其对Cd的积累和耐受性[12]。AtMTP5和AtMTP12也属于Zn-CDF亚族,AtMTP12有14个跨膜结构域,与AtMTP5形成一个异质二聚体,共同促进Zn2 + 进入高尔基体[13]。AtMTP8属于Mn-CDF,研究发现,AtMTP8参与Mn2 + 的响应机制[14]。此外,MTP8.1和MTP8.2在水稻[15]、甜橙[7]和茶(Camellia sinensis (L.) O. Ktze.)[16]中都被证明与Mn2 + 的转运有关,过表达黄瓜CsMTP8无论是在酵母还是拟南芥中都表现出对锰耐受性的提高[17]。AtMTP6是Zn/Fe-CDF亚族成员,在大肠杆菌突变体中进行功能互补分析表明,AtMTP6参与了Zn2 + 从细胞外转运至细胞内的过程[18]。
千穗谷(Amaranthus hypochondriacus L.)是苋科苋属的一年生草本植物,作为粮饲兼用型多功能作物,千穗谷具有产量高、适口性好、营养价值高等优点。其籽粒中蛋白质含量可达15%[19],氨基酸含量明显高于FAO/WHO规定的标准,脂肪含量占籽粒的6.88%。千穗谷植株高大,一般为1~2 m,高的可达3 m以上,茎叶中蛋白含量较高,营养成分可与牧草之王紫花苜蓿(Medicago sativa L.)媲美[19]。千穗谷根系发达,生长速率快,且适应性强,耐干旱、耐高温[20],对重金属的富集能力较强[21],在重金属修复方面具有较大开发潜能。
目前关于千穗谷MTP家族的研究还未见报道,本研究在全基因组范围内鉴定到9个千穗谷MTP家族成员,从基因序列特征、跨膜结构域、染色体定位、启动子顺式作用元件预测、miRNA靶基因预测和组织特异性表达等方面进行了分析,并通过定量RT-PCR检测了AhMTPs对Cd胁迫的响应,以期为千穗谷MTP基因的功能研究和高产优质千穗谷新种质的培育提供理论依据。
1. 材料与方法
1.1 千穗谷MTP家族成员及理化性质分析
基于Pfam(http://pfam.sanger.ac.uk/)数据库中MTP的隐马尔可夫模型PF01545,使用HMMER3.0软件的HMMSEARCH功能在千穗谷v2.1基因组数据库中查找MTP家族成员序列号,并在Phytozome v13(https://phytozome-next.jgi.doe.gov/)数据库中搜索序列号,获得基因序列和蛋白序列。
通过在线工具ExPASy(http://web.expasy.org/protparam/)分析千穗谷MTP的氨基酸序列长度、等电点、相对分子质量等理化性质数据;使用在线网站Plant-mPLoc sever(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/#)预测AhMTP蛋白的亚细胞定位。
1.2 千穗谷MTP蛋白系统发育树构建
通过MEGA 7软件对9个千穗谷、12个拟南芥、9个甜菜(Beta vulgaris L.)MTP蛋白序列进行多重序列比对,构建系统发育树(采用邻近法)。进一步使用iTOL(https://itol.embl.de/)美化系统发育树。拟南芥MTP家族蛋白序列下载于TAIR(https://www.arabidopsis.org/),甜菜MTP基因家族蛋白序列下载于Phytozome v13数据库。
1.3 千穗谷MTP基因结构及跨膜结构域分析
使用TBtools软件对AhMTP家族成员进行基因结构分析。通过SMART(http://smart.embl-heidelberg.de/)在线软件对千穗谷MTP家族成员进行跨膜结构域分析。使用HMMER(https://www.ebi.ac.uk/Tools/hmmer/search/phmmer)在线软件对所有AhMTP家族成员进行功能域鉴定。
1.4 千穗谷MTP蛋白二级与三级结构分析
使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)在线软件对千穗谷MTP成员进行蛋白质二级结构分析;通过Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)在线服务器对千穗谷MTP家族成员进行蛋白质三级结构建模分析。
1.5 千穗谷MTP基因染色体定位及共线性分析
根据Phytozome v13数据库中的基因位置信息,使用TBtools软件展示AhMTP家族成员染色体定位结果。从Phytozome v13数据库下载千穗谷、拟南芥、水稻、甜菜的基因结构注释信息文件及基因组文件,通过TBtools将其共线性关系进行可视化[22],其中Ah为千穗谷缩写,Os为水稻缩写,At为拟南芥缩写,Bv为甜菜缩写。
1.6 千穗谷MTP基因启动子顺式作用元件预测
取每个家族成员基因序列上游2 000 bp,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站进行启动子顺式作用元件预测。
1.7 千穗谷MTP组织特异性表达分析
从Phytozome v13数据库获取千穗谷MTP基因在不同发育时期、不同组织器官的PKAM数据,使用Heml软件对基因在不同组织中的表达谱进行聚类分析,并绘制热图。
1.8 千穗谷MTP基因的miRNA预测
利用psRNATarget(https://www.zhaolab.org/psRNATarget/home)在线网站,使用MTP基因的编码区为靶序列进行miRNA预测,设置期望值 ≤ 4.0,miRNA数据选择双子叶模式植物拟南芥。
1.9 材料培养与处理
在温度为23 ℃、光周期为14 h / 10 h、相对湿度为70%的气候室内培养基因型为“1506”的千穗谷种子。发芽后喷施1/2霍格兰营养液,出现第3片真叶时转入含5 L 1/2霍格兰营养液的水培装置。水培10 d后,加入80 μmol/L 的CdCl2溶液进行胁迫处理。Cd胁迫1、6 h时采集叶片和根系,立即液氮冷冻,−80 ℃保存备用。每个处理3个生物学重复。
1.10 RNA提取和定量RT-PCR分析
RNA提取:称取0.1 g叶片,用液氮快速研磨,转移至已加入1 mL TRIZOL(Takara,日本)的离心管中;在室温下放置5 min,加0.2 mL氯仿,混匀15 s,室温放置3 min。处理后的匀浆在4 ℃以12000 r/min的转速离心5 min;吸取上清液至新离心管,加入0.5 mL异丙醇,室温下放置10 min,4 ℃12000 r/min离心15 min;去上清,用1 mL 75%乙醇洗涤沉淀;离心并去除乙醇后,将沉淀在空气中晾干5~10 min,溶解RNA于DEPC处理的水中,枪尖吸打数次,55 ℃~60 ℃助溶5~10 min,置于−80 ℃保存备用。
反转录试剂盒为诺唯赞HiScript ⅡQ RT SuperMix for qPCR( + gDNA wiper)。定量RT-PCR所用的引物由Primer3 Plus设计,见附表1
1 。qRT-PCR体系为:10 μL 2 × Ace Q Universal SYBR qPCR Master Mix,上下游引物各0.4 μL,2 μL cDNA,7.2 μL ddH2O。扩增条件为:预变性95 ℃ 5 min,循环反应为95 ℃ 10 s,60 ℃ 30 s,共39个循环,熔解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。每个处理共3个重复,相对表达量采用2−△△Ct法计算。2. 结果与分析
2.1 千穗谷MTP家族成员鉴定
千穗谷基因组文件由Phytozome v13数据库获取,基于Pfam数据库中MTP的隐马尔可夫模型,通过hmmsearch软件鉴定出9个MTP基因家族成员,分别命名为AhMTP1~AhMTP9。鉴定结果表明,AhMTP基因长度在2493~12747 bp,AhMTP3最长,AhMTP2最短;编码蛋白长度在155~830个氨基酸,最长的为AhMTP2,最短的为AhMTP8;等电点在4.81~9.54,大部分蛋白等电点小于7,仅AhMTP1、AhMTP3和AhMTP6的等电点大于7,分别为8.75、7.80和9.54;蛋白分子量在16885.61~93971.60 Da,AhMTP2最大,AhMTP8最小。亚细胞定位结果显示,除了AhMTP2和AhMTP6定位在细胞膜和液泡,其他成员都定位于液泡(表1)。
表 1 千穗谷MTP家族成员基本信息Table 1. Basic information of MTP family members in Amaranthus hypochondriacus基因
Gene登录号
Accession number蛋白长度
Protein length / aa基因长度
Gene length / bp分子量
Molecular weight / Da等电点
Isoelectric point亚细胞定位
LocalizationAhMTP1 AH022184 376 8344 41127.39 8.75 液泡 AhMTP2 AH001412 830 2493 93971.60 6.94 细胞膜/液泡 AhMTP3 AH022259 451 12747 49774.67 7.80 液泡 AhMTP4 AH023492 396 6491 44899.19 4.87 液泡 AhMTP5 AH010891 417 5541 47165.96 5.67 液泡 AhMTP6 AH020319 224 6107 25139.53 9.54 细胞膜/液泡 AhMTP7 AH016853 205 2747 23800.73 6.83 液泡 AhMTP8 AH019735 155 4707 16885.61 5.78 液泡 AhMTP9 AH006882 279 4895 31121.67 4.81 液泡 2.2 千穗谷MTP蛋白系统发育树构建
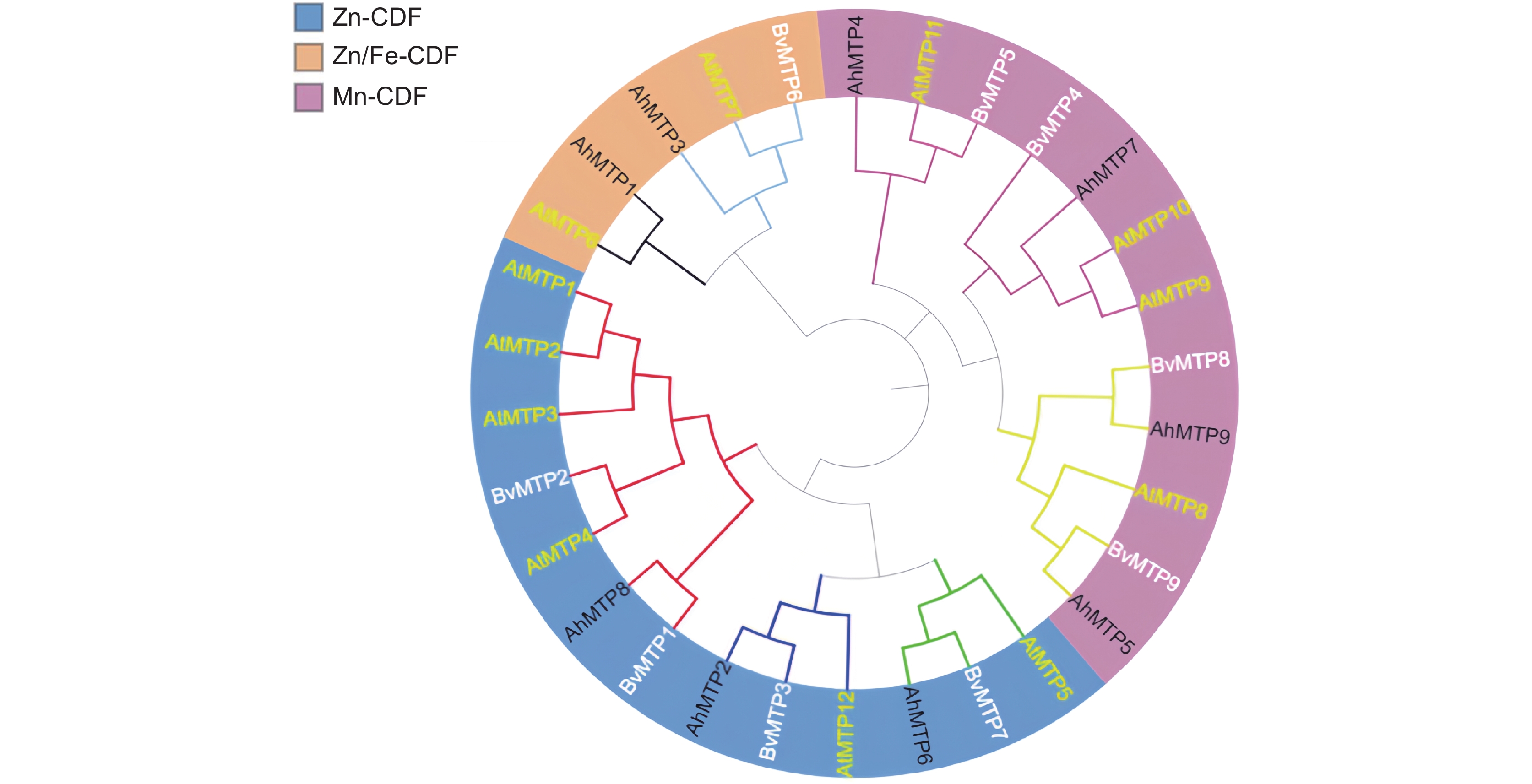
为了研究千穗谷MTP家族成员的进化关系,我们利用MEGA 7软件对千穗谷、拟南芥和千穗谷近缘物种甜菜的MTP家族成员构建了系统进化树(图1)。结果表明,MTP家族成员可分为3个亚族,即Zn-CDF、Zn/Fe-CDF和Mn-CDF。千穗谷AhMTP2、AhMTP6和AhMTP8属于Zn-CDF亚族,与拟南芥AtMTP1~AtMTP5、AtMTP12以及甜菜BvMTP1~BvMTP3、BvMTP7属于同一亚族;其中,AhMTP8属于组1,AhMTP6属于组5,AhMTP2 属于组12。AhMTP1和AhMTP3属于Zn/Fe-CDF亚族,与拟南芥AtMTP6、AtMTP7以及甜菜BvMTP6属于同一亚族;其中AhMTP1属于组6,AhMTP3属于组7。而AhMTP4、AhMTP5、AhMTP7和AhMTP9属于Mn-CDF,与拟南芥AtMTP8~ AtMTP11属于同一亚族,其中,AhMTP5和AhMTP9属于组8,AhMTP4和AhMTP7属于组9。
![]() 图 1 千穗谷、拟南芥和甜菜的MTP基因家族系统发育树不同颜色字体代表不同物种。黄色:拟南芥;白色:甜菜;黑色:千穗谷。不同颜色分支代表不同组,红色代表组1,绿色代表组5,黑色代表组6,亮蓝色代表组7,黄色代表组8,紫色代表组9,深蓝色代表组12。Figure 1. Phylogenetic tree of Amaranthus hypochondriacus, Arabidopsis thaliana, and Beta vulgarisDifferent color fonts represent different species. Yellow for Arabidopsis thaliana, white for Beta vulgaris, and black for Amaranthus hypochondriacus; Different color branches represent different groups, red for group 1, green for group 5, black for group 6, bright blue for group 7, yellow for group 8, purple for group 9, and dark blue for group 12.
图 1 千穗谷、拟南芥和甜菜的MTP基因家族系统发育树不同颜色字体代表不同物种。黄色:拟南芥;白色:甜菜;黑色:千穗谷。不同颜色分支代表不同组,红色代表组1,绿色代表组5,黑色代表组6,亮蓝色代表组7,黄色代表组8,紫色代表组9,深蓝色代表组12。Figure 1. Phylogenetic tree of Amaranthus hypochondriacus, Arabidopsis thaliana, and Beta vulgarisDifferent color fonts represent different species. Yellow for Arabidopsis thaliana, white for Beta vulgaris, and black for Amaranthus hypochondriacus; Different color branches represent different groups, red for group 1, green for group 5, black for group 6, bright blue for group 7, yellow for group 8, purple for group 9, and dark blue for group 12.2.3 千穗谷MTP基因结构与跨膜结构域分析
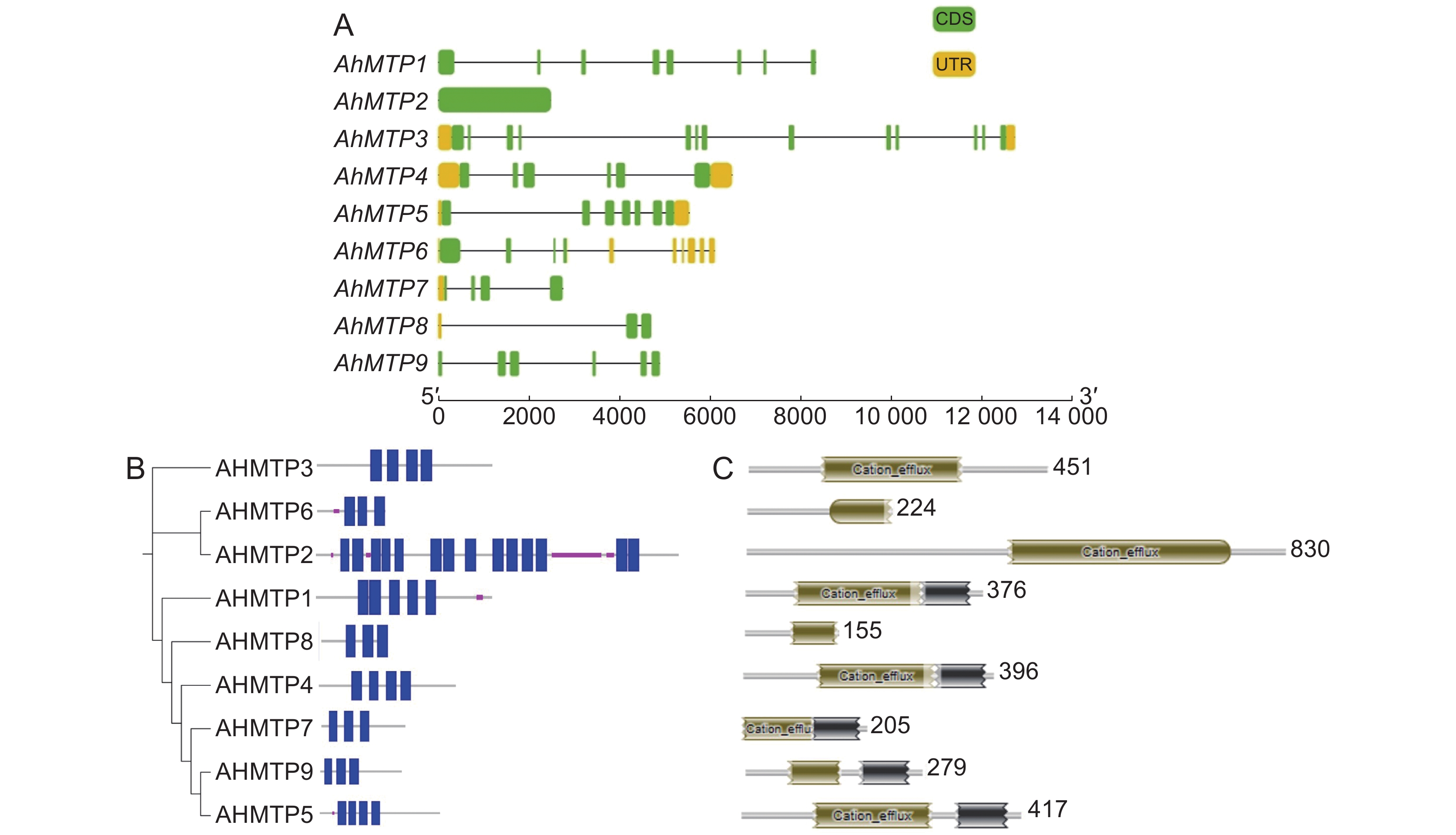
千穗谷MTP家族成员基因结构较为复杂,除AhMTP2无内含子外,其余成员均包含两个及以上内含子,其中AhMTP3多达12个内含子。不同基因内含子序列长度差异也较大,其中AhMTP8包含该家族中最长的内含子,长达4089 bp(图2:A)。
MTP作为金属离子转运蛋白,跨膜结构是其行使功能的重要结构域。对千穗谷MTP家族9个成员进行跨膜结构预测发现,大部分成员包含3 ~ 4个跨膜结构域,而AhMTP2的跨膜结构域最多,达14个(图2:B)。此外,所有家族成员均具有MTP转运蛋白的典型特征Cation_efflux域,AhMTP1、AhMTP4、AhMTP5、AhMTP7、AhMTP9还包含1个ZT_dimer结构域(图2:C)。
2.4 千穗谷MTP蛋白质二级和三级结构分析
基于SOPMA在线软件对千穗谷MTP成员进行蛋白质二级结构分析(附图1
2 ),结果表明,所有家族成员均包含α-螺旋、无规则卷曲和延伸链,大多数成员α-螺旋占比最高,只有AhMTP6无规则卷曲占比(46.43%)高于α-螺旋(29.02%)。AhMTP蛋白的3D结构预测是在密集模式下使用Phyre2服务器生成的,基于与模型匹配覆盖度以及置信百分数最高的比对结果进行预测分析。千穗谷MTP家族9个成员均可以匹配到匹配度高于30%的蛋白模型(附图2
2 ),AhMTP1、AhMTP6、AhMTP8以c6xpd8(锌转运体8)为参考模型,重叠覆盖度分别为33%、43%、73%;AhMTP2、AhMTP3、AhMTP 4、AhMTP 5、AhMTP7以c3jlzp(阳离子转运蛋白)为参考模型,重叠覆盖度分别为78%、63%、71%、70%、97%;AhMTP9以c2qfiB(二价铁转运体)为模型参考,重叠覆盖度为71%。其中,AhMTP1和AhMTP6匹配程度较低,但也在30%以上。2.5 千穗谷MTP基因染色体定位及共线性分析
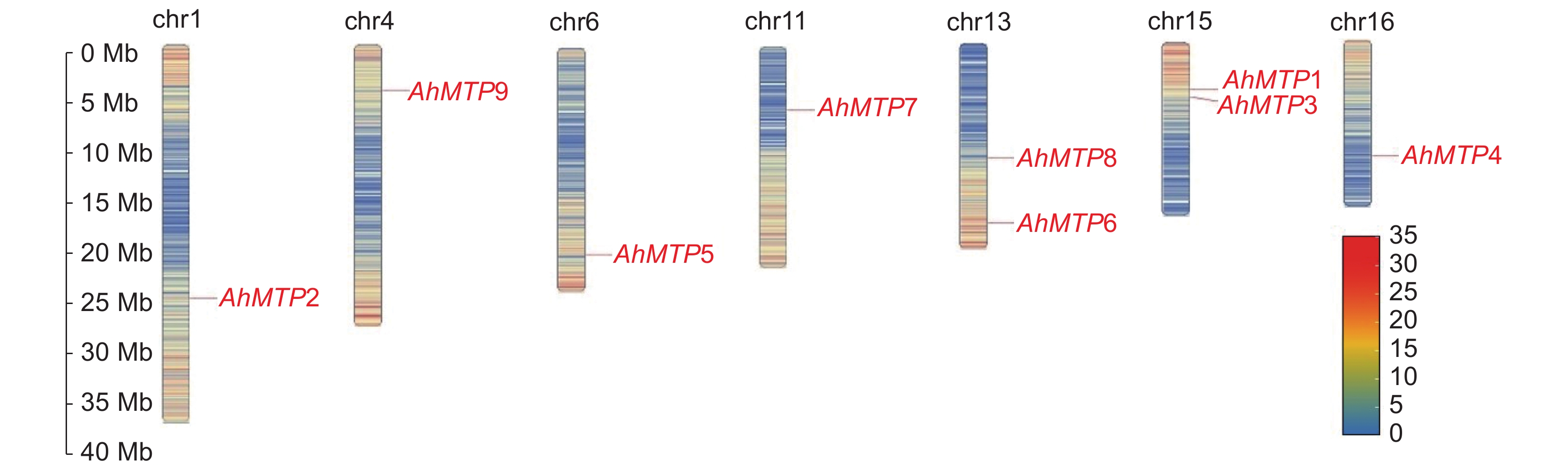
对千穗谷MTP基因家族成员进行染色体定位分析,结果表明,9个家族成员分别定位在chr1、chr4、chr6、chr11、chr13、chr15、chr16这7条染色体上,其中AhMTP6和AhMTP8定位在chr13染色体上,AhMTP1和AhMTP3定位在chr15上,其他染色体上均只有1个家族成员(图3)。
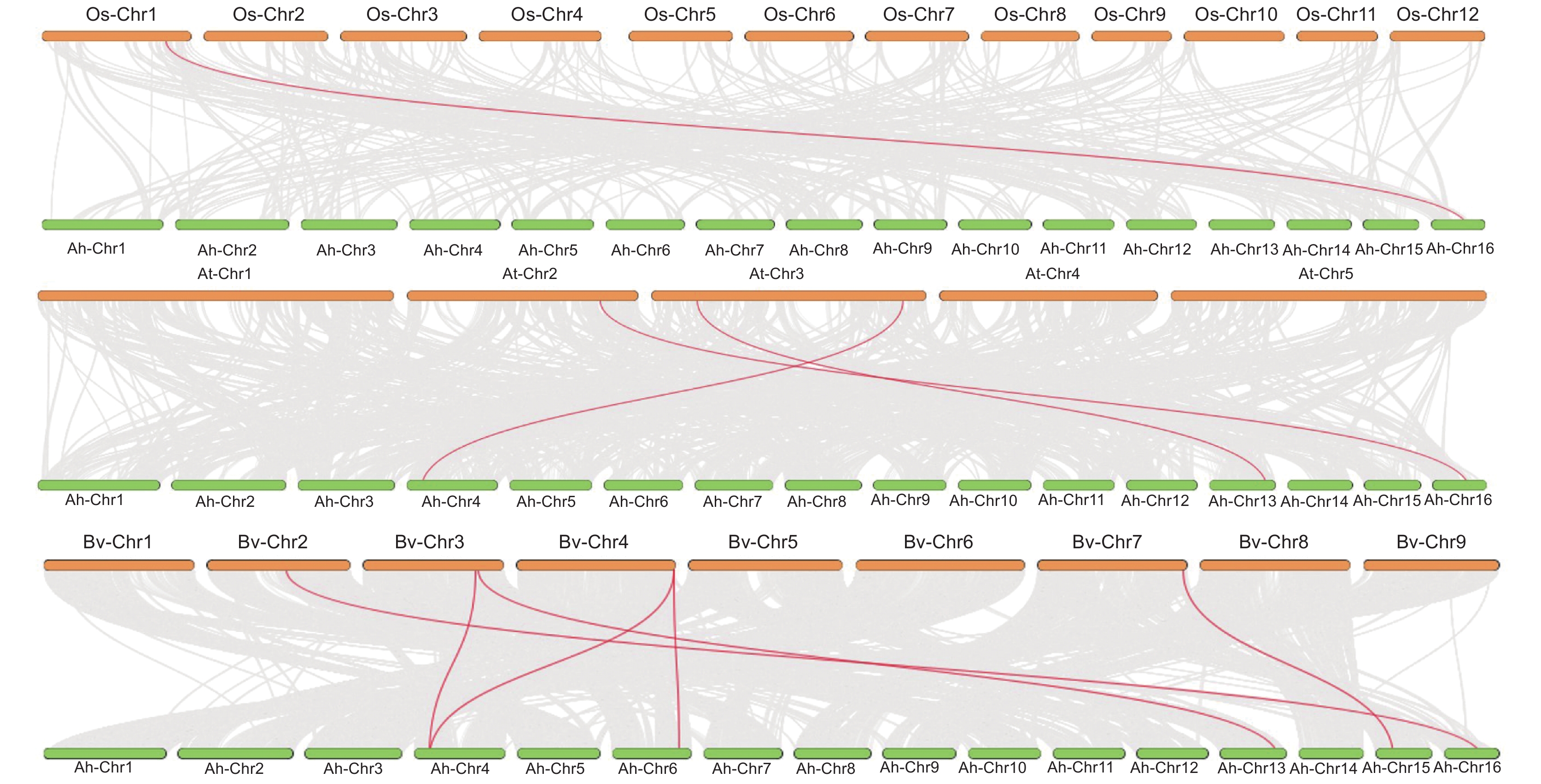
共线性分析结果显示,千穗谷与水稻只有1个共线性对,与拟南芥有3个共线性对,而与甜菜则含有6个共线性对(图4),这可能是因为千穗谷与甜菜之间的亲缘关系更近。
2.6 启动子顺式作用元件预测
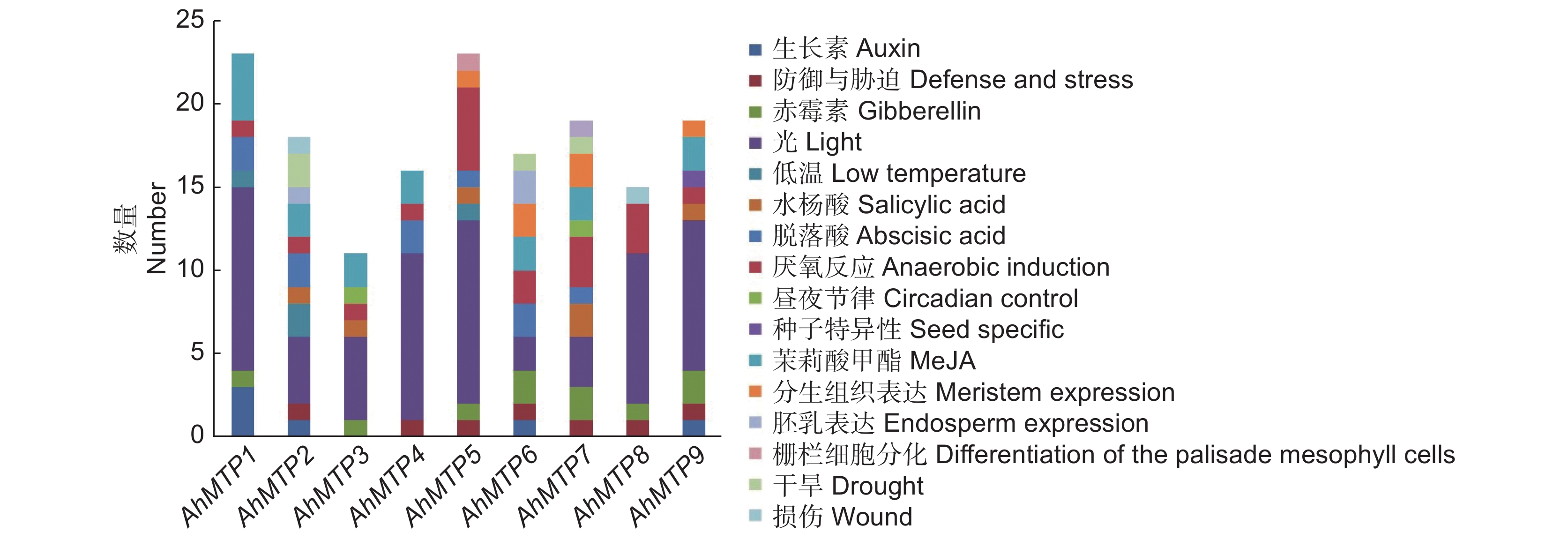
对千穗谷MTP基因起始密码子上游2000 bp的序列进行顺式作用元件预测,发现启动子序列包含多个调控生长发育和应激响应以及激素相关的顺式作用元件。其中,光响应元件和厌氧响应元件存在于每个AhMTP的启动子区;与赤霉素相关的作用元件除了没在AhMTP2和AhMTP4中发现外,在其他成员中均有发现,与茉莉酸甲酯相关的作用元件除在AhMTP5和AhMTP8中不存在外,其他成员均有发现;AhMTP1、AhMTP2、AhMTP5中存在响应低温胁迫的作用元件,而AhMTP2、AhMTP6、AhMTP7中存在响应干旱胁迫的元件(图5)。
2.7 组织特异性表达
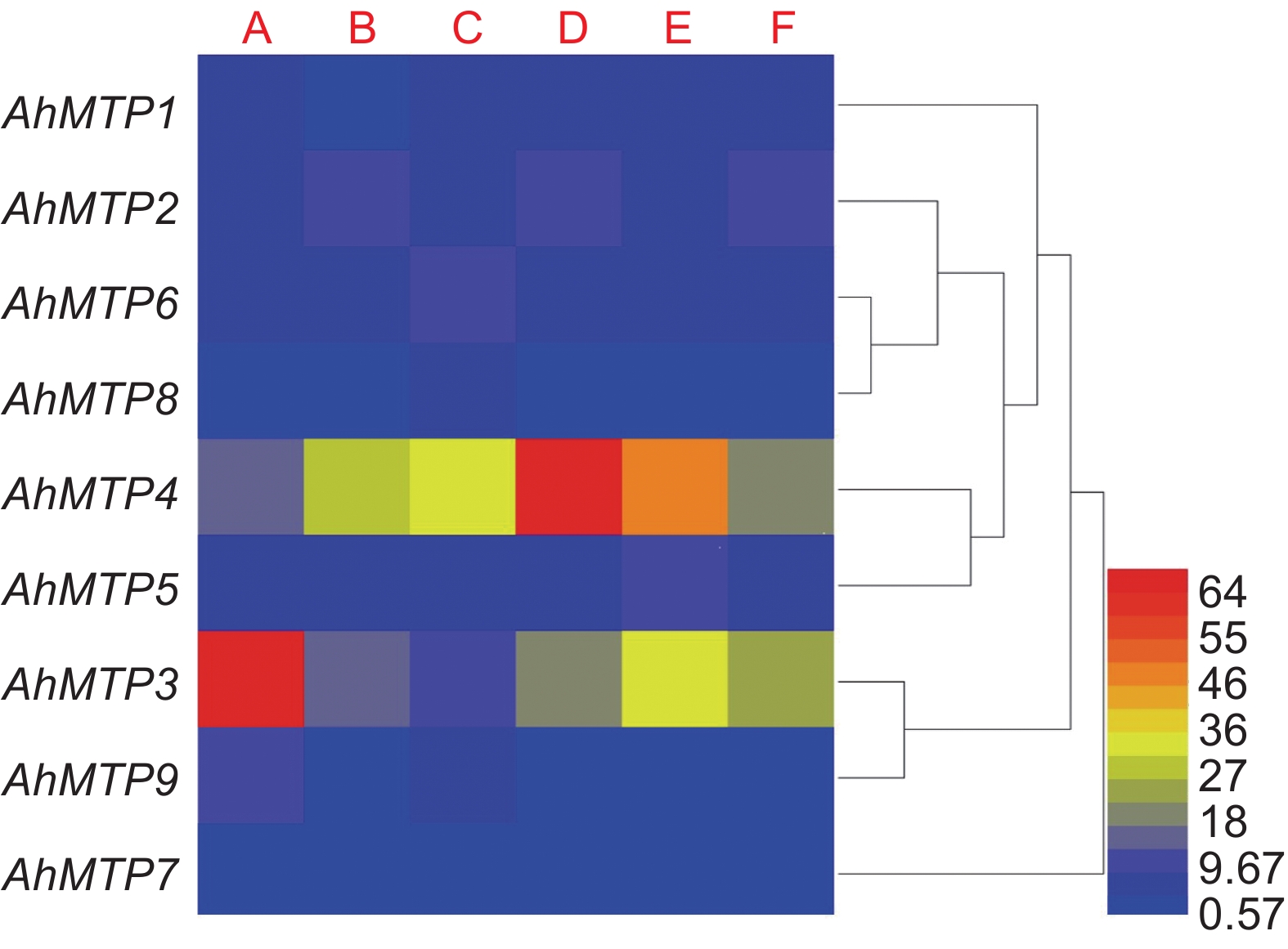
基于Phytozome v13数据库中的组织表达信息,将千穗谷MTP家族成员不同组织、不同时期的FPKM值进行了聚类分析。MTP家族9个成员在根、叶、花、未成熟种子和茎部均有表达。其中,AhMTP3和AhMTP4在不同组织中的表达量都较高,且不同组织间差异较大。AhMTP3在叶中的表达量最高,AhMTP4在未成熟种子中表达量最高。AhMTP1在根中表达量最低,在其他组织之间差异较小。AhMTP2在根、未成熟的种子、茎中表达量较高,在叶和花中较低。AhMTP3和AhMTP9的表达模式较为相似,均在叶中丰度最高。AhMTP6和AhMTP8的表达模式相似,均在花中表达量最高,这可能是由于二者都属于Zn-CDF亚族,亲缘关系较近。AhMTP7在各个组织间的表达量差异不明显(图6)。
2.8 千穗谷MTP基因的miRNA预测
为深入了解潜在的miRNA对千穗谷MTP基因的转录调控,以AhMTP基因的转录本为靶序列,预测能够相互作用的miRNA。结果发现,AhMTP1被ath-miR2937切割抑制;ath-miR5658分别切割抑制和翻译抑制靶向AhMTP2,同时还靶向AhMTP3;ath-miR398b/c-5p同样切割抑制靶向AhMTP2,此外,ath-miR773b-3p和ath-miR8179也靶向AhMTP2。AhMTP3除ath-miR5658外,还是ath-miR826b的切割抑制靶向基因。AhMTP4分别是ath-miR413和ath-miR844-3p的切割靶向基因。AhMTP5分别是ath-miR4240和ath-miR8182的切割抑制靶向基因。AhMTP7受ath-miR5663-5p切割抑制调控;而AhMTP8是ath-miR856的切割抑制靶向调控基因(附表2
3 )。2.9 千穗谷MTP基因响应镉胁迫的表达分析
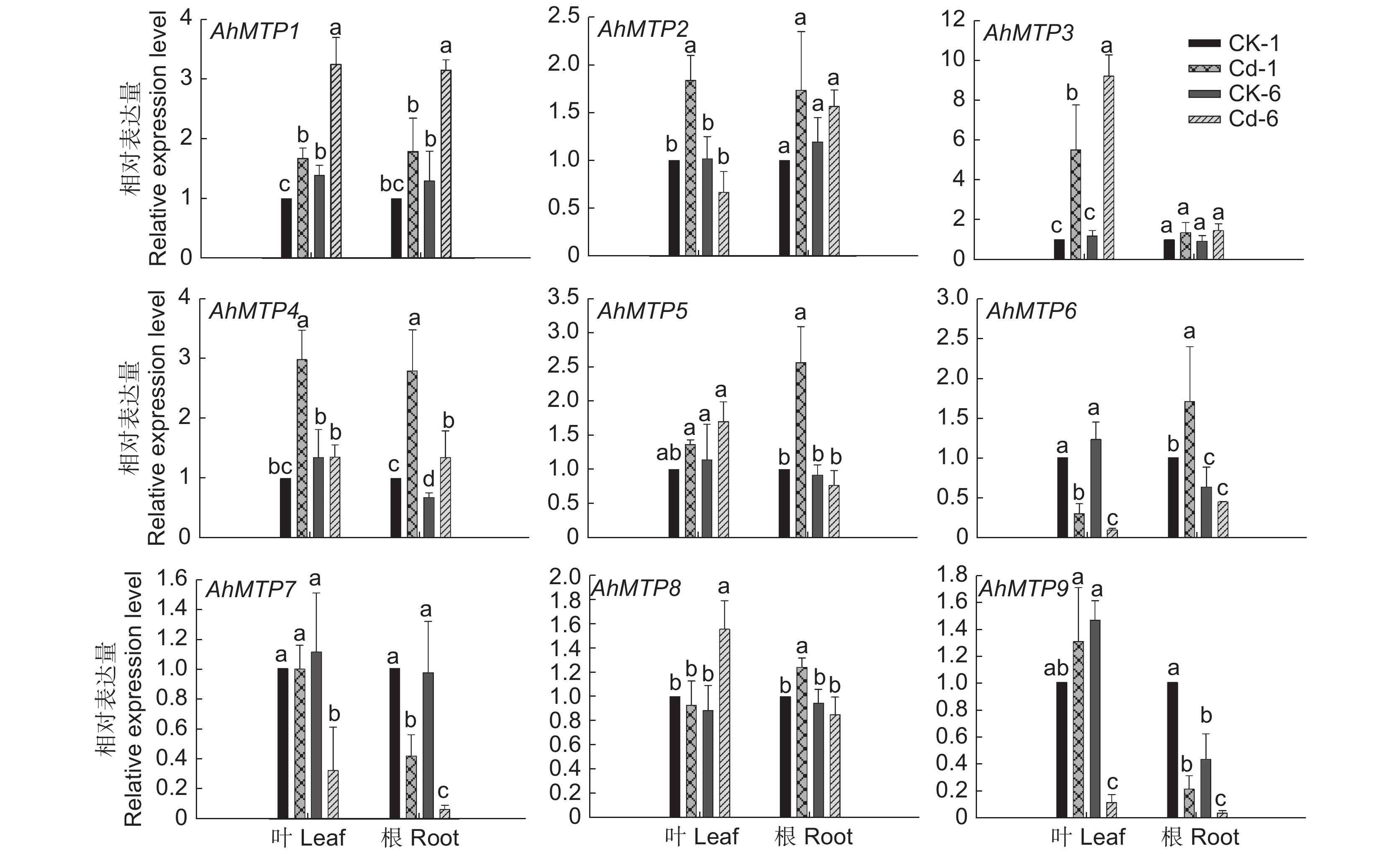
为了解MTP在千穗谷对镉离子吸收转运中的作用,本研究分析了镉处理条件下根和叶中所有AhMTP基因的表达模式。结果显示,镉处理后,叶中AhMTP1、AhMTP3、AhMTP8的表达量显著升高,AhMTP6、AhMTP7、AhMTP9的表达量显著下降,而AhMTP2和AhMTP4先上调,后在6 h恢复到对照水平。根中AhMTP1、AhMTP4的表达水平显著升高,AhMTP7、AhMTP9的表达水平显著降低,而AhMTP5、AhMTP6、AhMTP8的表达先上调后恢复至对照水平。综合分析发现,镉处理条件下,AhMTP1、AhMTP2和AhMTP4在根与叶中均受到诱导表达,AhMTP7、AhMTP9在根与叶中的表达则被抑制。AhMTP2、AhMTP3对镉胁迫的响应只体现在叶中,在根中无显著变化,而AhMTP5对镉胁迫的响应只体现在根中,在叶中无变化(图7)。
![]() 图 7 镉胁迫下千穗谷MTP基因在根系和叶片中的表达水平CK-1:对照1 h;Cd-1:镉处理1 h;CK-6:对照6 h;Cd-6:镉处理6 h。不同小写字母代表不同处理之间差异显著(P < 0.05)。Figure 7. MTP gene expression levels in roots and leaves of Amaranthus hypochondriacus under Cd stressCK-1: Control for 1 h; Cd-1: Cadmium treatment for 1 h; CK-6: Control for 6 h; Cd-6: Cadmium treatment for 6 h. Different lowercase letters indicate significant differences between treatments (P < 0.05).
图 7 镉胁迫下千穗谷MTP基因在根系和叶片中的表达水平CK-1:对照1 h;Cd-1:镉处理1 h;CK-6:对照6 h;Cd-6:镉处理6 h。不同小写字母代表不同处理之间差异显著(P < 0.05)。Figure 7. MTP gene expression levels in roots and leaves of Amaranthus hypochondriacus under Cd stressCK-1: Control for 1 h; Cd-1: Cadmium treatment for 1 h; CK-6: Control for 6 h; Cd-6: Cadmium treatment for 6 h. Different lowercase letters indicate significant differences between treatments (P < 0.05).3. 讨论
本研究以千穗谷基因组为参考,共鉴定出9个MTP家族成员,和拟南芥(12)、水稻(10)、甜橙(12)[7]、葡萄(Vitis vinifera L.)(11)[23]、茶(13)[16]、海刀豆(Canavalia rosea (Sw.) DC.)(12)[24]以及蒺藜苜蓿(12)[9]成员数相近,但在其他物种中,如油菜(Brassica napus L.)(33)[25]、烟草(26)[26, 27]和小麦(20)[6, 28]中,MTP家族成员数较多,这可能是由于这些物种多倍体基因组的复杂性所导致。植物MTP家族一般包含Zn-CDF、Zn/Fe-CDF、Mn-CDF3个亚族,根据不同植物MTP蛋白序列的相似性和进化关系,又可将Zn-CDF分为1、5、12等3个组,Zn/Fe-CDF分为6和7两个组,Mn-CDF分为8和9两个组[4]。本研究鉴定的9个千穗谷MTP基因的序列长度、编码氨基酸数量、理论等电点以及分子量之间的差异均较大。系统进化树显示,它们均匀分布在7个组中,除组8和组9各包含两个成员外,其他组均只含1个成员,说明千穗谷的不同MTP成员在进化上关系较远,有可能具有不同的功能和调控机制。AhMTP蛋白大多数被预测定位于液泡,表明它们可能在液泡中发挥转运阳离子的作用,AhMTP2和AhMTP6同时定位于液泡和细胞膜上,可能负责细胞间转运金属离子的重要作用,二者均属于Zn-CDF亚族。
根据前人的研究,所有MTP成员均包含1个典型的C端Cation_efflux结构域和数量不等的跨膜结构域[29]。本研究也表明所有AhMTP蛋白均包含Cation_efflux结构。此外,AhMTP1/4/5/7/9均包含一个金属离子转运二聚体ZT_dimer,可形成MTPs的同源二聚体或异源二聚体。所有AhMTP均含有多个跨膜结构域,其中AhMTP2的跨膜结构域最多,达14个。AhMTP2也是唯一没有内含子的家族成员,其编码区最长(2493 bp),分子量也最大(93971.60 Da),这与同为Zn-CDF亚组的拟南芥MTP蛋白AtMTP12相似[4]。
基因结构分析结果表明,千穗谷MTP不同成员的内含子数量在0~12个,Zn-CDF亚族成员中,除AhMTP6包含9个内含子外,其余成员均在0~2个,组1成员AhMTP8包含2个内含子,组12成员AhMTP2则无内含子。Mn-CDF亚族成内含子数量在3~6个。Zn/Fe-CDF成员包含的内含子数量最多,如AhMTP1有7个,AhMTP3有12个。这与毛果杨中MTP成员内含子的分布相似[8],毛果杨Zn-CDF亚族中除组5成员有9个内含子外,其余组的均在0~1个;Mn-CDF成员的内含子数在3~6个;Zn/Fe-CDF也同样包含最多的内含子,为10~12个。此外,黄瓜MTP的内含子数在1~12个[10],Zn-CDF亚族中除组5成员含有9个内含子外,其他成员只有1个;Mn-CDF成员内含子数量为5~6个,而Zn/Fe-CDF成员的内含子最多,为11~12个。以上结果表明,按照亚族来分,Zn-CDF内含子数量最少(组5除外),Mn-CDF次之,而Zn/Fe-CDF成员的内含子数量最多。
蛋白结构分析是研究其功能的基础,千穗谷MTP蛋白质的二级结构主要有α-螺旋、无规则卷曲以及部分延伸链。前人研究表明,所有MdMTP蛋白质均包含1个CED结构,其作用是促进阳离子外流[30]。3D预测结果表明,所有AhMTP中的CED都被折叠成多个跨膜结构域(TMD)形成紧密的螺旋束, Zn- MTP和Zn/Fe-MTP子家族成员中含有1或2个保守的HXXXD (X = 任意氨基酸,H = 组氨酸,D = 天冬氨酸)残基,Mn-MTP亚组成员则包含两个保守的DXXXD残基。
分析不同物种间的共线基因对可能有助于基因家族的进化研究,本文对千穗谷与模式作物水稻、拟南芥和甜菜的MTP基因进行同源性分析,结果发现,甜菜中AhMTPs的同源基因对高于拟南芥和水稻,表明甜菜与千穗谷的协同性更高。Ah-Chr4、Ah-Chr13 和Ah-Chr16在拟南芥与甜菜中均存在共线性对,Ah-Chr16在水稻、拟南芥与甜菜中都具有共线性对,表明这些同源基因在进化过程中的保守性较强。
启动子顺式作用元件分析可以帮助我们预测基因在植物不同生长发育阶段、对外界环境和各种生物以及非生物胁迫反应中的作用。G-box、MRE、Box4和ACE等元件在植物光信号转导中发挥重要作用[31],在对千穗谷9个MTP成员的启动子序列分析中,与光反应有关的顺式元件最多,且在每个AhMTP成员中均有发现,暗示千穗谷MTP基因的表达可能受光的调节。AhMTP基因启动子中数量较多的元件还包括与厌氧反应有关的ARE,以及与抵御胁迫相关的TC-rich repeats,显示这些基因可能参与了千穗谷对外界环境胁迫的反应。此外,大部分AhMTPs基因启动子区都包含激素响应元件,如与赤霉素相关的TATC-box、与生长素相关的TGA-element和AuxRR-core、与水杨酸相关的ACA-element,以及响应茉莉酸甲酯的顺式元件CGTCA-motif和TGACG-motif等。其中,AhMTP8只包含TATC-box,暗示其可能只受赤霉素的调控,对其他激素无响应,而AhMTP9包含以上所有激素相关的顺式元件,说明该基因可能受多种激素的调控。千穗谷MTP基因启动子顺式作用元件的多样性表明,千穗谷MTP功能可能也存在多样性。
千穗谷MTP启动子中与生长发育相关的顺式元件主要包括与胚乳表达相关的GCN4-motif,存在于AhMTP2和AhMTP6中。苦荞麦(Fagopyrum tataricum (L.) Gaertn.)FtMTP3.2和FtMTP8.1中也存在该元件[32],暗示某些MTP基因可能在胚乳中特异性表达。与分生组织表达相关的CAT-box在AhMTP5/6/7/9中均有发现。前人研究中,苦荞麦的FtMTP5/6/7.2/8.1/12基因启动子也包含该元件[30],暗示这些基因可能在茎尖、根尖等分生组织高表达。此外,AhMTP5启动子区域存在栅栏状叶肉细胞分化相关的HD-zip1元件,AhMTP9中存在与种子特异性相关的RY-element元件,暗示MTP基因的表达可能存在一定的组织特异性。
进化关系较近的蛋白通常具有相似的功能。本研究分析了千穗谷和拟南芥MTP家族的进化关系,发现了多个同源基因对。如,千穗谷的AhMTP5和AhMTP9与拟南芥的AtMTP8蛋白同属MTP家族的第8组,前人研究结果显示AtMTP8定位于液泡[14],本研究发现AhMTP5和AhMTP9也定位在液泡,可能与拟南芥AtMTP8具有类似的功能。前人研究显示,拟南芥AtMTP8基因与锰离子和铁离子的转运有关,而本研究发现,AhMTP5和AhMTP9基因的表达受Cd的抑制,可能参与Cd的转运和吸收,暗示同一分支的同源蛋白功能之间存在分化。已经证实,Zn-CDF亚族组1的多个基因均与Cd的吸收转运有关,如AtMTP1[33]、AtMTP3[34]和OsMTP1[12, 35, 36]均能够显著提高转基因酵母细胞对Cd2 + 的耐受性。系统进化树显示,AhMTP8属于Zn-CDF亚族的组1,镉胁迫实验也表明,其表达受到了Cd2 + 胁迫的诱导,说明AhMTP8很可能参与了千穗谷对Cd的响应。
miRNA可通过抑制靶基因的表达,参与植物生长发育以及胁迫响应的不同生理反应。miR398响应多种金属胁迫,可靶向铜/锌超氧化物歧化酶(CSD)[37, 38]。如在拟南芥[39]、烟草[40]和水稻[41]中均发现miR398响应Cu、Fe和Mn的胁迫。此外,miR398在蒺藜苜蓿叶片中也响应Cd和Hg胁迫[42]。在本研究中,我们发现,miR398b和miR398c均靶向AhMTP2,且后者在叶中同样响应Cd胁迫。
4. 结论
千穗谷MTP家族的9个成员可分为Zn-CDF、Mn-CDF和Zn/Fe-CDF 3个亚族。不同亚家族基因成员的内含子数目较为相近。9个AhMTPs定位在7条不同的染色体上;千穗谷与甜菜的共线性对最多,为6对。千穗谷MTP启动子区域包含多个与生长发育和应激响应及激素相关的元件。表达分析表明,AhMTP3和AhMTP4在不同组织间的表达量差异最为显著。miRNA预测显示共有7个AhMTPs含有潜在的miRNA靶位点。AhMTP2、AhMTP3只在叶中响应镉胁迫,而AhMTP5只在根中响应;镉胁迫下,除AhMTP6在叶和根中的表达趋势相反,其余成员在不同部位的表达趋势均一致。
1 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。2 1,2)如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。3 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 千穗谷、拟南芥和甜菜的MTP基因家族系统发育树
不同颜色字体代表不同物种。黄色:拟南芥;白色:甜菜;黑色:千穗谷。不同颜色分支代表不同组,红色代表组1,绿色代表组5,黑色代表组6,亮蓝色代表组7,黄色代表组8,紫色代表组9,深蓝色代表组12。
Figure 1. Phylogenetic tree of Amaranthus hypochondriacus, Arabidopsis thaliana, and Beta vulgaris
Different color fonts represent different species. Yellow for Arabidopsis thaliana, white for Beta vulgaris, and black for Amaranthus hypochondriacus; Different color branches represent different groups, red for group 1, green for group 5, black for group 6, bright blue for group 7, yellow for group 8, purple for group 9, and dark blue for group 12.
图 7 镉胁迫下千穗谷MTP基因在根系和叶片中的表达水平
CK-1:对照1 h;Cd-1:镉处理1 h;CK-6:对照6 h;Cd-6:镉处理6 h。不同小写字母代表不同处理之间差异显著(P < 0.05)。
Figure 7. MTP gene expression levels in roots and leaves of Amaranthus hypochondriacus under Cd stress
CK-1: Control for 1 h; Cd-1: Cadmium treatment for 1 h; CK-6: Control for 6 h; Cd-6: Cadmium treatment for 6 h. Different lowercase letters indicate significant differences between treatments (P < 0.05).
表 1 千穗谷MTP家族成员基本信息
Table 1 Basic information of MTP family members in Amaranthus hypochondriacus
基因
Gene登录号
Accession number蛋白长度
Protein length / aa基因长度
Gene length / bp分子量
Molecular weight / Da等电点
Isoelectric point亚细胞定位
LocalizationAhMTP1 AH022184 376 8344 41127.39 8.75 液泡 AhMTP2 AH001412 830 2493 93971.60 6.94 细胞膜/液泡 AhMTP3 AH022259 451 12747 49774.67 7.80 液泡 AhMTP4 AH023492 396 6491 44899.19 4.87 液泡 AhMTP5 AH010891 417 5541 47165.96 5.67 液泡 AhMTP6 AH020319 224 6107 25139.53 9.54 细胞膜/液泡 AhMTP7 AH016853 205 2747 23800.73 6.83 液泡 AhMTP8 AH019735 155 4707 16885.61 5.78 液泡 AhMTP9 AH006882 279 4895 31121.67 4.81 液泡 -
[1] Ghori NH,Ghori T,Hayat MQ,Imadi SR,Gul A,et al. Heavy metal stress and responses in plants[J]. Int J Environ Sci Technol,2019,16 (3):1807−1828. doi: 10.1007/s13762-019-02215-8
[2] 金枫,王翠,林海建,沈亚欧,张志明,等. 植物重金属转运蛋白研究进展[J]. 应用生态学报,2010,21(7):1875−1882. Jin F,Wang C,Lin HJ,Shen YO,Zhang ZM,et al. Heavy metal-transport proteins in plants:a review[J]. Chinese Journal of Applied Ecology,2010,21 (7):1875−1882.
[3] Fan W,Liu CY,Cao BN,Qin ML,Long DP,et al. Genome-wide identification and characterization of four gene families putatively involved in cadmium uptake,translocation and sequestration in mulberry[J]. Front Plant Sci,2018,9:879. doi: 10.3389/fpls.2018.00879
[4] Gustin JL,Zanis MJ,Salt DE. Structure and evolution of the plant cation diffusion facilitator family of ion transporters[J]. BMC Evol Biol,2011,11 (1):76. doi: 10.1186/1471-2148-11-76
[5] Ram H,Kaur A,Gandass N,Singh S,Deshmukh R,et al. Molecular characterization and expression dynamics of MTP genes under various spatio-temporal stages and metal stress conditions in rice[J]. PLoS One,2019,14 (5):e0217360. doi: 10.1371/journal.pone.0217360
[6] Vatansever R,Filiz E,Eroglu S. Genome-wide exploration of metal tolerance protein (MTP) genes in common wheat (Triticum aestivum):insights into metal homeostasis and biofortification[J]. BioMetals,2017,30 (2):217−235. doi: 10.1007/s10534-017-9997-x
[7] Fu XZ,Tong YH,Zhou X,Ling LL,Chun CP,et al. Genome-wide identification of sweet orange (Citrus sinensis) metal tolerance proteins and analysis of their expression patterns under zinc,manganese,copper,and cadmium toxicity[J]. Gene,2017,629:1−8. doi: 10.1016/j.gene.2017.07.072
[8] Gao YF,Yang FM,Liu JK,Xie W,Zhang L,et al. Genome-wide identification of metal tolerance protein genes in Populus trichocarpa and their roles in response to various heavy metal stresses[J]. Int J Mol Sci,2020,21 (5):1680. doi: 10.3390/ijms21051680
[9] El-Sappah AH,Elbaiomy RG,Elrys AS,Wang Y,Zhu YM,et al. Genome-wide identification and expression analysis of metal tolerance protein gene family in Medicago truncatula under a broad range of heavy metal stress[J]. Front Genet,2021,12:713224. doi: 10.3389/fgene.2021.713224
[10] 朱雄萌,蒋昕晨,席克勇,杨静,尹军良,朱永兴. 黄瓜MTP基因家族分析及重金属胁迫下表达特征[J]. 西北植物学报,2021,41(6):933−943. Zhu XM,Jiang XC,Xi KY,Yang J,Yin JL,Zhu YX. Analysis of MTP gene family and expression characteristics under heavy metal stress in cucumber[J]. Acta Botanica Boreali-Occidentalia Sinica,2021,41 (6):933−943.
[11] Montanini B,Blaudez D,Jeandroz S,Sanders D,Chalot M. Phylogenetic and functional analysis of the cation diffusion facilitator (CDF) family:Improved signature and prediction of substrate specificity[J]. BMC Genomics,2007,8 (1):107. doi: 10.1186/1471-2164-8-107
[12] Menguer PK,Farthing E,Peaston KA,Ricachenevsky FK,Fett JP,Williams LE. Functional analysis of the rice vacuolar zinc transporter OsMTP1[J]. J Exp Bot,2013,64 (10):2871−2883. doi: 10.1093/jxb/ert136
[13] Fujiwara T,Kawachi M,Sato Y,Mori H,Kutsuna N,et al. A high molecular mass zinc transporter MTP12 forms a functional heteromeric complex with MTP5 in the Golgi in Arabidopsis thaliana[J]. FEBS J,2015,282 (10):1965−1979. doi: 10.1111/febs.13252
[14] Eroglu S,Meier B,von Wirén N,Peiter E. The vacuolar manganese transporter MTP8 determines tolerance to iron deficiency-induced chlorosis in Arabidopsis[J]. Plant Physiol,2016,170 (2):1030−1045. doi: 10.1104/pp.15.01194
[15] Chen ZH,Fujii Y,Yamaji N,Masuda S,Takemoto Y,et al. Mn tolerance in rice is mediated by MTP8.1,a member of the cation diffusion facilitator family[J]. J Exp Bot,2013,64 (14):4375−4387. doi: 10.1093/jxb/ert243
[16] Zhang XY,Li QH,Xu WL,Zhao H,Guo F,et al. Identification of MTP gene family in tea plant (Camellia sinensis L. ) and characterization of CsMTP8.2 in manganese toxicity[J]. Ecotoxicol Environ Saf,2020,202:110904. doi: 10.1016/j.ecoenv.2020.110904
[17] Migocka M,Papierniak A,Maciaszczyk-Dziubińska E,Poździk P,Posyniak E,et al. Retracted:Cucumber metal transport protein MTP8 confers increased tolerance to manganese when expressed in yeast and Arabidopsis thaliana[J]. J Exp Bot,2014,65 (18):5367−5384. doi: 10.1093/jxb/eru295
[18] 吴平治,陈键,栾升,李东屏. 拟南芥CDF家族基因AtMTP6编码一个锌离子转运蛋白[J]. 生命科学研究,2006,10(3):244−247. Wu PZ,Chen J,Luan S,Li DP. A cation diffusion facilitator (CDF) gene AtMTP6 encodes a zinc transporter in Arabidopsis[J]. Life Science Research,2006,10 (3):244−247.
[19] 张丹丹,程金芝. 籽粒苋在食品工业中的研究进展及前景[J]. 科技与创新,2016(23):31. doi: 10.15913/j.cnki.kjycx.2016.23.031 [20] 周涛,彭辉,喻望晨,刘宁芳,胡龙兴,徐倩. 千穗谷TCP基因家族生物信息学分析[J]. 草地学报,2022,30(4):867−878. Zhou T,Peng H,Yu WC,Liu NF,Hu LX,Xu Q. Bioinformatics analysis of TCP gene family in Amaranthus hypochondriacus[J]. Acta Agrestia Sinica,2022,30 (4):867−878.
[21] Yuan M,He HD,Xiao L,Zhong T,Liu H,et al. Enhancement of Cd phytoextraction by two Amaranthus species with endophytic Rahnella sp. JN27[J]. Chemosphere,2014,103:99−104. doi: 10.1016/j.chemosphere.2013.11.040
[22] Chen CJ,Chen H,Zhang Y,Thomas HR,Frank MH,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Mol Plant,2020,13 (8):1194−1202. doi: 10.1016/j.molp.2020.06.009
[23] Shirazi Z,Abedi A,Kordrostami M,Burritt DJ,Hossain MA. Genome-wide identification and characterization of the metal tolerance protein (MTP) family in grape (Vitis vinifera L. )[J]. 3 Biotech,2019,9 (5):199. doi: 10.1007/s13205-019-1728-2
[24] Zou T,Lin RY,Pu L,Mei QM,Wang ZF,et al. Genome-wide identification,structure characterization,expression pattern profiling,and substrate specificity of the metal tolerance protein family in Canavalia rosea (Sw.) DC[J]. Plants,2021,10 (7):1340. doi: 10.3390/plants10071340
[25] Xie T,Yang WJ,Chen X,Rong H,Wang YP,Jiang JJ. Genome-wide identification and expressional profiling of the Metal Tolerance Protein gene family in Brassica napus[J]. Genes,2022,13 (5):761. doi: 10.3390/genes13050761
[26] Liu JK,Gao YF,Tang YL,Wang D,Chen XM,et al. Genome-wide identification,comprehensive gene feature,evolution,and expression analysis of plant metal tolerance proteins in tobacco under heavy metal toxicity[J]. Front Genet,2019,10:345. doi: 10.3389/fgene.2019.00345
[27] Papierniak-Wygladala A,Kozak K,Barabasz A,Palusińska M,Całka M,et al. Identification and characterization of a tobacco metal tolerance protein,NtMTP2[J]. Metallomics,2020,12 (12):2049−2064. doi: 10.1039/d0mt00210k
[28] 杨蕾,卢晨,朱永兴,尹军良,方正武,马东方. 小麦MTP基因家族分析及其在胁迫下的作用[J]. 西北植物学报,2020,40(7):1123−1134. Yang L,Lu C,Zhu YX,Yin JL,Fang ZW,Ma DF. Bioinformatic analysis of wheat metal tolerance protein (MTP) gene family and its role under stress[J]. Acta Botanica Boreali-Occidentalia Sinica,2020,40 (7):1123−1134.
[29] Kolaj-Robin O,Russell D,Hayes KA,Pembroke JT,Soulimane T. Cation diffusion facilitator family:structure and function[J]. FEBS Lett,2015,589 (12):1283−1295. doi: 10.1016/j.febslet.2015.04.007
[30] Qi DZ,Wang LM,Liang MX,Zhang Q,Tang XL,et al. Genome-wide analyses of metal tolerance protein genes in apple (Malus domestica):Identification,characterization,expression and response to various metal ion stresses[J]. Environ Exp Bot,2022,201:104948. doi: 10.1016/j.envexpbot.2022.104948
[31] Lin M,Yan JW,Ali MM,Wang SJ,Tian SN,et al. Isolation and functional characterization of a green-tissue promoter in japonica rice (Oryza sativa subsp. Japonica)[J]. Biology,2022,11 (8):1092. doi: 10.3390/biology11081092
[32] Li ZQ,Wang CL,Wang KY,Zhao JY,Shao JR,et al. Metal tolerance protein encoding gene family in Fagopyrum tartaricum:genome-wide identification,characterization and expression under multiple metal stresses[J]. Plants,2022,11 (7):850. doi: 10.3390/plants11070850
[33] Kobae Y,Uemura T,Sato MH,Ohnishi M,Mimura T,et al. Zinc transporter of Arabidopsis thaliana AtMTP1 is localized to vacuolar membranes and implicated in zinc homeostasis[J]. Plant Cell Physiol,2004,45 (12):1749−1758. doi: 10.1093/pcp/pci015
[34] Arrivault S,Senger T,Krämer U. The Arabidopsis metal tolerance protein AtMTP3 maintains metal homeostasis by mediating Zn exclusion from the shoot under Fe deficiency and Zn oversupply[J]. Plant J,2006,46 (5):861−879. doi: 10.1111/j.1365-313X.2006.02746.x
[35] Yuan LY,Yang SG,Liu BX,Zhang M,Wu KQ. Molecular characterization of a rice metal tolerance protein,OsMTP1[J]. Plant Cell Rep,2012,31 (1):67−79. doi: 10.1007/s00299-011-1140-9
[36] Das N,Bhattacharya S,Maiti MK. Enhanced cadmium accumulation and tolerance in transgenic tobacco overexpressing rice metal tolerance protein gene OsMTP1 is promising for phytoremediation[J]. Plant Physiol Biochem,2016,105:297−309. doi: 10.1016/j.plaphy.2016.04.049
[37] Jagadeeswaran G,Saini A,Sunkar R. Biotic and abiotic stress down-regulate miR398 expression in Arabidopsis[J]. Planta,2009,229 (4):1009−1014. doi: 10.1007/s00425-009-0889-3
[38] Dugas DV,Bartel B. Sucrose induction of Arabidopsis miR398 represses two Cu/Zn superoxide dismutases[J]. Plant Mol Biol,2008,67 (4):403−417. doi: 10.1007/s11103-008-9329-1
[39] Sunkar R,Kapoor A,Zhu JK. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J]. Plant Cell,2006,18 (8):2051−2065. doi: 10.1105/tpc.106.041673
[40] Burklew CE,Ashlock J,Winfrey WB,Zhang BH. Effects of aluminum oxide nanoparticles on the growth,development,and microRNA expression of tobacco (Nicotiana tabacum)[J]. PLoS One,2012,7 (5):e34783. doi: 10.1371/journal.pone.0034783
[41] Lima JC,Arenhart RA,Margis-Pinheiro M,Margis R. Aluminum triggers broad changes in microRNA expression in rice roots[J]. Genet Mol Res,2011,10 (4):2817−2832. doi: 10.4238/2011.November.10.4
[42] Zhou ZS,Huang SQ,Yang ZM. Bioinformatic identification and expression analysis of new microRNAs from Medicago truncatula[J]. Biochem Biophys Res Commun,2008,374 (3):538−542. doi: 10.1016/j.bbrc.2008.07.083
-
期刊类型引用(1)
1. 惠生娟,葛丽萍,王子瑜,张玉胜,苏云婷,孙岩,李润植. 续随子MYB基因家族的鉴定及ElMYB114在油脂合成中的功能分析. 植物科学学报. 2025(01): 92-101 .  本站查看
本站查看
其他类型引用(0)
-
其他相关附件
-
PDF格式
刘霄霏 附录 点击下载(439KB)
-



 下载:
下载: