Research progress in uptake and metabolism of foliar urea in plants
-
摘要:
叶面喷施尿素是农业生产中节肥增效和增产提质的措施之一。叶片吸收和利用尿素的过程受叶片特性、植株生长环境和体内碳氮代谢等因素影响。目前叶面肥的相关研究绝大部分仍集中在应用效果层面,而忽视了对作物叶片吸收利用尿素的过程及其调控机制的深入解析,限制了氮肥利用率和作物品质的进一步提高。本文从叶片的组织结构入手,系统综述了叶片喷施尿素后的吸收过程,涉及的关键基因和跨膜转运尿素的生理分子调控机制,以期为揭示叶面肥的高效吸收利用机理提供研究基础,并为实现节肥增效提质的农业绿色发展提供理论支撑。
Abstract:Foliar fertilization is a popular strategy used to reduce fertilizer input and improve nitrogen use efficiency, crop yield, and quality. The effectiveness of foliar application and the efficient assimilation of urea by leaves are influenced by various factors, including foliar structure, environmental conditions, and carbon-nitrogen metabolism. However, most existing studies have focused on the impacts of foliar fertilizer application, with a comprehensive understanding of the mechanisms and regulation of foliar nutrient absorption and utilization still lacking. This knowledge gap limits further improvement of nitrogen-use efficiency and crop quality. In this review, we present a systematic summary of recent advancements in leaf anatomy structure, physiological and molecular mechanisms governing urea uptake and transport, as well as the identification of key genes involved and underlying mechanisms and regulatory networks of foliar urea uptake and metabolism. This review should help inform further research, potentially guiding strategies to promote sustainable agriculture, reduce fertilizer input, and enhance efficiency and food quality.
-
Keywords:
- Leaf /
- Uptake /
- Nutrients transporter /
- Urea
-
氮素是植物生长发育需求量最大的营养元素。施用氮肥是农业生产中提高作物产量的重要手段。然而,近年来氮肥的不合理施用导致作物氮素利用率、产量与品质下降和土壤盐碱化等土壤污染问题[1]。为缓解作物生长后期根系衰老或低温、干旱等逆境胁迫导致的养分吸收能力持续减弱的困境,采用叶面肥喷施方式,尤其是水肥药一体化技术,具有省时省工、用量少、利用率高、显著改善作物产量和品质等优点[2]。迄今为止,尿素被认为是农业生产中效果最好的叶面喷施氮肥形态。叶面喷施后,被叶片吸收的尿素作为氮源从叶片表面经过渗透扩散、吸收或代谢过程进入叶肉细胞或负责运输的维管束组织后快速地运输到地上部的需氮器官[3]。目前大多数实验以根系尿素吸收代谢为研究对象,对叶片吸收尿素的机理知之甚少。本文综述了近年来国内外植物叶片尿素吸收、转运的分子机理和调控机制等方面的研究进展,以期为研究叶面养分吸收转运调控机理,进一步提高叶面肥养分吸收利用效率,实现提质增效的农业绿色发展提供理论基础。
1. 植物叶片吸收尿素的途径
叶片和根系的组织解剖结构存在较大差异。因而,与之相关的吸收养分过程也不尽相同[4]。养分离子仅需经过细胞壁,就可以跨膜进入根细胞。但叶表细胞外层往往被角质层覆盖,养分离子需要穿透蜡质层、角质层等类脂层和细胞壁后才能跨膜进入叶片表皮细胞。尿素被植物叶片吸收利用的过程包括叶表吸附、表皮渗透、吸收和暂存于叶片活性细胞的液泡,然后再被转移和吸收利用。
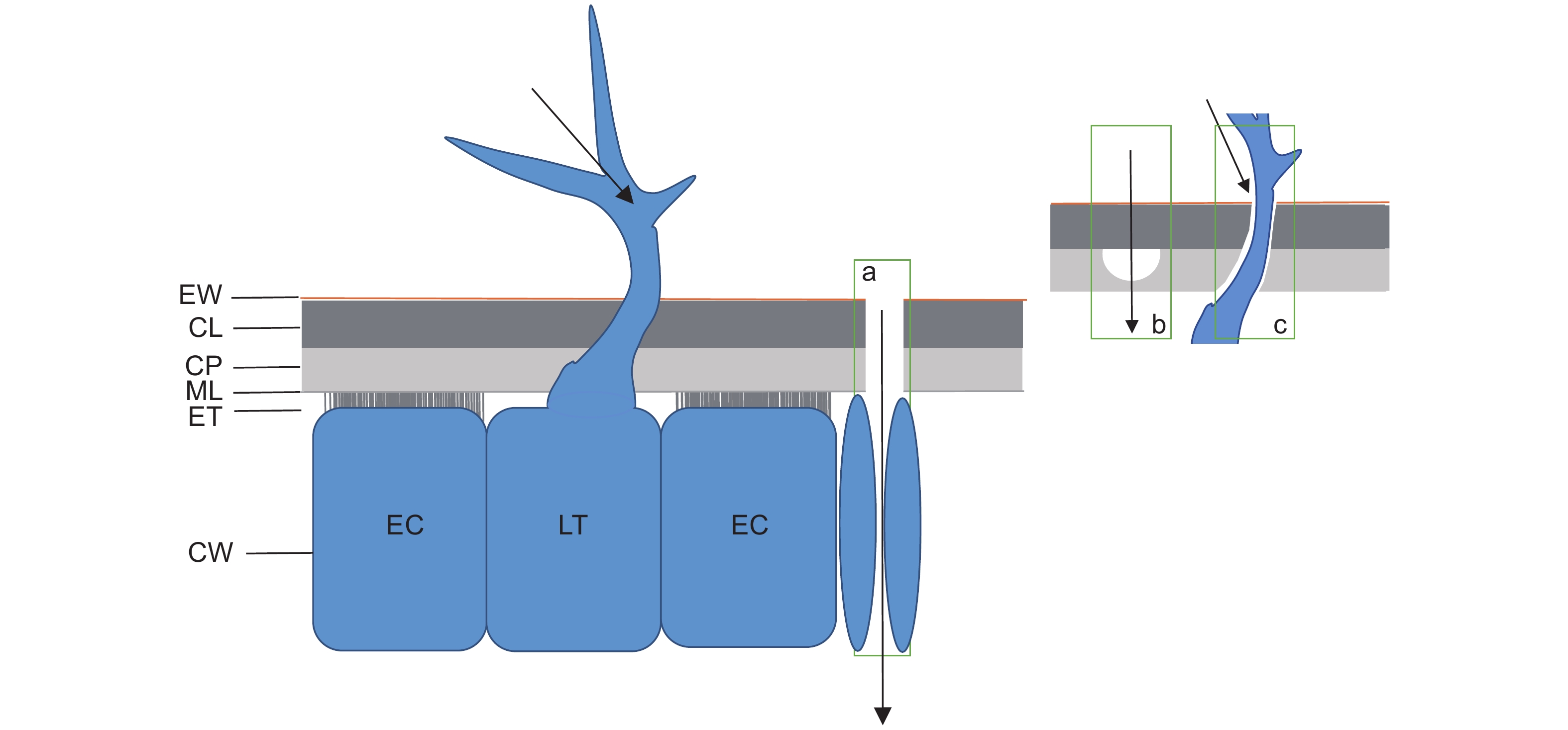
尿素一般通过3种途径从叶片表面进入叶肉细胞(图1)[5]:气孔、角质层的亲水小孔或外连丝以及叶片表面毛状体和叶片交接处的缝隙。叶表覆盖的蜡质及角质层会阻碍叶片对养分的吸收。溶液需要通过角质层孔隙或表皮细胞细胞壁中的外质连丝,才能扩散到细胞质膜,而相比之下气孔对养分的吸收可能更容易渗透[5]。溶液通过气孔渗透进入叶片受到光照条件、CO2浓度以及生长激素的限制。黑暗处理、CO2浓度低以及脱落酸又都会导致气孔关闭,降低气孔在叶面养分吸收过程中的效率[6]。由图1可以看出,养分通过毛状体进入细胞的过程是最便捷的。然而,上述3种渗透吸收途径叶面养分吸收过程中的贡献率仍然有待进一步研究。相对其他叶片表皮组织结构而言,叶脉对养分溶质更具有渗透性[5]。叶基在氮吸收、硝酸盐还原和尿素水解中发挥重要作用。研究结果显示,植物叶片从外界环境吸收的尿素在短时间里(24 h)部分尿素仍存在于叶基中[5]。
![]() 图 1 尿素进入叶片表皮细胞的途径示意图a:尿素通过角质层的亲水小孔进入叶表;b:尿素通过叶片表面腺毛和叶片交接处缝隙进入叶表;c:尿素通过气孔进入表皮细胞和细胞间隙。EW:外角质层;CP:真角质层;CL:角质层基层;ML:中间板层和果胶层;ET:外质连丝;CW:细胞壁;EC:表皮细胞;LT:毛状体。Figure 1. Schematic of urea pathway into leaf epidermal cellsa: Urea enters the leaf surface through hydrophilic pores in the cuticle; b: Urea enters the leaf surface through the gap between the leaf surface gland hairs and leaf junction; c: Urea enters the epidermal cells and intercellular spaces through the stomata. EW: Epicuticular waxes; CP: Cuticle proper; CL: Cuticular layer; ML: Middle lamellae and pectinaceous Layer; ET: Ectodesmata; CW: Cell wall; EC: Epidermal cells; LT: Leaf trichome.
图 1 尿素进入叶片表皮细胞的途径示意图a:尿素通过角质层的亲水小孔进入叶表;b:尿素通过叶片表面腺毛和叶片交接处缝隙进入叶表;c:尿素通过气孔进入表皮细胞和细胞间隙。EW:外角质层;CP:真角质层;CL:角质层基层;ML:中间板层和果胶层;ET:外质连丝;CW:细胞壁;EC:表皮细胞;LT:毛状体。Figure 1. Schematic of urea pathway into leaf epidermal cellsa: Urea enters the leaf surface through hydrophilic pores in the cuticle; b: Urea enters the leaf surface through the gap between the leaf surface gland hairs and leaf junction; c: Urea enters the epidermal cells and intercellular spaces through the stomata. EW: Epicuticular waxes; CP: Cuticle proper; CL: Cuticular layer; ML: Middle lamellae and pectinaceous Layer; ET: Ectodesmata; CW: Cell wall; EC: Epidermal cells; LT: Leaf trichome.1.1 角质层
外源尿素在进入叶表皮细胞的细胞壁之前要穿透蜡质层、角质层等类脂层。这意味着,在养分离子进入叶表皮纤维素为主要组分的细胞壁之前,需要首先在几乎没有孔隙的角质层中进行渗透扩散[5]。角质层有两种渗透途径:一种是亲水性途径,如矿质营养元素等亲水性物质可以通过此途径;另一种是亲脂性途径,如杀虫剂和除草剂等可以借助此途径进入植物体[7]。角质层化学成分、结构等直接影响尿素吸收运输能力[8]。角质层下方的果胶层、延伸到组织的中间层以及连接表皮细胞的特定的胞外连丝通道,这些提供一个靠近叶片表皮组织的小维管束的亲水途径(图1)。
尿素可以通过与亲水性化合物和亲脂性化合物相同的途径穿透角质层[5]。尿素通过扩散作用进入叶片的渗透能力是离子型肥料的十几倍[6],而且这种能力不依赖于浓度。叶片对尿素的扩散吸收取决于角质层的组成、厚度、润湿性和渗透性[9]。因此,尿素等小分子有机物和硝态氮或铵态氮等无机离子都受到这类脂质的调节。液滴与叶片表面相互作用,导致潜在的高或低接触角会影响叶面尿素吸收效率。叶面斥水性是用水滴在叶片表面的接触角来测量的,其接触角越大,斥水性越好[10],即不利于液滴停留在叶表面。叶表面的润湿性会通过影响露水、雾滴和降雨等滞留在叶片表面的水分和其滞留时间从而对叶片吸收水分和养分产生积极影响[11]。因此,吸湿性的肥料可能会进一步促进叶面养分的渗透[12]。研究结果表明,添加尿素会促进角质层中的离子扩散作用,进一步增强离子通过角质层的渗透能力。说明尿素可能引起了细胞膜上的一些化学变化[13],增加了某些离子的穿透率,从而提供了运输通道。
1.2 毛状体
叶面喷施尿素后,首先接触的是叶表面凸起的毛状体。它是一种源于表皮组织的特殊结构,通过生长、分化或细胞分裂继续发育,产生从表皮表面延伸出来的毛发状突出物[14]。例如,拟南芥(Arabidopsis thaliana (L.)Hegnh.)叶表皮细胞在经过核内遗传物质复制,逐渐膨大后向叶面外侧垂直伸长,形成杆状结构,细胞顶端发育形成3个分支;分支顶端分化逐渐变尖,形成乳突状[15]。毛状体被证明可以吸收和重新分配大量的养分离子[16]。毛状体对养分吸收的潜在贡献因物种及本身组织解剖结构和功能而不同[15,17],同一叶片上可同时出现不同类型(腺状、非腺状、鳞片状[17])的毛状体是原因之一。然而,在尿素吸收过程中,毛状体所扮演的角色至今尚不清楚。这意味着尿素可能通过毛状体结构直接穿透蜡质层甚至角质层进入表皮细胞。毛状体突变体的发现可能成为研究以上的问题的突破口[18]。
1.3 气孔
除以上所述之外,气孔也是叶片吸收尿素的关键途径。叶面施用的养分溶液只有在施加外部压力或在溶液中添加某些表面活性剂后才能通过气孔渗透进入[7],否则很难发生气孔的自发浸润。而通过气孔的过程实际上是溶液进入气孔室和细胞间隙等腔体,而不是进入细胞本身;这些腔体的细胞外壁也被内角质层覆盖,但是腔内的内角质层可能更薄,其阻碍作用较小[4],更容易穿透,也就是说与穿透角质层相比,溶质离子在气孔渗透途径中的渗透速度更快[5],甚至可能是某些物质进入叶片的唯一途径,例如纳米肥料[12]。叶片表面停留的液体由于植物蒸腾作用的发生,会通过保卫细胞扩散或角质层扩散进入叶片[5, 12]。但是,植物通常会调节气孔开放或闭合来调节水分运输[19]。气孔闭合时会导致尿素无法通过气孔进入植物体内,并且水分胁迫会造成角质层蜡的增加从而阻碍叶面氮素吸收[20]。尽管已有实验证实叶面施用的尿素通过气孔运动进入叶片[4],这种发生的机制和气孔对叶面尿素吸收的总体贡献尚不清楚,有待进一步研究。
2. 叶片中的尿素吸收转运系统
高等植物在长期适应环境的过程中进化出高亲和转运系统(High-affinity transporter system,HATS)和低亲和转运系统(Low-affinity transporter system,LATS)[21]。前者是主动耗能运输的系统,通过质子梯度提供能量,对能量代谢抑制剂很敏感,后者不需要依赖质子机制来转运尿素[22]。
2.1 高亲和力转运尿素机制及其在叶片氮吸收中的功能
DUR3(Degradation of urea 3)是目前高等植物中研究最清楚,也是迄今发现的唯一定位于质膜的高亲和尿素转运体[23],其同源基因几乎存在于所有能够进行光合作用的生物体中(表1)。在结构上,AtDUR3属于钠/溶质共转运的SSS家族(Sodium-solute symporter,SSS),但与该家族的所有成员相似性都很低(最高的仅约16%),与拟南芥的任何其他蛋白也都没有显著的同源性[24]。在拟南芥、玉米(Zea mays L.)和水稻(Oryza sativa L.)等高等植物中都成功克隆和鉴定了DUR3尿素转运体[24]。
表 1 植物叶片中尿素转运体Table 1. Urea transporters in leaves类型
Type基因
Gene登录号
Accession No.物种
Species拉丁名
Latin name位点
Site功能
Function文献
ReferenceDUR3 AtDUR3 At5g45380 拟南芥 Arabidopsis thaliana (L.) Heynh. 细胞质膜 H + -尿素共运输
高亲和性尿素跨质膜
吸收转运;[26] OsDUR3 Os10g0580400 水稻 Oryza sativa L. 细胞质膜 尿素运输;氮转移 [27] ZmDUR3 Zm00001e030875 玉米 Zea mays L. 细胞质膜 高亲和力尿素转运 [28] PyDUR3.1 AB359179 条斑紫菜 Porphyra yezoensis Ueda – 氮缺乏高度上调 [29] PyDUR3.2 AB359180 条斑紫菜 – 氮缺乏高度上调 [29] PyDUR3.3 AB931115 条斑紫菜 – 尿素转运 [30] PIP ZmPIP1.5 Zm00001d051872 玉米 Zea mays L. 质膜 尿素转运蛋白 [31] ZmPIP1.5b AJ271796 玉米 – 尿素转运蛋白 [31] NIP ZmNIP2.1 Zm00001d018037 玉米 质膜 尿素吸收与转运;
调节液泡中尿素[32] ZmNIP2.4 Zm00001d052261 玉米 质膜 尿素吸收与转运;
调节液泡中尿素[32] OsNIP2;1 Os02g0745100 水稻 Oryza sativa L. – 尿素转运蛋白 [33] CsNIP2;1 Csa017389 黄瓜 Cucumis sativus L. – 尿素的吸收和内部运输 [34] AtNIP6.1 At1g80760 拟南芥 Arabidopsis thaliana (L.) Heynh. 质膜 尿素转运蛋白 [35] AtNIP5.1 At4g10380 拟南芥 – 低硼诱导的尿素转运 [35] TIP AtTIP1.1 At2g36830 拟南芥 液泡膜 尿素转运蛋白 [36] AtTIP1.2 At3g26520 拟南芥 液泡膜 尿素转运蛋白 [24] AtTIP1.3 At4g01470 拟南芥 – 尿素转运蛋白 [37] AtTIP2.1 At3g16240 拟南芥 液泡膜/
叶绿体膜尿素转运蛋白 [24] AtTIP4.1 At2g25810 拟南芥 液泡膜 尿素转运蛋白 [24] AtTIP5.1 At3g47440 拟南芥 线粒体膜 尿素转运蛋白 [38] NtTIPa AJ237751 拟南芥 液泡膜 调节液泡中尿素 [39] VgTIP2.1 MH824554 巨大丽穗凤梨 Vriesea gigantea Gaudich 液泡膜 调节液泡中尿素 [40] ZmTIP4.4 Zm00001d039293 玉米 Zea mays L. 液泡膜 调节液泡中尿素 [22] XIP NtXIP1.1α NP_001312796 烟草 Nicotiana tabacum L. 质膜 尿素转运蛋白 [41] NtXIP1.1β Nitab4.5_0000956g0150.1 烟草 质膜 尿素转运 [41] DUR3的转运能力和强度受pH值和尿素浓度调控,其转录表达具有组织特异性,并且随植物个体的发育阶段而变化[25]。水稻中OsDUR3在叶中的表达高于根,而且表达强弱因植物种类和发育时期存在显著差异[26],而且参与了衰老叶片中尿素再分配过程[25]。AtDUR3主要在根表皮细胞和老叶维管组织以及中脉表达[26]。DUR3在木质部薄壁细胞质膜上表达,表明其可能参与木质部尿素的装载与卸载[23] 。供给植物硝酸盐和氨态氮都会下调DUR3的表达。尤其值得引起注意的是在拟南芥、水稻和玉米根中,缺氮胁迫和供给尿素都可以上调其表达[23]。这说明AtDUR3是一个底物诱导的转运系统,类似于硝酸盐的NRT2.1基因的表达调控系统。目前有团队正在研究这种表达上调来自尿素信号本身,还是由于氮素供应不足,尿素供应导致抑制缺氮胁迫而造成的。DUR3的表达水平还受到pH值的影响。转化AtDUR3的卵母细胞在pH值为5.0时,其尿素吸收量比pH值为8的时候增加了3倍[26]。因此,DUR3表达具有底物、pH值依赖性[27]。
2.2 低亲和力的尿素转运机制及其在叶片氮吸收中的功能
尿素被动运输主要是由主要内在蛋白(Major intrinsic protein,MIP)超家族介导[40]。MIP可分为类Nodulin 26膜内在蛋白(Nodulin 26-like membrane intrinsic protein,NIP)、质膜内在蛋白(Plasma membrane intrinsic protein,PIP)、液泡膜内在蛋白(Tonoplast intrinsic protein,TIP)、碱性小分子膜内在蛋白(Small basic intrinsic protein,SIP)、过类GlpF膜内在蛋白(GlpF-like intrinsic protein,GIP)、混合内在蛋白(Hybrid intrinsic proteins,HIP)、未分类内在蛋白(X intrinsic Protein,XIP)7个家族[42]。NIP蛋白对水、尿素等多种小分子以及硅酸盐、硼酸盐等都具有渗透性,是一个具有广泛底物特异性的特异性亚家族(表1)。拟南芥AtNIP5.1可以转运尿素和硼酸,在缺硼且在高浓度尿素的条件下,NIP5.1是尿素主要运输蛋白[35]。尿素和硼两种底物在NIP5.1通道孔内并不相互竞争限制结合位点[43]。NIP6.1是与NIP5.1最相似的基因,AtNIP6.1可以转运尿素,但研究显示尿素可以抑制NIP6.1的表达[35]。NIP6.1在叶柄中表达,转运硼到嫩叶中可能发挥独特的作用,尿素对其表达抑制可能是对植物中过量尿素造成潜在毒性的一种反应[35],也可能是NIP6.1在植物器官间的尿素运输中起到次要作用。CsNIP2.1同样参与尿素的氮营养调控,如在种子萌发过程中尿素的吸收和内部运输,以及氮向发育组织的运输等多个环节。OsNIP2.1还介导了硅的吸收和亚砷酸盐的双向运输[44]。这些都说明尿素转运蛋白在不同物种中往往能够兼具跨膜运输其他养分离子的功能。ZmNIP2.1、ZmNIP2.4定位于质膜,对硅和尿素都有渗透性,但在不同玉米组织的表达模式是不同的,除了参与根系对尿素的吸收外,还可能参与叶片和/或生殖器官的尿素吸收和再转移[22]。ZmTIP4.4参与尿素转运,稳定液泡中尿素的浓度[40]。
PIP家族中,目前只发现PIP1.5可以转运尿素,其表达受到硝酸盐和昼夜周期诱导。ZmPIP1.5b与ZmPIP1.5的同源性为95.2%,是在各组织器官中广泛表达的尿素转运体[31]。研究表明,ZmPIP1.2可以运输硼酸,尿素的分子大小与硼酸相似,同为不带电的小分子[39]。ZmPIP1.2可能与AtNIP5.1具有转运尿素的相似功能。最新研究证明,AtPIP1.2可能促进NH4 + /NH3的融合,调节液泡中尿素的储存[40]。在供给巨大丽穗凤梨(Vriesea gigantea Gaudich)幼苗尿素或铵条件下,VgPIP1.1和VgPIP1.2转录水平上调,而VgTIP2.1仅在成熟植物中对尿素反应上调,这表明个体发育会影响PIP1.2和TIP2.1的转录水平,调节氮的运输和分配[40]。
TIP亚家族约占总液泡膜蛋白的40%[45],具有转移尿素并存储在液泡的作用,以维持细胞质中的氮平衡[46]。TIP家族成员TIP1.1、TIP1.2、TIP2.1和TIP4.1具有不依赖pH值转运高浓度尿素的能力[22]。此外,ZmTIP1.1在植物中除了可以运输尿素之外,还可以和AtAMT2.1一样跨膜转运NH4 + 两种形态氮素[47]。此外,NtTIPa在植物中优先跨膜转运尿素[39],可能由于TIP增加了水和一些小分子溶质在被动运输通过细胞膜过程中的流动速率[48]。虽然目前还没有在线粒体或任何其他内膜中发现尿素转运体,但在拟南芥中AtTIP5.1可能是花粉线粒体尿素转运体[38]。在拟南芥种子胚的质膜[37]和花粉管内膜[38]也发现了同样能运输尿素的TIP1.3,而AtTIP2.1定位于液泡膜和叶绿体膜[22, 49],它们在相应宿主生物中的生理功能都需要进一步研究。液泡膜一般具有较高的尿素渗透性,甚至可能高于质膜[39]。此外,TIP1.5 在液泡膜的位置上,有助于提高拟南芥花粉管中尿素分子从液泡向线粒体基质渗透的效率[37]。这些结果表明,植物细胞液泡膜的尿素存储功能对尿素的储存和运输具有更重要的生理意义。
烟草(Nicotiana tabacum L.)中NtXIP1.1α、NtXIP1.1β不运输H2O,但可以促进尿素转运[41],它们在亚细胞定位和底物选择性方面没有差异,需要进一步的研究来精确量化不同器官和组织中转录本的水平或对不同环境生长条件的反应,并阐明其生理意义。但研究已经证明,NtXIP1.1不参与维管组织中尿素的装载或卸载[50]。XIP与NIP具有相似性(尤其是NIP3),底物都是甘油和硼,但对水的渗透性都不高,因此XIP可能与NIP具有相似功能。
3. 尿素的代谢及利用
3.1 尿素的利用
植物可以从外界环境中吸收尿素,也可自身合成尿素。但脲酶活性在胞质中呈组成型表达而导致细胞质中很少会存在尿素积累。已知在植物细胞中存在脲酶和尿素酰胺酶两类尿素分解酶。
尿素在细胞质基质中被脲酶水解成氨基甲酸酯和NH4 + ,氨基甲酸酯是不稳定的,可以产生NH4 + 和CO2[51](图2、表2)。尿素分解过程中氨的释放导致pH值上升,因为在pH值为中性时,大多数氨被质子化变为NH4 + 。细胞质中的NH4 + 和谷氨酸在谷氨酰胺合成酶作用下,形成新的氨基酸进入碳氮代谢,据报道该酶仅存在于叶片中的韧皮部薄壁细胞[52]。脲酶由4个基因和Ni2 + 共同调控激活其活性[53]。ABA(Abscisic acid)、SA(Salicylic acid)、JA(Jasmonates)和GA(Gibberellin)均诱导脲酶基因的表达,但不影响脲酶活性[54]。这可能是因为激素调控脲酶转录过程,但不参与脲酶活性形成过程(基因翻译或者脲酶激活)。此外,NH4 + 作为植物生长氮源时,脲酶的合成被抑制,而尿素或其他氮素时,激活脲酶活性[55]。因此,植物体内脲酶活性是尿素同化效率的重要指征。
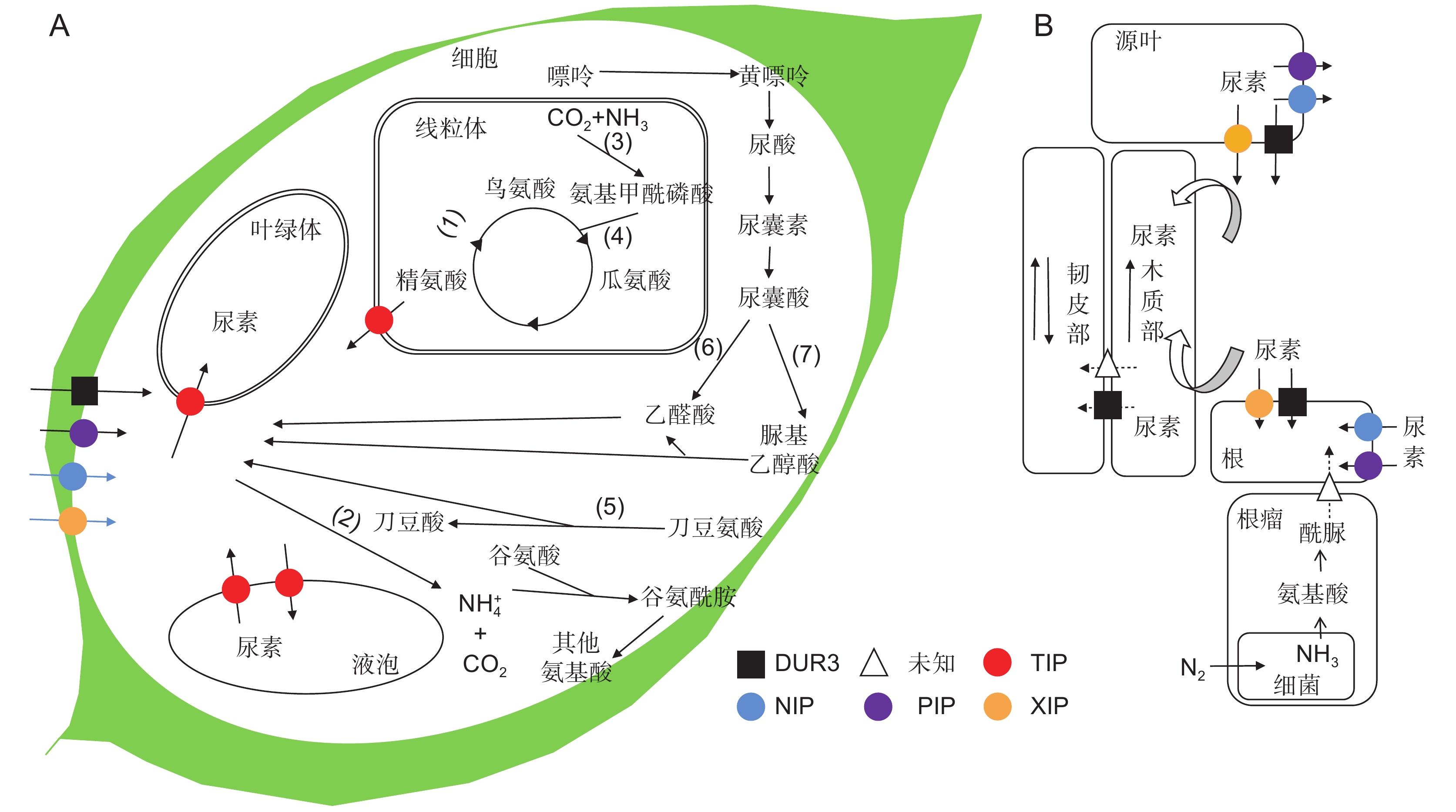
![]() A:细胞中尿素的转运、分解与合成过程。植物中尿素合成和分解的酶主要包括:(1)精氨酸酶;(2)脲酶;(3)氨基甲酰磷酸合成酶;(4)鸟氨酸氨基甲酰转移酶;(5)刀豆氨酸水解酶;(6)尿囊酸脒基水解酶;(7)尿囊酸酰胺水解酶;(8)尿素裂解酶。DUR3是高亲和尿素转运蛋白;TIP、NIP、PIP和XIP亚家族的水通道蛋白介导低亲和的尿素转运。B:根、叶尿素吸收以及从根到叶的长距离运输。实线箭头表示已知途径。虚线箭头表示未知途径。Figure 2. Urea uptake and metabolism in plants (modified according to Cao et al.[53] and Tegeder et al.[57])A: Schematic of transport, decomposition, and synthesis of urea in cells. Urea-generating enzymes are (1) Arginase; (2) Urease; (3) Carbamoyl phosphate synthetase; (4) Ornithinetranscarbamylase; (5) Canavanine hydrolase; (6) Amidinohydrolase; (7) Allantoate amidinohydrolase; (8) Urea-lyase. DUR 3 is a high-affinity urea transporter; aquaporins of TIP, NIP, PIP, and XIP subfamilies mediate low-affinity urea transport. Schematic representation of urea uptake and translocation from root to leaves. Legend indicates transporters involved in urea transport. B: Root, leaf urea uptake, and long-distance transport from root to leaf. Solid-line arrows indicate known pathways. Dashed arrows indicate unknown pathway.表 2 不同类型植物中尿素合成与分解代谢比较Table 2. Urea synthesis, catabolism, and degradation in different types of plants
A:细胞中尿素的转运、分解与合成过程。植物中尿素合成和分解的酶主要包括:(1)精氨酸酶;(2)脲酶;(3)氨基甲酰磷酸合成酶;(4)鸟氨酸氨基甲酰转移酶;(5)刀豆氨酸水解酶;(6)尿囊酸脒基水解酶;(7)尿囊酸酰胺水解酶;(8)尿素裂解酶。DUR3是高亲和尿素转运蛋白;TIP、NIP、PIP和XIP亚家族的水通道蛋白介导低亲和的尿素转运。B:根、叶尿素吸收以及从根到叶的长距离运输。实线箭头表示已知途径。虚线箭头表示未知途径。Figure 2. Urea uptake and metabolism in plants (modified according to Cao et al.[53] and Tegeder et al.[57])A: Schematic of transport, decomposition, and synthesis of urea in cells. Urea-generating enzymes are (1) Arginase; (2) Urease; (3) Carbamoyl phosphate synthetase; (4) Ornithinetranscarbamylase; (5) Canavanine hydrolase; (6) Amidinohydrolase; (7) Allantoate amidinohydrolase; (8) Urea-lyase. DUR 3 is a high-affinity urea transporter; aquaporins of TIP, NIP, PIP, and XIP subfamilies mediate low-affinity urea transport. Schematic representation of urea uptake and translocation from root to leaves. Legend indicates transporters involved in urea transport. B: Root, leaf urea uptake, and long-distance transport from root to leaf. Solid-line arrows indicate known pathways. Dashed arrows indicate unknown pathway.表 2 不同类型植物中尿素合成与分解代谢比较Table 2. Urea synthesis, catabolism, and degradation in different types of plants目前仅在细菌、酵母和藻类中发现由DUR1、DUR2编码的尿素酰胺酶。此酶利用ATP分解产生的能量分两步将尿素分解为 CO2和 NH3[56]。因此,还没有在植物研究中的相关报道。
3.2 尿素的代谢
植物的内源尿素主要在精氨酸(Arginine,Arg)的分解途径和酰脲、嘌呤的降解途径中产生(图2)。
3.2.1 精氨酸分解途径
在缺氮条件下,线粒体中精氨酸酶(Arginase,ARG)催化精氨酸形成鸟氨酸(Ornithine,Orn)和尿素[58]。精氨酸异化过程亦与多胺代谢相关,精氨酸、鸟氨酸分别是多胺生物合成过程中的副产物和前体物质[60]。
3.2.2 酰脲和嘌呤的降解途径
在逆境条件下,固氮植物体内游离的嘌呤降解生成酰脲(主要是尿囊素和尿囊酸),然后水解成尿素参与氮素循环,主要在豆科植物中用于长距离氮运输[35]。每分子尿囊素可以释放4个NH4 + ,比直接转运氨基酸分子或其他含氮有机物更有效,特别是在胁迫或花芽分化等需大量氮素供应时期[52]。因此,尿囊酸酰胺水解酶分解尿囊酸直接释放NH3的途径十分重要。
4. 尿素代谢过程中下游含氮代谢物的吸收转运系统
尿素进入叶片后被细胞质中的脲酶分解为NH4 + 和CO2[51]。AMT家族是高等植物的主要铵转运蛋白(表3)。AMT可分为AMT1和AMT2两大亚家族。AMT1家族成员多属于高亲和转运系统,参与植物对NH4 + 的质外体与共质体运输[61]。AMT1.1在拟南芥各器官中均有表达,如在叶中高度表达,参与叶片转运尿素过程[62]。BnAMT1.2与AtAMT1.3的同源性为97%,在叶中高度表达;其转录水平受到光变化的强烈影响[63],它的功能可能与拟南芥的基因功能相似,参与叶片NH4 + 吸收。除BnAMT1.2外,PtrAMT1.6的转录水平也受到日变化周期的强烈影响[64]。AMT1基因会根据作物不同表达部位也不同,如番茄(Solanum lycopersicum L.)LeAMT1.3只在地上部表达[65]。除此之外,杨(Populus)PtrAMT1.5、PtrAMT1.6和拟南芥AtAMT1.4均参与植物生殖器官的NH4 + 转运[63, 66]。
表 3 植物叶片中铵态氮转运体Table 3. Ammonium-nitrogen transporters in leaves类型
Type基因
Gene登录号
Accession No.物种
Species拉丁名
Latin name位点
Site功能
Function文献
ReferencePIP VgPIP1.1 MH824552 巨大丽穗凤梨 Vriesea gigantea Gaudich – 促进NH4 + /NH3转运 [40] VgPIP1.2 MH824553 巨大丽穗凤梨 – 促进NH4 + /NH3转运 [40] AMT AtAMT1.1 AT4G13510 拟南芥 Arabidopsis thaliana (L.) Heynh. 质膜 NH4 + 转运蛋白 [62] AtAMT1.3 AT3G24300 拟南芥 质膜 NH4 + 转运蛋白 [63] AtAMT1.4 AT4G28700 拟南芥 – NH4 + 转运蛋白 [66] AtAMT1.5 AT3G24290 拟南芥 – NH4 + 转运蛋白 [64] AtAMT2.1 AT2G38290 拟南芥 质膜 高亲和NH4 + 转运蛋白 [67] BnAMT1.2 AF306518 油菜 Brassica napus L. – NH4 + 转运蛋白 [63] LeAMT1.3 NP_001234216.1 番茄 Solanum lycopersicum L. – NH4 + 转运蛋白 [65] GmAMT1.6 GLYMA_20G221400 大豆 Glycine max (L.) Merr. – NH4 + 转运蛋白 [62] GmAMT2.2 GLYMA_18G204800 大豆 – NH4 + 转运蛋白 [67] GmAMT3.1 GLYMA_05G196500 大豆 – NH4 + 转运蛋白 [62] PtrAMT3.1 Poptr1_1:175190 杨 Populus – NH4 + 转运蛋白 [64] TIP AtTIP2.3 AT5G47450 拟南芥 Arabidopsis thaliana (L.) Heynh. 液泡膜 NH3转运 [49] AMT2家族在地上部与地下部NH4 + 传输分配过程中也起到了一定的分配与调控作用[67]。AtAMT2.1多在叶中表达,参与植物细胞的共质体和质外体之间NH4 + 的转运,以及NH4 + 从根到芽的转运[67]。AMT2.2在叶柄中高表达,参与NH4 + 韧皮部运输。AMT2家族的茶(Camellia sinensis (L.) O. Ktze)CsAMT3.1基因在绿色组织及根中均有较高的表达量,在成熟叶片中的表达量最高,其功能与NH4 + 在茶各组织部位的运输分配有关[61]。但杨PtrAMT3.1只在衰老的叶片中表达,参与NH4 + 转移[64]。
此外,VgPIP1.1和VgPIP1.2促进NH4 + /NH3转运[40]。TIP家族中AtTIP2.3也促进NH3跨膜运输,介导NH4 + 向液泡的装载和区隔化[46],从而调节液泡中NH4 + 浓度以降低铵毒发生的可能性,其转录水平随着幼龄和成体植物的形态和生理变化以及叶片的功能特化而变化[49]。
5. 展望
高等植物具有多种不同类型的尿素运输系统。在尿素被叶片吸收、木质部和韧皮部装载与卸载以及液泡贮存等过程中,不同类型的尿素转运蛋白协同调控尤为重要。尽管叶片的解剖结构和成分分析已取得较大进展,但不同作物的角质层、蜡质层与尿素等养分离子互作关系及其对尿素吸收的影响机制仍不清楚。毛状体途径在尿素吸收过程的贡献与调节机制尚需进一步探究。针对叶面吸收和代谢途径中的关键基因,借助最新的基因编辑技术和已有突变体库,采用多组学联合分析、无损伤微测技术和同位素示踪技术,有助于解析不同渗透吸收途径在叶面养分吸收过程中的角色和贡献率,揭示叶面养分吸收的分子生理调控机制。
DUR3是目前发现的唯一的高亲和尿素转运体,但其在主要农作物中的表达调控机制有待进一步解析,如DUR3在木质部、韧皮部尿素装载和卸出中的作用与上下游信号调控。此外,更多的尿素转运蛋白新基因有待于发掘和功能解析,例如:TIP2.1在液泡膜和叶绿体膜中表达,其功能未能进行详细解析和验证。负责长距离运输过程中木质部和韧皮部尿素装载和卸出的转运体尚不明确。通过整合尿素信号途径中吸收和代谢的关键基因和转录因子,借助基因编辑技术对关键基因进行编辑,增强植株对尿素吸收和转运等方面的能力;结合新型智能叶面肥料(尿素),包括纳米硅负载尿素的叶面肥或结合添加脲酶抑制剂等新型肥料,进一步整合养分资源,优化管理措施,以期提高氮素吸收利用效率,助力实现高产优质农业绿色可持续发展。
-
图 1 尿素进入叶片表皮细胞的途径示意图
a:尿素通过角质层的亲水小孔进入叶表;b:尿素通过叶片表面腺毛和叶片交接处缝隙进入叶表;c:尿素通过气孔进入表皮细胞和细胞间隙。EW:外角质层;CP:真角质层;CL:角质层基层;ML:中间板层和果胶层;ET:外质连丝;CW:细胞壁;EC:表皮细胞;LT:毛状体。
Figure 1. Schematic of urea pathway into leaf epidermal cells
a: Urea enters the leaf surface through hydrophilic pores in the cuticle; b: Urea enters the leaf surface through the gap between the leaf surface gland hairs and leaf junction; c: Urea enters the epidermal cells and intercellular spaces through the stomata. EW: Epicuticular waxes; CP: Cuticle proper; CL: Cuticular layer; ML: Middle lamellae and pectinaceous Layer; ET: Ectodesmata; CW: Cell wall; EC: Epidermal cells; LT: Leaf trichome.
图 2 植物对尿素的吸收与代谢(参考曹凤秋等[53]和Tegeder等[57]的文献)
A:细胞中尿素的转运、分解与合成过程。植物中尿素合成和分解的酶主要包括:(1)精氨酸酶;(2)脲酶;(3)氨基甲酰磷酸合成酶;(4)鸟氨酸氨基甲酰转移酶;(5)刀豆氨酸水解酶;(6)尿囊酸脒基水解酶;(7)尿囊酸酰胺水解酶;(8)尿素裂解酶。DUR3是高亲和尿素转运蛋白;TIP、NIP、PIP和XIP亚家族的水通道蛋白介导低亲和的尿素转运。B:根、叶尿素吸收以及从根到叶的长距离运输。实线箭头表示已知途径。虚线箭头表示未知途径。
Figure 2. Urea uptake and metabolism in plants (modified according to Cao et al.[53] and Tegeder et al.[57])
A: Schematic of transport, decomposition, and synthesis of urea in cells. Urea-generating enzymes are (1) Arginase; (2) Urease; (3) Carbamoyl phosphate synthetase; (4) Ornithinetranscarbamylase; (5) Canavanine hydrolase; (6) Amidinohydrolase; (7) Allantoate amidinohydrolase; (8) Urea-lyase. DUR 3 is a high-affinity urea transporter; aquaporins of TIP, NIP, PIP, and XIP subfamilies mediate low-affinity urea transport. Schematic representation of urea uptake and translocation from root to leaves. Legend indicates transporters involved in urea transport. B: Root, leaf urea uptake, and long-distance transport from root to leaf. Solid-line arrows indicate known pathways. Dashed arrows indicate unknown pathway.
表 1 植物叶片中尿素转运体
Table 1 Urea transporters in leaves
类型
Type基因
Gene登录号
Accession No.物种
Species拉丁名
Latin name位点
Site功能
Function文献
ReferenceDUR3 AtDUR3 At5g45380 拟南芥 Arabidopsis thaliana (L.) Heynh. 细胞质膜 H + -尿素共运输
高亲和性尿素跨质膜
吸收转运;[26] OsDUR3 Os10g0580400 水稻 Oryza sativa L. 细胞质膜 尿素运输;氮转移 [27] ZmDUR3 Zm00001e030875 玉米 Zea mays L. 细胞质膜 高亲和力尿素转运 [28] PyDUR3.1 AB359179 条斑紫菜 Porphyra yezoensis Ueda – 氮缺乏高度上调 [29] PyDUR3.2 AB359180 条斑紫菜 – 氮缺乏高度上调 [29] PyDUR3.3 AB931115 条斑紫菜 – 尿素转运 [30] PIP ZmPIP1.5 Zm00001d051872 玉米 Zea mays L. 质膜 尿素转运蛋白 [31] ZmPIP1.5b AJ271796 玉米 – 尿素转运蛋白 [31] NIP ZmNIP2.1 Zm00001d018037 玉米 质膜 尿素吸收与转运;
调节液泡中尿素[32] ZmNIP2.4 Zm00001d052261 玉米 质膜 尿素吸收与转运;
调节液泡中尿素[32] OsNIP2;1 Os02g0745100 水稻 Oryza sativa L. – 尿素转运蛋白 [33] CsNIP2;1 Csa017389 黄瓜 Cucumis sativus L. – 尿素的吸收和内部运输 [34] AtNIP6.1 At1g80760 拟南芥 Arabidopsis thaliana (L.) Heynh. 质膜 尿素转运蛋白 [35] AtNIP5.1 At4g10380 拟南芥 – 低硼诱导的尿素转运 [35] TIP AtTIP1.1 At2g36830 拟南芥 液泡膜 尿素转运蛋白 [36] AtTIP1.2 At3g26520 拟南芥 液泡膜 尿素转运蛋白 [24] AtTIP1.3 At4g01470 拟南芥 – 尿素转运蛋白 [37] AtTIP2.1 At3g16240 拟南芥 液泡膜/
叶绿体膜尿素转运蛋白 [24] AtTIP4.1 At2g25810 拟南芥 液泡膜 尿素转运蛋白 [24] AtTIP5.1 At3g47440 拟南芥 线粒体膜 尿素转运蛋白 [38] NtTIPa AJ237751 拟南芥 液泡膜 调节液泡中尿素 [39] VgTIP2.1 MH824554 巨大丽穗凤梨 Vriesea gigantea Gaudich 液泡膜 调节液泡中尿素 [40] ZmTIP4.4 Zm00001d039293 玉米 Zea mays L. 液泡膜 调节液泡中尿素 [22] XIP NtXIP1.1α NP_001312796 烟草 Nicotiana tabacum L. 质膜 尿素转运蛋白 [41] NtXIP1.1β Nitab4.5_0000956g0150.1 烟草 质膜 尿素转运 [41] 表 2 不同类型植物中尿素合成与分解代谢比较
Table 2 Urea synthesis, catabolism, and degradation in different types of plants
表 3 植物叶片中铵态氮转运体
Table 3 Ammonium-nitrogen transporters in leaves
类型
Type基因
Gene登录号
Accession No.物种
Species拉丁名
Latin name位点
Site功能
Function文献
ReferencePIP VgPIP1.1 MH824552 巨大丽穗凤梨 Vriesea gigantea Gaudich – 促进NH4 + /NH3转运 [40] VgPIP1.2 MH824553 巨大丽穗凤梨 – 促进NH4 + /NH3转运 [40] AMT AtAMT1.1 AT4G13510 拟南芥 Arabidopsis thaliana (L.) Heynh. 质膜 NH4 + 转运蛋白 [62] AtAMT1.3 AT3G24300 拟南芥 质膜 NH4 + 转运蛋白 [63] AtAMT1.4 AT4G28700 拟南芥 – NH4 + 转运蛋白 [66] AtAMT1.5 AT3G24290 拟南芥 – NH4 + 转运蛋白 [64] AtAMT2.1 AT2G38290 拟南芥 质膜 高亲和NH4 + 转运蛋白 [67] BnAMT1.2 AF306518 油菜 Brassica napus L. – NH4 + 转运蛋白 [63] LeAMT1.3 NP_001234216.1 番茄 Solanum lycopersicum L. – NH4 + 转运蛋白 [65] GmAMT1.6 GLYMA_20G221400 大豆 Glycine max (L.) Merr. – NH4 + 转运蛋白 [62] GmAMT2.2 GLYMA_18G204800 大豆 – NH4 + 转运蛋白 [67] GmAMT3.1 GLYMA_05G196500 大豆 – NH4 + 转运蛋白 [62] PtrAMT3.1 Poptr1_1:175190 杨 Populus – NH4 + 转运蛋白 [64] TIP AtTIP2.3 AT5G47450 拟南芥 Arabidopsis thaliana (L.) Heynh. 液泡膜 NH3转运 [49] -
[1] Zang HD,Blagodatskaya E,Wen Y,Shi LL,Cheng F,et al. Temperature sensitivity of soil organic matter mineralization decreases with long-term n fertilization:evidence from four Q10 estimation approaches[J]. Land Degrad Dev,2020,31 (6):683−693. doi: 10.1002/ldr.3496
[2] Bindraban PS,Dimkpa C,Nagarajan L,Roy A,Rabbinge R. Revisiting fertilisers and fertilisation strategies for improved nutrient uptake by plants[J]. Biol Fertil Soils,2015,51 (8):897−911. doi: 10.1007/s00374-015-1039-7
[3] Wang WH,Köhler B,Cao FQ,Liu LH. Molecular and physiological aspects of urea transport in higher plants[J]. Plant Sci,2008,175 (4):467−477. doi: 10.1016/j.plantsci.2008.05.018
[4] Franke W. Mechanisms of foliar penetration of solutions[J]. Annu Rev Plant Physiol,1967,18:281−300. doi: 10.1146/annurev.pp.18.060167.001433
[5] Schreel JDM,Leroux O,Goossens W,Brodersen C,Rubinstein A,Steppe K. Identifying the pathways for foliar water uptake in beech (Fagus sylvatica L. ):a major role for Trichomes[J]. Plant J,2020,103 (2):769−780. doi: 10.1111/tpj.14770
[6] 张俊伶. 植物营养学[M]. 北京: 中国农业大学出版社, 2021: 54-57. [7] Li C,Wang P,van der Ent A,Cheng MM,Jiang HB,et al. Absorption of foliar-applied Zn in sunflower (Helianthus annuus):importance of the cuticle,stomata and Trichomes[J]. Ann Bot,2019,123 (1):57−68. doi: 10.1093/aob/mcy135
[8] Aponte J,Baur P. The role of pH for ionic solute uptake by the non-aerial hypocotyl of mung bean plants[J]. J Plant Dis Prot,2018,125 (4):433−442. doi: 10.1007/s41348-018-0153-9
[9] Fernández V,Bahamonde HA,Peguero-Pina JJ,Gil-Pelegrín E,Sancho-Knapik D,et al. Physico-chemical properties of plant cuticles and their functional and ecological significance[J]. J Exp Bot,2017,68 (19):5293−5306. doi: 10.1093/jxb/erx302
[10] Rosado BHP,Holder CD. The significance of leaf water repellency in Ecohydrological research:a review[J]. Ecohydrology,2013,6 (1):150−161. doi: 10.1002/eco.1340
[11] Goldsmith GR,Bentley LP,Shenkin A,Salinas N,Blonder B,et al. Variation in leaf wettability traits along a tropical montane elevation gradient[J]. New Phytol,2017,214 (3):989−1001. doi: 10.1111/nph.14121
[12] Eichert T,Goldbach HE. Equivalent pore radii of hydrophilic foliar uptake routes in Stomatous and Astomatous leaf surfaces-further evidence for a stomatal pathway[J]. Physiol Plant,2008,132 (4):491−502. doi: 10.1111/j.1399-3054.2007.01023.x
[13] Yamada Y,Wittwer SH,Bukovac MJ. Penetration of organic compounds through isolated cuticular membranes with special reference to C14 Urea[J]. Plant Physiol,1965,40 (1):170−175. doi: 10.1104/pp.40.1.170
[14] Johnson HB. Plant pubescence:an ecological perspective[J]. Bot Rev,1975,41 (3):233−258. doi: 10.1007/BF02860838
[15] 程丽林, 谷海萍, 刘梦琳, 张长峰. 植物果实角质层及其渗透性的研究进展[J]. 保鲜与加工, 2019, 19(3): 174-178. Cheng LL, Gu HP, Liu ML, Zhang CF. Research progress on the plantfruit cuticles and its permeability[J]. Storage and Process, 2019, 19(3): 174-178.
[16] Waseem M,Nie ZF,Yao GQ,Hasan M,Xiang Y,Fang XW. Dew absorption by leaf Trichomes in Caragana korshinskii:an alternative water acquisition strategy for withstanding drought in arid environments[J]. Physiol Plant,2021,172 (2):528−539. doi: 10.1111/ppl.13334
[17] Schreel JDM,Steppe K. Foliar water uptake in trees:negligible or necessary?[J]. Trends Plant Sci,2020,25 (6):590−603. doi: 10.1016/j.tplants.2020.01.003
[18] Yan A,Pan JB,An LZ,Gan YB,Feng HY. The responses of Trichome mutants to enhanced ultraviolet-B radiation in Arabidopsis thaliana[J]. J Photochem Photobiol B:Biol,2012,113:29−35. doi: 10.1016/j.jphotobiol.2012.04.011
[19] Villar-Salvador P,Planelles R,Oliet J,Peñuelas-Rubira JL,Jacobs DF,González M. Drought tolerance and transplanting performance of holm oak (Quercus ilex) seedlings after drought hardening in the nursery[J]. Tree Physiol,2004,24 (10):1147−1155. doi: 10.1093/treephys/24.10.1147
[20] Bethea Jr FG,Park D,Mount A,Menchyk N,Liu HB. Effects of acute moisture stress on creeping bentgrass cuticle morphology and associated effects on foliar nitrogen uptake[J]. HortScience,2014,49 (12):1582−1587. doi: 10.21273/HORTSCI.49.12.1582
[21] 刘海光,罗振,董合忠. 植物硝态氮吸收和转运的调控研究进展[J]. 生物技术通报,2021,37(6):192−201. Liu HG,Luo Z,Dong HZ. Research progress on the regulation of NO3- uptake and transport in plant[J]. Biotechnology Bulletin,2021,37 (6):192−201.
[22] Liu LH,Ludewig U,Gassert B,Frommer WB,Von Wirén N. Urea transport by nitrogen-regulated tonoplast intrinsic proteins in Arabidopsis[J]. Plant Physiol,2003,133 (3):1220−1228. doi: 10.1104/pp.103.027409
[23] Kojima S,Bohner A,Gassert B,Yuan LX,Wirén NV. AtDUR3 represents the major transporter for high-affinity urea transport across the plasma membrane of nitrogen-deficient Arabidopsis roots[J]. Plant J,2007,52 (1):30−40. doi: 10.1111/j.1365-313X.2007.03223.x
[24] Liu LH,Ludewig U,Frommer WB,Von Wirén N. AtDUR3 encodes a new type of high-affinity urea/H + symporter in Arabidopsis[J]. Plant Cell,2003,15 (3):790−800. doi: 10.1105/tpc.007120
[25] Liu GW,Sun AL,Li DQ,Athman A,Gilliham M,Liu LH. Molecular identification and functional analysis of a maize (Zea mays) DUR3 homolog that transports urea with high affinity[J]. Planta,2015,241 (4):861−874. doi: 10.1007/s00425-014-2219-7
[26] Beier MP,Fujita T,Sasaki K,Kanno K,Ohashi M,et al. The urea transporter DUR3 contributes to rice production under nitrogen-deficient and field conditions[J]. Physiol Plant,2019,167 (1):75−89. doi: 10.1111/ppl.12872
[27] Wang WH,Köhler B,Cao FQ,Liu GW,Gong YY,et al. Rice DUR3 mediates high-affinity urea transport and plays an effective role in improvement of urea acquisition and utilization when expressed in Arabidopsis[J]. New Phytol,2012,193 (2):432−444. doi: 10.1111/j.1469-8137.2011.03929.x
[28] Zanin L,Tomasi N,Wirdnam C,Meier S,Komarova NY,et al. Isolation and functional characterization of a high affinity urea transporter from roots of Zea mays[J]. BMC Plant Biol,2014,14 (1):222. doi: 10.1186/s12870-014-0222-6
[29] Kakinuma M,Coury DA,Nakamoto C,Sakaguchi K,Amano H. Molecular analysis of physiological responses to changes in nitrogen in a marine Macroalga,Porphyra yezoensis(Rhodophyta)[J]. Cell Biol Toxicol,2008,24 (6):629−639. doi: 10.1007/s10565-007-9053-7
[30] Kakinuma M,Suzuki K,Iwata S,Coury DA,Iwade S,Mikami K. Isolation and characterization of a new DUR3-like gene,PyDUR3.3,from the marine macroalga Pyropia yezoensis (Rhodophyta)[J]. Fish Sci,2016,82 (1):171−184. doi: 10.1007/s12562-015-0947-7
[31] Gaspar M,Bousser A,Sissoëff I,Roche O,Hoarau J,Mahé A. Cloning and characterization of ZmPIP1-5b,an aquaporin transporting water and urea[J]. Plant Sci,2003,165 (1):21−31. doi: 10.1016/S0168-9452(03)00117-1
[32] Gu RL,Chen XL,Zhou YL,Yuan LX. Isolation and characterization of three maize aquaporin genes,ZmNIP2;1,ZmNIP2;4 and ZmTIP4;4 involved in urea transport[J]. BMB Rep,2012,45 (2):96−101. doi: 10.5483/BMBRep.2012.45.2.96
[33] Mitani N,Yamaji N,Ma JF. Characterization of substrate specificity of a rice silicon transporter,Lsi1[J]. Pflügers Archiv Eur J Physiol,2008,456 (4):679−686.
[34] Wallace IS,Roberts DM. Distinct transport selectivity of two structural subclasses of the Nodulin-like intrinsic protein family of plant Aquaglyceroporin channels[J]. Biochemistry,2005,44 (51):16826−16834. doi: 10.1021/bi0511888
[35] Yang H,Menz J,Häussermann I,Benz M,Fujiwara T,Ludewig U. High and low affinity urea root uptake:involvement of NIP5;1[J]. Plant Cell Physiol,2015,56 (8):1588−1597. doi: 10.1093/pcp/pcv067
[36] 石永春,郭尧,薛瑞丽. 烟草硼内向转运体NIP5;1的克隆和表达分析[J]. 中国农学通报.,2016,32(21):100−105. Shi YC,Guo Y,Xue RL. Cloning and expression analysis of boron infux transporter NIP5;1 form Nicotiana[J]. Chinses Agricultual Science Bulletin,2016,32 (21):100−105.
[37] Klebl F,Wolf M,Sauer N. A defect in the yeast plasma membrane urea transporter Dur3p is complemented by CpNIP1,a Nod26-like protein from zucchini (Cucurbita pepo L.),and by Arabidopsis thaliana δ-TIP or γ-TIP[J]. FEBS Lett,2003,547 (1-3):69−74. doi: 10.1016/S0014-5793(03)00671-9
[38] Soto G,Fox R,Ayub N,Alleva K,Guaimas F,et al. TIP5;1 is an aquaporin specifically targeted to pollen mitochondria and is probably involved in nitrogen remobilization in Arabidopsis thaliana[J]. Plant J,2010,64 (6):1038−1047. doi: 10.1111/j.1365-313X.2010.04395.x
[39] Gerbeau P,Güçlü J,Ripoche P,Maurel C. Aquaporin Nt-TIPa can account for the high permeability of tobacco cell vacuolar membrane to small neutral solutes[J]. Plant J,1999,18 (6):577−587. doi: 10.1046/j.1365-313x.1999.00481.x
[40] Matiz A,Cambuí CA,Richet N,Mioto PT,Gomes F,et al. Involvement of Aquaporins on nitrogen-acquisition strategies of juvenile and adult plants of an epiphytic tank-forming bromeliad[J]. Planta,2019,250 (1):319−332. doi: 10.1007/s00425-019-03174-7
[41] Bienert GP,Bienert MD,Jahn TP,Boutry M,Chaumont F. Solanaceae XIPs are plasma membrane Aquaporins that facilitate the transport of many uncharged substrates[J]. Plant J,2011,66 (2):306−317. doi: 10.1111/j.1365-313X.2011.04496.x
[42] Wang M,Ding L,Gao LM,Li YR,Shen QR,Guo SW. The interactions of Aquaporins and mineral nutrients in higher plants[J]. Int J Mol Sci,2016,17 (8):1229. doi: 10.3390/ijms17081229
[43] Miwa K, Tanaka M, Kamiya T, Fujiwara T. Molecular mechanisms of boron transport in plants: involvement of Arabidopsis NIP5;1 and NIP6;1[M]//Jahn TP, Bienert GP, eds. MIPs and Their Roles in the Exchange of Metalloids. New York: Springer, 2010: 83-96.
[44] Zhao FJ,Ago Y,Mitani N,Li RY,Su YH,et al. The role of the rice aquaporin Lsi1 in Arsenite efflux from roots[J]. New Phytol,2010,186 (2):392−399. doi: 10.1111/j.1469-8137.2010.03192.x
[45] Maeshima M. Tonoplast transporters:organization and function[J]. Annu Rev Plant Physiol Plant Mol Biol,2001,52:469−497. doi: 10.1146/annurev.arplant.52.1.469
[46] Jahn TP,Møller ALB,Zeuthen T,Holm LM,Klaerke DA,et al. Aquaporin homologues in plants and mammals transport ammonia[J]. FEBS Lett,2004,574 (1-3):31−36.
[47] Quiroga G,Erice G,Aroca R,Delgado-Huertas A,Ruiz-Lozano JM. Elucidating the possible involvement of maize Aquaporins and arbuscular mycorrhizal symbiosis in the plant ammonium and urea transport under drought stress conditions[J]. Plants,2020,9 (2):148. doi: 10.3390/plants9020148
[48] Chrispeels MJ,Maurel C. Aquaporins:the molecular basis of facilitated water movement through living plant cells?[J]. Plant Physiol,1994,105 (1):9−13. doi: 10.1104/pp.105.1.9
[49] Loque D,Ludewig U,Yuan LX,von Wirén N. Tonoplast intrinsic proteins AtTIP2;1 and AtTIP2;3 facilitate NH3 transport into the vacuole[J]. Plant Physiol,2005,137 (2):671−680. doi: 10.1104/pp.104.051268
[50] Gupta AB,Sankararamakrishnan R. Genome-wide analysis of major intrinsic proteins in the tree plant Populus trichocarpa:characterization of XIP subfamily of Aquaporins from evolutionary perspective[J]. BMC Plant Biol,2009,9:134. doi: 10.1186/1471-2229-9-134
[51] Witte CP,Tiller SA,Taylor MA,Davies HV. Leaf urea metabolism in potato. Urease activity profile and patterns of recovery and distribution of 15N after foliar urea application in wild-type and urease-antisense Transgenics[J]. Plant Physiol,2002,128 (3):1129−1136. doi: 10.1104/pp.010506
[52] 张海涛,宋远辉,郑思怡,花芹,杨晔,林泉祥. 植物尿素代谢及稳态调节机制研究进展[J]. 安徽农业大学学报,2022,49(2):181−188. Zhang HT,Song YH,Zheng SY,Hua Q,Yang Y,Lin QX. Research progress on urea metabolism and regulation mechanism of homeostasis in plants[J]. Journal of Anhui Agricultural University,2022,49 (2):181−188.
[53] 曹凤秋,刘国伟,王伟红,吴学明,刘来华. 高等植物尿素代谢及转运的分子机理[J]. 植物学报,2009,44(3):273−282. Cao FJ,Liu GW,Wang WH,Wu XM,Liu LH. Molecular processes of urea metabolism and transport in higher plants[J]. Chinese Bulletin of Botany,2009,44 (3):273−282.
[54] Machuca A,Cuba-Díaz M,Córdova C. Enzymes in the rhizosphere of plants growing in the vicinity of the polish Arctowski Antarctic station[J]. J Soil Sci Plant Nutr,2015,15 (4):833−838.
[55] De Macedo FG,Bresolin JD,Santos EF,Furlan F,Lopes da Silva WT,et al. Nickel availability in soil as influenced by liming and its role in soybean nitrogen metabolism[J]. Front Plant Sci,2016,7:1358.
[56] Kanamori T,Kanou N,Atomi H,Imanaka T. Enzymatic characterization of a prokaryotic urea carboxylase[J]. J Bacteriol,2004,186 (9):2532−2539.
[57] Tegeder M,Masclaux-Daubresse CE. Source and sink mechanisms of nitrogen transport and use[J]. New Phytologist,2017,217 (1):35−53.
[58] 王慧飞,冯雪,张一名,陈光,孙艳香. 植物中尿素循环相关酶及代谢产物研究进展[J]. 云南农业大学学报(自然科学),2018,33(2):334−342. Wang HF,Feng X,Zhang YM,Chen G,Sun YX. Advance in study on the urea cycle related enzymes and metabolic products in plant[J]. Journal of Yunnan Agricultural University (Natural Science)
,2018,33 (2):334−342. [59] Ariz I,Asensio AC,Zamarreño AM,García-Mina JM,Aparicio-Tejo PM,Moran JF. Changes in the C/N balance caused by increasing external ammonium concentrations are driven by carbon and energy availabilities during ammonium nutrition in pea plants:the key roles of asparagine synthetase and anaplerotic enzymes[J]. Physiol Plant,2013,148 (4):522−537. doi: 10.1111/j.1399-3054.2012.01712.x
[60] Todd CD,Tipton PA,Blevins DG,Piedras P,Pineda M,Polacco JC. Update on Ureide degradation in legumes[J]. J Exp Bot,2006,57 (1):5−12. doi: 10.1093/jxb/erj013
[61] 张文婧,林琳,孙威江. 茶树铵转运蛋白AMT研究进展[J]. 分子植物育种,2022,20(8):2586−2596. Zhang WJ,Lin L,Sun WJ. Advances of ammonium transporter AMT in tea plant (Camellia sinensis (L.) O. Ktze.)[J]. Molecular Plant Breeding,2022,20 (8):2586−2596.
[62] Kobae Y,Tamura Y,Takai S,Banba M,Hata S. Localized expression of arbuscular mycorrhiza-inducible ammonium transporters in soybean[J]. Plant Cell Physiol,2010,51 (9):1411−1415. doi: 10.1093/pcp/pcq099
[63] Pearson JN,Finnemann J,Schjoerring JK. Regulation of the high-affinity ammonium transporter (BnAMT1;2) in the leaves of Brassica napus by nitrogen status[J]. Plant Mol Biol,2002,49 (5):483−490. doi: 10.1023/A:1015549115471
[64] Couturier J,Montanini B,Martin F,Brun A,Blaudez D,Chalot M. The expanded family of ammonium transporters in the perennial poplar plant[J]. New Phytol,2007,174 (1):137−150. doi: 10.1111/j.1469-8137.2007.01992.x
[65] Von Wiren N,Lauter FR,Ninnemann O,Gillissen B,Walch-Liu P,et al. Differential regulation of three functional ammonium transporter genes by nitrogen in root hairs and by light in leaves of tomato[J]. Plant J,2000,21 (2):167−175. doi: 10.1046/j.1365-313x.2000.00665.x
[66] Bindel N,Neuhäuser B. High-affinity ammonium transport by Arabidopsis thaliana AMT1;4[J]. Acta Physiol Plant,2021,43 (4):69. doi: 10.1007/s11738-021-03235-z
[67] Sohlenkamp C,Wood CC,Roeb GW,Udvardi MK. Characterization of Arabidopsis AtAMT2,a high-affinity ammonium transporter of the plasma membrane[J]. Plant Physiol,2002,130 (4):1788−1796. doi: 10.1104/pp.008599
-
期刊类型引用(0)
其他类型引用(2)



 下载:
下载: