Application of metabonomics in regulation study of plant secondary metabolites
-
摘要:
代谢组学是继蛋白质组学和基因组学之后发展起来的新型学科,主要研究生物样本和器官小分子代谢产物,目前广泛应用于生物医学、食品科学、农业动植物学等领域。本文总结了代谢组学技术在植物次生代谢调控研究中的应用,对近5年代谢组学技术在植物热门领域的应用情况进行概括,以期为代谢组学在植物研究领域方面的进一步发展提供理论依据。
Abstract:Metabonomics is a new discipline that has emerged after proteomics and genomics, and is mainly applied to study biological samples and small molecule metabolites in organs. Currently, it is widely used in biomedicine, food science, agricultural zoology, botany, and other fields. This paper summarizes the application of metabolomics technology in the regulation of plant secondary metabolism as well as the research status of metabolomics in popular fields of plant research in the past five years to provide a theoretical basis for the further development of metabolomics research.
-
Keywords:
- Metabolomics /
- Botany /
- Secondary Metabolism /
- Difference
-
1999年,Nicholson等[1]提出了代谢组学(Metabonomics)的概念,认为代谢组学能够弥补基因组学和蛋白质组学所忽略的生物体的整个动态代谢状态,可以定量测定生命系统对病理生理刺激或基因修饰的动态多参数代谢反应。Fiehn[2]认为代谢组学可以定义为对限定条件下的特定生物样品中所有代谢组分的定性和定量,对代谢物进行全面定量的分析。该团队开创性地利用气相色谱-质谱联用(GC-MS)技术,自动定量了拟南芥(Arabidopsis thaliana (L.) Heynh)提取物中的326种代谢物,并确定了其中149个代谢物的化学结构[3]。
代谢组学技术是继蛋白质组和基因组学技术发展起来的新兴科学技术,是系统生物学的重要组成部分,在临床研究、天然产物化学等研究领域中有着举足轻重的作用。其采用高通量的色谱、质谱和核磁共振等技术对生物体代谢产物的多维数据信息与数学模型建立联系,从而实现对复杂代谢物的分析,建立完整的代谢网络[4]。同时,根据液相色谱质谱联用技术的固有特性,要求研究者使用多元变量统计方法对原始数据进行分析。与差异倍数分析、显著性检验等比较传统的单变量分析相比,多元变量统计分析,如无监督分析(主成分分析等)、监督分析(偏最小二乘判别分析等)等更加注重代谢物之间的关系,以及它们在生物过程中的促进/拮抗关系。
植物初生代谢与次生代谢产物成分复杂、种类繁多、体系庞大,传统分析方法很难检测出其所含的全部成分,代谢组学的出现能很好地解决农林业、天然产物业等领域的相关问题,如中药材或中药饮片中发挥主要疗效的活性成分的模糊性、未知性等问题[5]。代谢组学相关技术能够从根本上全方位地对天然植物所含的化学成分进行系统分析,从而获得活性物质的指纹图谱,通过多元统计分析对化学物质进行检测鉴定,从而获得该天然产物所含的化学成分种类,为其应用提供思路[6]。目前,代谢组学技术在植物表型评价、辅助育种、活性成分分析以及植物胁迫/抗逆分子机制研究等方面发挥着重要功能。
1. 代谢组学相关分析技术
1.1 代谢组学的技术分析平台
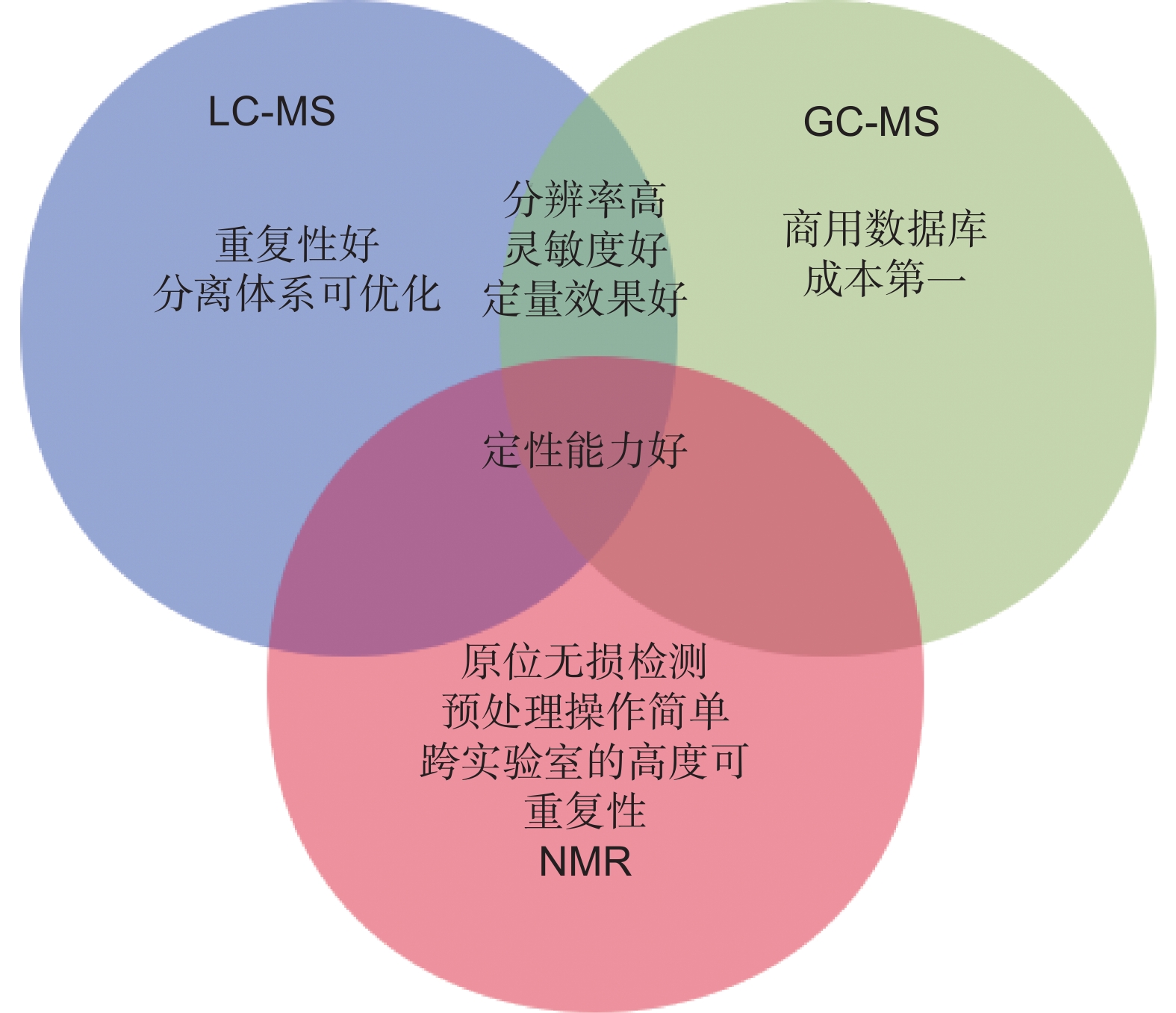
代谢组学的目标是整合广泛而复杂的数据信息集,通过可靠的技术平台,进行数据集成,并利用先进的生物统计方法,得到生物代谢过程中的动态变化和代谢通路的相关机制信息[7]。代谢组学实验旨在表征来自各种样品类型(如血清、细胞提取物、尿液等)的不同类别小分子,收集小分子样本,选择合适的平台进行分析。因其可靠性高,质谱(MS)和核磁共振(NMR)是目前代谢组学实验中最常用的技术,核磁共振光谱法操作简便,基于质谱的代谢组学方法则提供了一个高灵敏度与高选择性相结合的平台,两者在代谢组学分析中的优越性和适应性各具特色,具体如图1所示。
MS作为代谢组学中最常用的分析工具之一,具有灵敏度高 (通常是pg级)、可重复性好、多功能性强以及数据采集速度快等特点,能测量分子的质量,确定物质片段,可检测超过1000种内源性代谢物的特征,已成为极性和非极性小分子分析的领先技术。同时MS配合其他分离分析技术,更能适应对不同性质小分子代谢物的分析检测,如气相-质谱联用技术(GC-MS)可用于分析低沸点、低极性、易挥发的衍生物;而液相-质谱联用技术(LC-MS)可用于高沸点、热稳定性差的代谢物的分离分析,是目前在代谢组学领域应用范围较广的分析检测技术。同时,随着科学的发展,更高层次、高精度、高分辨率的分析检测技术如高效液相色谱-质谱联用技术与超高效液相色谱-质谱联用技术的问世,相比于LC-MS,具有灵敏度更高、峰容量更好、通量更高等优势。其次,用于检测离子型代谢物的毛细管电泳-质谱技术(CE-MS)已被证明是生物样品中极性代谢物分析的强大手段。超临界流体色谱-质谱联用技术(SFC-MS)相较于前述检测技术,可以对代谢组进行全面分析,提高了代谢组的覆盖率,并进一步提高了分析通量,在代谢组学领域具有光明的应用前景[8]。
NMR是近年来在代谢组学研究领域中能提供最丰富数据的优秀分析平台之一,在生命科学领域通常采用氢谱(1H NMR)、碳谱(13C NMR)及磷谱(31P NMR)[9],一维光谱学本质上是定量的,无需单独的代谢物标准品即可轻松用于代谢物定量,二维光谱最常用于鉴定代谢物,但也可以定量[10],其作为代谢组学研究的强大工具,可提供高度可重复的定量分析。虽然与MS和质谱相比,NMR的检测灵敏度较低,但可以提供直接定量、鉴定和简单的样品处理,且相较于MS检测过程中存在的基质干扰和离子化程度问题,NMR具有基本无偏倚性的特点,其对所有物质的检测灵敏度一致,同时,经过NMR技术检测过的样品基本无损伤,并可以设计多种编辑方法,使实验进行得更加灵活。
1.2 数据处理
1.2.1 数据预处理
代谢组学分析中使用各种分析平台,获取样品的代谢物数据,要从这些数据中提取有用的信息还需要进行一系列的数据处理,将原始数据转化为可用于进一步统计分析的形式。数据处理过程一般包括NMR或MS原始数据的获得、数据预处理(包含去噪、基线校正、去同位素、峰对齐、分箱、峰识别、均一化、数据缩放等)。通过数据库对质谱数据进行采集及目标化合物定性分析工作,通常GC-MS数据选择NIST数据库,LC-MS选择METLIN数据库或者Fiehn数据库等。然后,使用自撰写R程序包或相关软件结合自建数据库完成提峰、注释等工作。接着对原始数据进行准备和处理,最后进行数据标准化处理,对数据进行优化,获得代谢物列表。
1.2.2 统计分析
基于代谢组学数据算法框架应运而生的软件(如XCMS、MZmine 2),可用于对原始数据进行峰注释、峰对齐等相关处理,从而获得具有代谢物特征的数据模式,以便进行后续的数据挖掘和统计分析[11]。通过整理,可将枯燥的数据可视化,转化为更易分析的形式。利用数据处理软件获得需要的展现形式,如主成分分析图,能直观地表示组内差异及组间差异,判定数据质量如何,有没有离散样本,结果是否可信,且在后续分析中可以去掉离散样品,提高最终结果的可靠度[12]。偏最小二乘法分析图和正交偏最小二乘法分析图则采用变量重要性投影(VIP)值结合t检验P值对代谢物进行统计分析,以VIP > 1.2且P < 0.05为标准,进行组间差异代谢物的筛选[13]。数据处理的最后一步是对差异代谢物进行分析,通过各类代谢组学数据库对筛选的代谢物进行鉴定及通路分析,进行代谢物聚类,获得差异代谢物聚类热图等结果。
1.3 代谢组学联合分析
代谢组学联合其他组学研究模式在植物领域也已经广泛使用,为系统阐述植物相关作用机制提供了巨大帮助。目前已有转录组学-代谢组学联合分析、蛋白质组学-代谢组学联合分析、基因组学-代谢组学联合分析及微生物组学-代谢组学联合分析等。代谢组是生物体表型的直接体现者,代谢物是生物体的最终产物,是生物体表型的物质基础。结合基因组或转录组,从“原因”与“结果”两个角度,从不同层次对生物体的内在变化进行分析,鉴定关键基因靶点、代谢物及代谢通路,构建核心调控网络,能够系统地阐述植物体生长发育、疾病发生、中药材药效作用等机制,从整体上理解植物产生内源性变化的机理。
目前还出现了基于代谢物的全基因组关联分析(mGWAS)、数量性状位点关联分析(mQTL)、长非编码RNA关联分析(lncRNA)等研究手段。利用全谱代谢组检测队列样本的代谢组数据,基于SNP重测序、转录组测序数据等,把代谢物作为表型与基因型数据进行关联分析,有利于批量定位调控代谢物的候选基因,挖掘调控产量、品质和环境应答等相关代谢通路,深入了解植物代谢物合成调控的遗传机制,从而解释生物学问题。目前,联合分析技术已应用于植物发育时空代谢谱的解析以及植物应激反应机制解析等,在深入研究植物代谢合成调控机制中发挥了重要作用。
2. 代谢组学在植物次生代谢调控研究中的应用
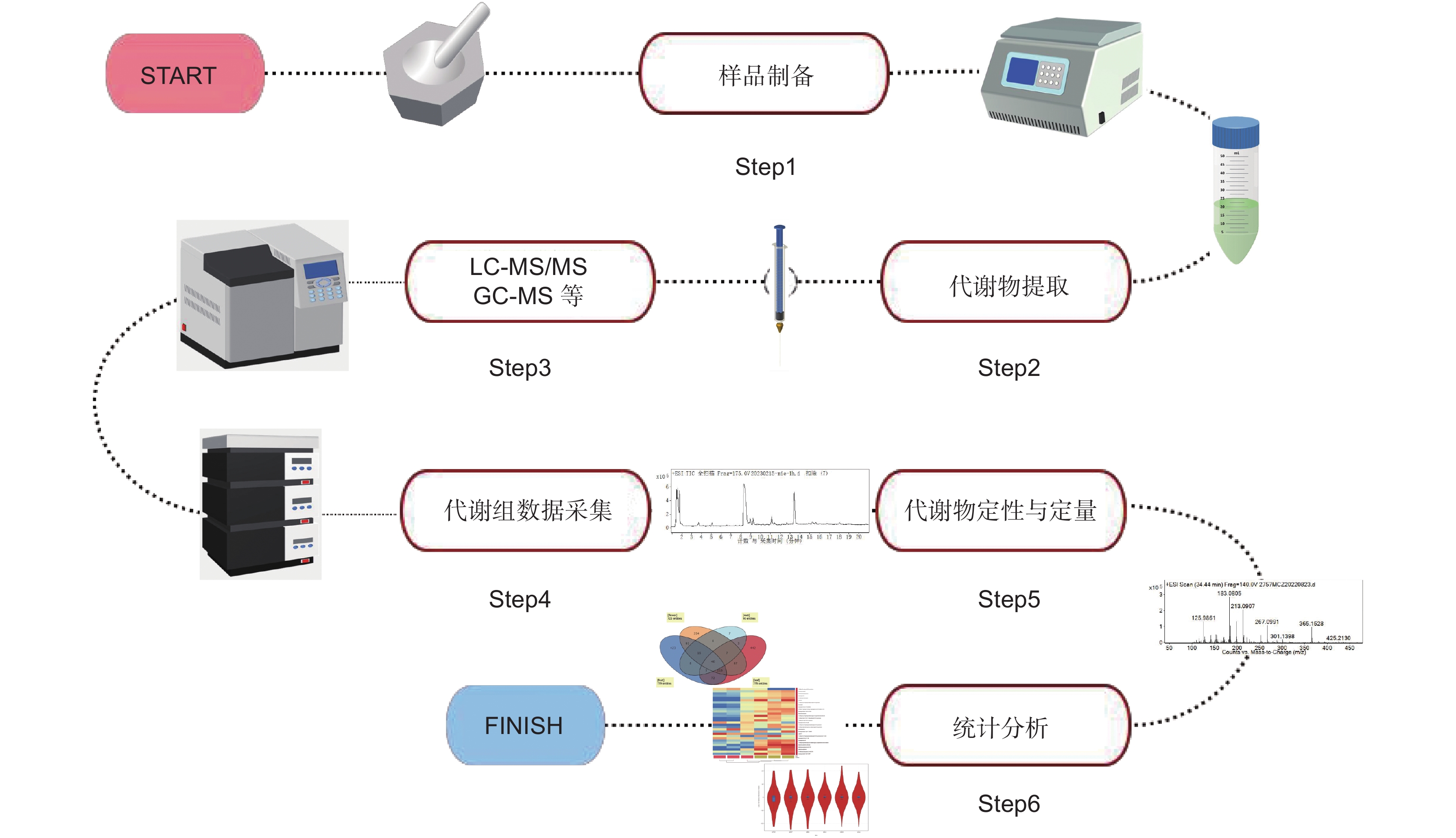
由于代谢组学技术所提供的众多优秀平台及数据整合分析系统,其在植物研究领域也发挥着极其重要的作用。各类植物所含的化学物质千变万化,具有多样性、不稳定性以及成分结构复杂等特点。因此,采用传统方法进行提取分离、纯化鉴定以及活性评价等准确性较低,且过程复杂,而代谢组学技术能够进行高通量检测、鉴定、定量以及代谢通路分析,可用于捕获植物化学复杂性的快照,能够快速测量其累积的植物化学物质,并揭示其代谢特征与响应遗传或环境变化的潜在关系[14],植物代谢组分析流程见图2。
2.1 环境胁迫相关研究
2.1.1 生物胁迫相关研究
代谢组学技术被越来越多地用于研究更全面的植物-病原菌相互作用机制。植物在生长发育过程中,会遭受到有害生物的侵染,如细菌、真菌、病毒、线虫等。在受到病原生物侵染时,植物可以通过调节体内的代谢反应,产生一系列的初、次级代谢产物。通过代谢组学技术分析病菌入侵前后代谢物谱图之间的差异,可以分析物质的变化,从而寻找抗病相关的代谢物,同时有效识别参与代谢过程的重要基因[15],这些抗病代谢物或基因可能给植物抗性育种带来新的研究思路和方向。
代谢组学技术已经用于分析核桃(Juglans regia L.)[16]、红枣(Ziziphus jujuba Mill.)[17]、柑橘(Citrus reticulata Blanco)[18, 19]、藜麦(Chenopodium quinoa Willd.)[20]、小麦(Triticum aestivum L.)[21, 22]、人参(Panax ginseng C. A. Meyer)[23]、葡萄(Vitis vinifera L.)[24]的防御机制,并揭示了防御过程中的重要反应,相关研究见表1。这些研究加深了对植物抗病虫害相关机制的理解,也为后期开发天然抗性药物提供了参考。
表 1 植物生物胁迫代谢组研究列表Table 1. List of metabolomics studies related to plant disease control物种
Species侵染病害
Infectious disease相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference核桃
Juglans regia L.胶孢炭疽菌 花青素B1/2/3、咖啡酸、没食子酸、柚皮素等 探讨了炭疽菌的发生机制 [16] 红枣
Ziziphus jujuba Mill.链格孢菌、细极链格孢菌 链格孢酚、细交链孢菌酮酸;天冬氨酸、甲硫氨酸和赖氨酸 阐释了黑斑病变过程中链格孢毒素的产生机理 [17] 柑橘
Citrus reticulata Blanco柑橘绿霉菌 糖类、脂质、有机酸 揭示柑橘采后绿脓杆菌的侵染机制 [18] 藜麦
Chenopodium quinoa Willd.霜霉病菌 蔗糖、生物胺、天冬氨酸、ɣ-氨基丁酸等氨基酸 揭示了毒素产生机理 [20] 小麦
Triticum aestivum L.禾谷镰刀菌 氨基酸 优化代谢物提取方法,探究染菌发生机制 [21] 小麦
Triticum aestivum L.腥黑粉菌 葫芦酸、十八碳三烯酸 揭示了籽粒腥黑穗病菌侵染前后代谢谱差异 [22] 柑橘
Citrus reticulata Blanco黄龙病 氨基酸、植物激素、嘌呤、水杨酸 证明了耐黄龙病品种的抗性策略 [19] 人参
Panax ginseng C. A. Meyer人参锈根症状 木质素、脂质、生物碱 揭示了病害的潜在分子机制 [23] 葡萄
Vitis vinifera L.中华蚱蜢、灰葡萄孢菌 脯氨酸等氨基酸、天冬氨酰-L、谷胱甘肽和一些脂肪酸 揭示了代谢组水平的复杂网络调控 [24] 植物在生长过程中不可避免地会遭受到多种自然灾害的危害,其中病虫害尤为普遍和严重,可能会使植株生长发育不良,严重的还可造成植株品种退化、植物死亡等,影响农业、林业及药材行业的经济效益和社会效益。而代谢组学技术在预防病虫害、掌握植物发病机理、研发防治病虫害药物方面发挥着巨大作用。
2.1.2 植物非生物胁迫代谢组研究
植物在生长发育过程中会受到生物(如真菌、细菌、虫害等)以及非生物的胁迫,非生物胁迫主要是环境带来的,包括光照、水分、盐分、紫外线、重金属、温度等因素。植物也会根据当前的应激条件对代谢网络进行配置,维持必要的代谢,采用新的稳态来适应逆境[25]。逆境胁迫下代谢组的重塑很大程度上反映了植物体对逆境胁迫的响应和防御,而代谢组学技术为研究不同逆境胁迫下代谢物的重塑提供了可靠手段。
在植物栽培繁育方面,工作人员需要从土壤特性、光照习性、温度等方面考虑植物生长发育的适宜性。而土壤中的化学元素会影响植物发育,如盐分能抑制不喜盐植物的生长。利用代谢组学技术可探究植物对盐的响应机制[26-28],为提高植物的抗盐能力奠定基础。同时随着农业环境的恶化,土壤中的重金属元素超标,如铅[25]等对植物的生长发育造成了严重的干扰,揭示植物对重金属胁迫的耐受策略就显得十分重要。除此之外,代谢组学技术对于植物所受的水分[29]、温度[30, 31]等其他非生物胁迫也可起到分析、监测的作用,相关研究见表2。
表 2 植物非生物胁迫代谢组研究列表Table 2. List of metabolomics studies related to plant abiotic stress物种
Species非生物胁迫因素
Abiotic stress factors相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference蓝莓 Vaccinium spp. 盐 甘氨酸、苹果酸、十八烷酸、L-苏糖酸等 耐盐性机理 [26] 水稻 Oryza sativa L. 铅 脂质、类二十烷酸 根际微环境与重金属胁迫耐受性 [25] 白刺 Nitraria tangutorum Bobr. 盐 氨基酸、糖、脂肪酸 白刺对盐胁迫的代谢响应 [27] 党参 Codonopsis pilosula (Franch.) Nannf. 干旱 脂类、糖类 干旱胁迫后产物 [29] 黑麦草 Lolium perenne L. 盐 糖类、氨基酸及其中间代谢物 耐盐代谢通路 [28] 早熟禾 Poa annua L. 低温 糖和糖醇、氨基酸、有机酸 适应低温的主要机制 [30] 橡胶树 Hevea brasiliensis (Willd. ex A. Juss.)Muell. 低温 糖类、氨基酸、脂质类 低温胁迫代谢物响应机制 [31] 2.2 自身因素
代谢组学技术在植物研究中的应用包括但不限于探究植物的代谢途径和代谢网络、环境对植物化学成分的影响、植物化学成分的作用及相关价值等方面。我国横跨寒带、温带、亚热带等气候类型,且地貌丰富,因此物种丰富度高,植物种类多样。不同种属植物或同种植物在不同生长环境、不同组织、不同发育阶段其所含代谢物差异明显,从而造成植物表型的差异,植株的功能也会发生改变。对于中医药产业来说,中药材的化学成分发生变化,在临床上可能会产生不同的疗效。代谢组学技术的出现弥补了中医药行业无法可视化的短板,有助于推动中医药行业的可持续发展,以及向国际化发展。同时,为了寻找植株产生差异的原因,促进植物资源的可持续利用及绿色发展,需要对该方面进行深层次的研究,新兴的代谢组学技术结合其他组学技术已经在该领域做出了重要贡献,具体内容见附表1
1 )。2.2.1 品种代谢物差异
植物代谢组学通过对代谢物的全面分析,可以鉴别农作物、树木以及中药材,结合多元统计分析,还可进一步进行质量控制。在代谢组学分析中,无监督分析能够最大程度地保留数据的原始状态,适合分析差异较小的品种。监督型分析适合差异较大的物种鉴别。不同种属的植物,其化学成分、品质、活性、药性等不同,且对周围环境产生的作用各异,因此,植物种属鉴定对于后续的应用至关重要。
在农业、林业、中药材等行业中,尤其是中药材行业,假冒伪劣产品防不胜防,除去人为因素,同种中药材,商品规格、品种等不同也会造成产品的差异性。如中药皂荚(Gleditsia sinensis Lam.)[32]、忍冬(Lonicera japonica Thunb.)[33]、百合(Lilium)[34]、柴胡(Bupleurum)[35]、黄精属(Polygonatum)[36]、人参属(Panax)[37]等植物均有两种及以上药材选择,每种药材的表型性状及其代谢物、功效等存在一定的差异,这就需要对其进行质量控制。代谢组学技术在区分不同种属药材、质量控制以及临床应用方面已较为成熟,且得到广泛应用。Jiang等[38]对5个品种荔枝(Litchi chinensis Sonn.)中所含的多酚类物质进行了代谢组学研究,结果发现品种间差异显著,且品种成熟度与酚类物质的组成及含量存在一定的相关性。同时,代谢组学技术对不同茶叶品种[39,40]及其所含活性物质等方面、农作物栽培育种、功能活性、营养价值评价研究[41-45]等方面也提供了支持。
2.2.2 组织代谢物差异
对于植物整体而言,不同组织[46, 47]的代谢物、功效等存在差异,将一种材料与其突变体或基因改造植物的代谢产物进行比较,对于筛选优良品种或基因、评价基因改造效果及进行相关功能基因组学研究有重要意义。
2.2.3 环境引起的代谢物差异
植物的生长繁衍需要特定的环境条件,不同的环境因子对植物物种的空间分布具有一定的影响,植物的组成和分布是环境与植物相互作用的结果[48]。环境因子如营养条件、地理位置、种植方式等的差异,会造成植物体初生及次生代谢的差异;环境因素如施肥条件[49, 50]、种植密度[51]、栽培环境[52, 53]以及产地[54, 55]等也会影响植株的代谢物、代谢水平以及代谢途径。代谢组学与多元统计分析相结合,可在环境造成的植物代谢物差异性研究方面提供新的方法与手段,促进资源的合理利用。
2.2.4 不同发育阶段的代谢物差异
植物从种子到植株的整个生长发育阶段,体内的代谢物不断转化,化学物质经过不同生物合成途径转变成自身所需的成分。了解植株在整个生长发育过程中的动态变化,在植物育种,特别是药材良种培育方面极其重要。
比较不同发育阶段有助于确定最佳收获时间,提高农业经济效益,并可揭示生长发育阶段的调控机制以及活性物质的积累机制等。代谢组学技术已应用于植物种子萌发[56-59]、开花[60-62]、果实发育[63-65]等阶段的差异代谢物检测,以及活性物质基础、发育过程中的动态变化检测等方面。
利用代谢组学技术对植物次生代谢物的变化特征进行分析,找出植物自身变化与代谢物的联系,从而发掘出与表型相关的代谢产物,对于揭示植物病理变化、品种差异以及进行质量评价等领域的研究意义重大。
3. 小结与展望
代谢组学技术在植物研究领域中占据重要位置,植物的次生代谢物在不同领域也发挥着重要作用。因此,利用代谢组学技术对植物体内的次生代谢物进行定性定量,同时结合数据处理软件对植物整体进行相关分析,能够直观地掌握植株之间的差异性,揭示植物次生代谢途径,阐明代谢网络调控机制。近年来,代谢组联合其他组学技术在揭示植物生长发育、生物及非生物胁迫、色味变化、活性成分、作用机理以及合成通路等方面的研究中发挥了越来越重要的作用。已有最新报道展现了代谢组学联合其他组学技术在研究植物生物防治、自交不亲和机制、代谢物空间分布等方面的优势。
随着对天然产物研究的深入,揭示植物生长发育过程中的代谢物及其代谢途径越来越重要。但目前对天然产物的取样存样以及定性定量分析还存在瓶颈,相关数据库还不够完善,通过代谢组学数据库鉴定的代谢物和代谢通路还较少,代谢物识别能力较为有限。同时,目前代谢物质的判断方法也比较单一,代谢物的分布状态无法反映代谢途径的状态,非靶向的代谢组学技术只能对代谢物进行半定量,这些不足之处尚需攻克。植物代谢组学可以结合其他组学技术以及其他学科(如微生物学,环境资源学,药理学等),进行多方向的探索,将代谢物与微生物、环境因子、基因、蛋白质等相结合,以共同揭示植物生物学信息。相信组学联合技术将会成为今后植物研究领域的热点,使学者解决植物领域研究中的难题成为可能。
1 1)如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 植物生物胁迫代谢组研究列表
Table 1 List of metabolomics studies related to plant disease control
物种
Species侵染病害
Infectious disease相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference核桃
Juglans regia L.胶孢炭疽菌 花青素B1/2/3、咖啡酸、没食子酸、柚皮素等 探讨了炭疽菌的发生机制 [16] 红枣
Ziziphus jujuba Mill.链格孢菌、细极链格孢菌 链格孢酚、细交链孢菌酮酸;天冬氨酸、甲硫氨酸和赖氨酸 阐释了黑斑病变过程中链格孢毒素的产生机理 [17] 柑橘
Citrus reticulata Blanco柑橘绿霉菌 糖类、脂质、有机酸 揭示柑橘采后绿脓杆菌的侵染机制 [18] 藜麦
Chenopodium quinoa Willd.霜霉病菌 蔗糖、生物胺、天冬氨酸、ɣ-氨基丁酸等氨基酸 揭示了毒素产生机理 [20] 小麦
Triticum aestivum L.禾谷镰刀菌 氨基酸 优化代谢物提取方法,探究染菌发生机制 [21] 小麦
Triticum aestivum L.腥黑粉菌 葫芦酸、十八碳三烯酸 揭示了籽粒腥黑穗病菌侵染前后代谢谱差异 [22] 柑橘
Citrus reticulata Blanco黄龙病 氨基酸、植物激素、嘌呤、水杨酸 证明了耐黄龙病品种的抗性策略 [19] 人参
Panax ginseng C. A. Meyer人参锈根症状 木质素、脂质、生物碱 揭示了病害的潜在分子机制 [23] 葡萄
Vitis vinifera L.中华蚱蜢、灰葡萄孢菌 脯氨酸等氨基酸、天冬氨酰-L、谷胱甘肽和一些脂肪酸 揭示了代谢组水平的复杂网络调控 [24] 表 2 植物非生物胁迫代谢组研究列表
Table 2 List of metabolomics studies related to plant abiotic stress
物种
Species非生物胁迫因素
Abiotic stress factors相关代谢物
Related metabolites代谢组学分析
Metabolomics analysis参考文献
Reference蓝莓 Vaccinium spp. 盐 甘氨酸、苹果酸、十八烷酸、L-苏糖酸等 耐盐性机理 [26] 水稻 Oryza sativa L. 铅 脂质、类二十烷酸 根际微环境与重金属胁迫耐受性 [25] 白刺 Nitraria tangutorum Bobr. 盐 氨基酸、糖、脂肪酸 白刺对盐胁迫的代谢响应 [27] 党参 Codonopsis pilosula (Franch.) Nannf. 干旱 脂类、糖类 干旱胁迫后产物 [29] 黑麦草 Lolium perenne L. 盐 糖类、氨基酸及其中间代谢物 耐盐代谢通路 [28] 早熟禾 Poa annua L. 低温 糖和糖醇、氨基酸、有机酸 适应低温的主要机制 [30] 橡胶树 Hevea brasiliensis (Willd. ex A. Juss.)Muell. 低温 糖类、氨基酸、脂质类 低温胁迫代谢物响应机制 [31] -
[1] Nicholson JK,Lindon JC,Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica,1999,29 (11):1181−1189. doi: 10.1080/004982599238047
[2] Fiehn O. Combining genomics,metabolome analysis,and biochemical modelling to understand metabolic networks[J]. Int J Genom,2001,2 (3):155−168.
[3] Fiehn O,Kopka J,Dormann P,Altmann T,Trethewey RN,Willmitzer L. Metabolite profiling for plant functional genomics[J]. Nat Biotechnol,2000,18 (11):1157−1161. doi: 10.1038/81137
[4] 姚玲玲,柯昌强,刘佳,唐春萍,叶阳. 不同炮制程度中药饮片蜜炙甘草的次生代谢化学成分组学研究[J]. 药学学报,2021,56(5):1444−1452. Yao LL,Ke CQ,Liu J,Tang CP,Ye Y. Metabolomic investigation of secondary metabolites of prepared slices of Glycyrrhiza uralensis with different degrees of honey processing[J]. Acta Pharmaceutica Sinica,2021,56 (5):1444−1452.
[5] 王鑫梦,唐小涵,李盈瑶,普雪雪,周燕. 基于代谢组学与网络药理学分析牛筋果叶中潜在药用活性成分及机制研究[J]. 中国中药杂志,2021,46(14):3625−3632. Wang XM,Tang XH,Li YY,Pu XX,Zhou Y. An integrative metabolomics and network pharmacology method for exploring bioactive components and preliminary pharmacodynamics in medicinal parts of Harrisonia perforata[J]. China Journal of Chinese Materia Medica,2021,46 (14):3625−3632.
[6] 杨靖,许振鹏,刘艳,康立欣,杨炳友,匡海学. 基于代谢组学的补阴药药性研究[J]. 中草药,2021,52(10):2987−2995. Yang J,Xu ZP,Liu Y,Kang LX,Yang BY,Kuang HX. Research on property of Yin-tonifying herbs based on metabolomics[J]. Chinese Traditional and Herbal Drugs,2021,52 (10):2987−2995.
[7] Jang C,Chen L,Rabinowitz JD. Metabolomics and isotope tracing[J]. Cell,2018,173 (4):822−837. doi: 10.1016/j.cell.2018.03.055
[8] Van de Velde B,Guillarme D,Kohler I. Supercritical fluid chromatography - Mass spectrometry in metabolomics:past,present,and future perspectives[J]. J Chromatogr B,2020,1161:122444. doi: 10.1016/j.jchromb.2020.122444
[9] 戴宇樵,吕才有. 代谢组学技术在茶学中的应用研究进展[J]. 江苏农业科学,2019,47(2):24−28. Dai YQ,Lü YC. Research progress of application of metabolomics technology in tea science[J]. Jiangsu Agricultural Sciences,2019,47 (2):24−28.
[10] Sengupta A,Weljie AM. NMR Spectroscopy-Based metabolic profiling of biospecimens[J]. Curr Protoc Protein Sci,2019,98 (1):e98.
[11] Rinschen MM,Ivanisevic J,Giera M,Siuzdak G. Identification of bioactive metabolites using activity metabolomics[J]. Nat Rev Mol Cell Biol,2019,20 (6):353−367. doi: 10.1038/s41580-019-0108-4
[12] 张丽媛,代安娜,于润众,阮长青,李志江,张东杰. 基于代谢组学的黑龙江省不同产地大豆的代谢产物分析[J]. 现代食品科技,2021,37(6):287−295. Zhang LY,Dai AN,Yu RZ,Ruan CQ,Li ZJ,Zhang DJ. Analysis of metabolites of soybeans from different producing origins in Heilongjiang Province Based on metabonomics[J]. Modern Food Science and Technology,2021,37 (6):287−295.
[13] 周曼丽,俞赟丰,罗晓欣,兰晓栋,金梦雨,简维雄. 基于代谢组学技术的冠心病血瘀证不同进展阶段大鼠潜在生物标志物及代谢通路研究[J]. 中国中医药信息杂志,2022,29(1):73−79. Zhou ML,Yu YF,Luo XX,Lan XD,Jin MY,Jian WX. Study on potential biomarkers and metabolic pathways of rats in different progressive stages of coronary heart disease with blood stasis syndrome based on metabonomics technology[J]. Chinese Journal of Information on Traditional Chinese Medicine,2022,29 (1):73−79.
[14] Abdelhafez OH,Othman EM,Fahim JR,Desoukey SY,Pimentel-Elardo SM,et al. Metabolomics analysis and biological investigation of three Malvaceae plants[J]. Phytochem Anal,2020,31 (2):204−214. doi: 10.1002/pca.2883
[15] 赵利,钞建宾,郭捷,田海娇,高芬. 基于代谢组学技术的植物抗病相关代谢物研究进展[J]. 西北植物学报,2021,41(6):1071−1078. Zhao L,Chao JB,Guo J,Tian HJ,Gao F. Study on plant Resistance-related metabolites against pathogenic fungi based on metabolomics[J]. Acta Botanica Boreali-Occidentalia Sinica,2021,41 (6):1071−1078.
[16] 陈新,王敏,傅茂润,王贵芳,相昆,等. 核桃炭疽病发生相关的酚类物质代谢分析[J]. 林业科学,2021,57(10):71−80. Chen X,Wang M,Fu MR,Wang GF,Xiang K,et al. Metabolic analysis of phenolic compounds associated with walnut anthracnose[J]. Scientia Silvae Sinicae,2021,57 (10):71−80.
[17] 范盈盈,胡东强,张锐利,李晓龙,何伟忠,等. 黑斑病对新疆红枣营养成分的影响[J]. 食品科学,2020,41(8):303−307. Fan YY,Hu DQ,Zhang RL,Li XL,He WZ,et al. Effects of black spot disease on nutritional composition of red jujubes grown in Xinjiang[J]. Food Science,2020,41 (8):303−307.
[18] Yang QY,Qian X,Routledge MN,Wu XY,Shi Y,et al. Metabonomics analysis of postharvest citrus response to Penicillium digitatum infection[J]. LWT-Food Sci Technol,2021,152:112371. doi: 10.1016/j.lwt.2021.112371
[19] Suh JH,Tang XX,Zhang Y,Gmitter FG Jr,Wang Y. Metabolomic analysis provides new insight into tolerance of Huanglongbing in citrus[J]. Front Plant Sci,2021,12:710598. doi: 10.3389/fpls.2021.710598
[20] 赵丽娟,闫素月,史晓晶,尉俊海,张洪. 霜霉病菌侵染对藜麦叶片代谢的影响[J]. 植物病理学报,2021,51(3):334−339. Zhao LJ,Yan SY,Shi XJ,Wei JH,Zhang H. Downy mildew-infection changes the metabolism of quinoa leaves[J]. Acta Phytopathologica Sinica,2021,51 (3):334−339.
[21] Zhao PY,Gu SB,Han C,Lu YR,Ma CY,et al. Targeted and untargeted metabolomics profiling of wheat reveals amino acids increase resistance to Fusarium head blight[J]. Front Plant Sci,2021,12:762605. doi: 10.3389/fpls.2021.762605
[22] Ren ZY,Fang MK,Muhae-Ud-Din G,Gao HF,Yang YZ,et al. Metabolomics analysis of grains of wheat infected and noninfected with Tilletia controversa Kühn[J]. Sci Rep,2021,11 (1):18876−18876. doi: 10.1038/s41598-021-98283-3
[23] Bian XB,Zhao Y,Xiao SY,Yang H,Han YZ,Zhang LX. Metabolome and transcriptome analysis reveals the molecular profiles underlying the ginseng response to rusty root symptoms[J]. BMC Plant Biol,2021,21 (1):215. doi: 10.1186/s12870-021-03001-w
[24] Jia HR,Li T,Haider MS,Sadeghnezhad E,Pang QQ,et al. Comparative transcriptomic and metabolomic profiling of grapevine leaves (cv. Kyoho) upon infestation of grasshopper and Botrytis cinerea[J]. Plant Mol Biol Rep,2022,40 (3):539−555. doi: 10.1007/s11105-022-01336-8
[25] Tan B,Tan X,Liu C,Zeng Y,Li YH. Effects of lead stress on rice (Oryza sativa L. ) growth and metabolism in the rhizosphere microenvironment:the role of eicosanoid compounds[J]. Plant Growth Regul,2022,96 (3):483−495. doi: 10.1007/s10725-022-00802-3
[26] 高龙飞,贾斌,张卫华,李爱,李天杰,等. 盐胁迫下蓝莓叶片生理特性与代谢组学分析[J]. 植物生理学报,2022,58(1):155−164. Gao LF,Jia B,Zhang WH,Li A,Li TJ,et al. Physiological characteristics and metabonomics analysis of blueberry leaves under salt stress[J]. Plant Physiology Journal,2022,58 (1):155−164.
[27] 闫海冰,张慧芳,冯帆,于兆友,杨秀清. 2种白刺对盐胁迫的代谢响应机制[J]. 林业科学,2021,57(1):20−29. Yan HB,Zhang HF,Feng F,Yu ZY,Yang XQ. Metabolic response mechanism of two Nitraria species to salt stress[J]. Scientia Silvae Sinicae,2021,57 (1):20−29.
[28] 张彩峡,吴洪新,毕玉芬. NaCl胁迫下多年生黑麦草的代谢组学分析[J]. 中国草地学报,2020,42(4):62−72. Zhang CX,Wu HX,Bi YF. Metabonomics analysis of Lolium perenne under NaCl stress[J]. Chinese Journal of Grassland,2020,42 (4):62−72.
[29] 赵春旭,张然,牛奎举,朱瑞婷,王勇,等. 青海野生草地早熟禾响应低温胁迫的代谢组学研究[J]. 草地学报,2020,28(4):904−914. Zhao CX,Zhang R,Niu KJ,Zhu RT,Wang Y,et al. Metabonomics study of Qinghai wild Poa pratensis in response to low temperature stress[J]. Acta Agrestia Sinica,2020,28 (4):904−914.
[30] 毛常丽, 李玲, 杨湉, 李小琴, 张凤良, 等. 橡胶树‘云研77-4’无性系幼苗低温胁迫后的代谢组学分析[J/OL]. 分子植物育种, 2022: 1−16. (2022-03-24). http: //kns.cnki.net/kcms/detail/46.1068.S.20220322.2041.012.html. Mao CL, Li L, Yang T, Li XQ, Zhang FL, et al. The metabolomics analysis of the clone cultivar 'Yunyan 77-4' clone seedlings under low temperature stress[J/OL]. Molecular Plant Breeding, 2022: 1−16. (2022-03-24). http: //kns.cnki.net/kcms/detail/46.1068.S.20220322.2041.012.html.
[31] 原静静,孙晓琛,栗锦鹏,杜弢,王惠珍. 基于LC-MS的干旱胁迫下党参代谢组学分析[J]. 中国实验方剂学杂志,2021,27(23):145−152. Yuan JJ,Sun XC,Li JP,Du T,Wang HZ. Metabolomics analysis of Codonopsis pilosula under drought stress based on LC-MS[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27 (23):145−152.
[32] Xie HM,Wang HD,Chen BX,Lou J,Wang HM,et al. Untargeted metabolomics analysis to unveil the chemical markers for the differentiation among three Gleditsia sinensis-derived herbal medicines by ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Arabian J Chem,2022,15 (5):103762. doi: 10.1016/j.arabjc.2022.103762
[33] Liu RY,Deng J,Lin XL,Li YM,Lin Y,et al. Metabolomics reveals distinct metabolites between Lonicera japonica and Lonicera macranthoides based on GC-MS[J]. J Chem,2020,2020:6738571.
[34] Tang YC,Liu YJ,He GR,Cao YW,Bi MM,et al. Comprehensive analysis of secondary metabolites in the extracts from different lily bulbs and their antioxidant ability[J]. Antioxidants,2021,10 (10):1634. doi: 10.3390/antiox10101634
[35] Xia ZD,Liu X,Tong LG,Wang H,Feng ML,et al. Comparison of chemical constituents of Bupleurum marginatum var. stenophyllum and Bupleurum chinense DC. using UHPLC-Q-TOF-MS based on a metabonomics approach[J]. Biomed Chromatogr,2021,35 (9):e5133.
[36] Wang SQ,Li WN,Zhang XF,Li G,Li XD,et al. Metabolomics study of different germplasm resources for three polygonatum species using UPLC-Q-TOF-MS/MS[J]. Front Plant Sci,2022,13:826902. doi: 10.3389/fpls.2022.826902
[37] He YF,Cai HQ,Zhang HM,Ren ZH,Tang H,et al. A metabolomic study of Asian and American ginseng based on RRLC-QTOF/MS methods[J]. J Liq Chromatogr Relat Technol,2019,42 (13-14):452−458. doi: 10.1080/10826076.2019.1625371
[38] Jiang NH,Zhu HL,Liu W,Fan C,Jin F,Xiang X. Metabolite differences of polyphenols in different litchi cultivars (Litchi chinensis Sonn.) based on extensive targeted metabonomics[J]. Molecules,2021,26 (4):1181. doi: 10.3390/molecules26041181
[39] 高晨曦,郭义红,孙威江,陈志丹. 基于DNA条形码和代谢组学技术的闽南乌龙茶产品鉴别[J]. 应用与环境生物学报,2021,27(6):1645−1652. Gao CX,Guo YH,Sun WJ,Chen ZD. Identification of oolong tea in southern Fujian,based on DNA barcoding and metabonomics[J]. Chinese Journal of Applied and Environmental Biology,2021,27 (6):1645−1652.
[40] Zhou BX,Wang ZH,Yin P,Ma BS,Ma CQ,et al. Impact of prolonged withering on phenolic compounds and antioxidant capability in white tea using LC-MS-based metabolomics and HPLC analysis:comparison with green tea[J]. Food Chem,2022,368:130855. doi: 10.1016/j.foodchem.2021.130855
[41] Liang LJ,Li WB,Tian M,Pan JJ,Feng ZY. Metabolomic profiling of five hulless barley (Hordeum vulgare L. ) with different:study on the metabolite difference of five hulless barley with different colors based on metabonomics approach[J]. Genet Resour Crop Evol,2022,69 (5):1843−1853. doi: 10.1007/s10722-022-01345-2
[42] 钱广涛,李祥羽,周静雯,张蘅,李立新. 三种不同颜色藜麦籽粒中氨基酸及其衍生物的代谢组学分析[J]. 植物生理学报,2021,57(11):2192−2202. Qian GT,Li XY,Zhou JW,Zhang H,Li LX. Metabonomic analysis of amino acids and derivatives in three types of quinoa grains with different colors[J]. Plant Physiology Journal,2021,57 (11):2192−2202.
[43] 于润众,宗恩祥,张丽媛,张东杰. 基于GC-MS分析不同品种小米代谢产物及代谢途径[J]. 食品科学,2021,42(24):199−205. Yu RZ,Zong EX,Zhang LY,Zhang DJ. Analysis of metabolites and metabolic pathways in different varieties of foxtail millets (Setaria italica L.) based on Gas Chromatography-Mass spectrometry[J]. Food Science,2021,42 (24):199−205.
[44] 张丽媛,于英博,赵子莹,于润众,李志江,张东杰. 不同品种绿豆中代谢产物的分离鉴定及代谢机制分析[J]. 食品科学,2021,42(16):169−175. Zhang LY,Yu YB,Zhao ZY,Yu RZ,Li ZJ,Zhang DJ. Separation and identification of metabolites and metabolic mechanism in two cultivars of mung bean[J]. Food Science,2021,42 (16):169−175.
[45] Espichán F,Rojas R,Quispe F,Cabanac G,Marti G. Metabolomic characterization of 5 native Peruvian chili peppers (Capsicum spp. ) as a tool for species discrimination[J]. Food Chem,2022,386:132704. doi: 10.1016/j.foodchem.2022.132704
[46] Chen JY,Wang WT,Kong JQ,Yue YD,Dong YY,et al. Application of UHPLC-Q-TOF MS based untargeted metabolomics reveals variation and correlation amongst different tissues of Eucommia ulmoides Oliver[J]. Microchem J,2022,172:106919. doi: 10.1016/j.microc.2021.106919
[47] Li MX,Liu MY,Wang BY,Shi L. Metabonomics analysis of stem extracts from Dalbergia sissoo[J]. Molecules,2022,27 (6):1982. doi: 10.3390/molecules27061982
[48] 魏海燕. 喀斯特山区不同环境因子对兰科植物分布的影响研究 — 以花江大峡谷为例[J]. 农村经济与科技,2020,31(1):68−70. [49] 贲蓓倍,徐维红,邹德玉,牟美睿,杨仁杰,刘海学. 不同施肥条件下的小麦籽粒代谢组学研究[J]. 麦类作物学报,2021,41(2):212−219. Ben BB,Xu WH,Zou DY,Mou MR,Yang RJ,Liu HX. Study on metabonomics of wheat grain under different fertilization conditions[J]. Journal of Triticeae Crops,2021,41 (2):212−219.
[50] 宋吉玲,周祖法,闫静,陆娜,程俊文,等. 基于UPLC-MS/MS技术的代谢组学方法研究麸皮对杨树桑黄代谢的影响[J]. 菌物学报,2021,40(3):641−655. Song JL,Zhou ZF,Yan J,Lu N,Cheng JW,et al. Study of effects of bran on the metabolism of Sanghuangporus vaninii based on metabolomics of UPLC-MS/MS[J]. Mycosystema,2021,40 (3):641−655.
[51] Liu HJ,Gu HR,Ye C,Guo CW,Zhu YF,et al. Planting density affects Panax notoginseng growth and ginsenoside accumulation by balancing primary and secondary metabolism[J]. Front Plant Sci,2021,12:628294. doi: 10.3389/fpls.2021.628294
[52] 刘龙桀,吴可心,刁云飞,李中跃,穆立蔷. 基于GC-MS分析东北红豆杉野生种与栽培种的代谢差异[J]. 植物研究,2021,41(5):798−806. Liu LJ,Wu KX,Diao YF,Li ZY,Mu LQ. Metabolic differences between wild and cultivated species of Taxus cuspidata based on GC-MS[J]. Bulletin of Botanical Research,2021,41 (5):798−806.
[53] Huang HZ,Tan P,Li MQ,Tan QC,Gao JH,et al. Quality analysis combined with mass spectrometry imaging reveal the difference between wild and cultivated Phyllanthus emblica Linn.: from chemical composition to molecular mechanism[J]. Arabian J Chem,2022,15 (6):103790. doi: 10.1016/j.arabjc.2022.103790
[54] Wu X,Liu Y,Guo JQ,Wang JX,Li MZ,et al. Differentiating Pu-erh raw tea from different geographical origins by 1H-NMR and U-HPLC/Q-TOF-MS combined with chemometrics[J]. J Food Sci,2021,86 (3):779−791. doi: 10.1111/1750-3841.15624
[55] 张舒,王长远,冯玉超,盛亚男,富天昕,等. 气相色谱-质谱联用代谢组学技术分析不同产地稻米代谢物[J]. 食品科学,2021,42(8):206−213. Zhang S,Wang CY,Feng YC,Sheng YN,Fu TX,et al. Analysis of metabolites in rice produced in different regions by GC-MS-based metabonomics[J]. Food Science,2021,42 (8):206−213.
[56] Bi WW,Zhao GX,Zhou YT,Xia XY,Wang JS,et al. Metabonomics analysis of flavonoids in seeds and sprouts of two Chinese soybean cultivars[J]. Sci Rep,2022,12 (1):5541. doi: 10.1038/s41598-022-09408-1
[57] 李富恒,张晓雯,张永芳,于萍,张宏发. 不同发育阶段老山芹种子多组学联合分析[J]. 东北农业大学学报,2021,52(10):32−46. Li FH,Zhang XW,Zhang YF,Yu P,Zhang HF. Integration analysis on multiple omics of Heracleum moellendorffii Hance seeds at different developmental stages[J]. Journal of Northeast Agricultural University,2021,52 (10):32−46.
[58] Wu XY,Wang YL,Tang HR. Quantitative metabonomic analysis reveals the germination associated dynamic and systemic biochemical changes for Mung-Bean (Vigna radiata) seeds[J]. J Proteome Res,2020,19 (6):2457−2470. doi: 10.1021/acs.jproteome.0c00181
[59] 肖金玲,沈蒙,葛云飞,康子悦,王娟,等. 萌发绿豆中多酚类物质动态变化规律及其抗氧化活性的研究[J]. 中国粮油学报,2020,35(7):28−35. Xiao JL,Shen M,Ge YF,Kang ZY,Wang J,et al. Dynamic changes and antioxidant activity of polyphenols in germinated mung bean[J]. Journal of the Chinese Cereals and Oils Association,2020,35 (7):28−35.
[60] Li Y,Wang JH,Wang KT,Lyu S,Ren LY,et al. Comparison analysis of widely-targeted metabolomics revealed the variation of potential astringent ingredients and their dynamic accumulation in the seed coats of both Carya cathayensis and Carya illinoinensis[J]. Food Chem,2022,374:131688. doi: 10.1016/j.foodchem.2021.131688
[61] 潘媛,赵晓,陈大霞. 灰毡毛忍冬花不同发育阶段的转录组学与代谢组学研究[J]. 中国中药杂志,2021,46(11):2798−2805. Pan Y,Zhao X,Chen DX. Different development phase of transcription proteomics and metabolomics of flower of Lonicera macranthoides[J]. China Journal of Chinese Materia Medica,2021,46 (11):2798−2805.
[62] 吴晓婷,张泽超,王红霞,张志华. 不同发育时期核桃内果皮的差异代谢物分析[J]. 河北农业大学学报,2021,44(4):44−50. Wu XT,Zhang ZC,Wang HX,Zhang ZH. Analysis of different metabolites in the endocarp of walnut at different developmental stages[J]. Journal of Hebei Agricultural University,2021,44 (4):44−50.
[63] Lee MY,Seo HS,Singh D,Lee SJ,Lee CH. Unraveling dynamic metabolomes underlying different maturation stages of berries harvested from Panax ginseng[J]. J Ginseng Res,2020,44 (3):413−423. doi: 10.1016/j.jgr.2019.02.002
[64] Liu JG,Liu YQ,Jia M,Kang XD,Wang SM,et al. Association of enriched metabolites profile with the corresponding volatile characteristics induced by rice yellowing process[J]. Food Chem,2021,349:129173. doi: 10.1016/j.foodchem.2021.129173
[65] Pan Y,Zhao X,Wang Y,Tan J,Chen DX. Metabolomics integrated with transcriptomics reveals the distribution of iridoid and crocin metabolic flux in Gardenia jasminoides Ellis[J]. PLoS One,2021,16 (9):e0256802. doi: 10.1371/journal.pone.0256802
-
期刊类型引用(7)
1. 符梅,李桂花,罗文龙,骆善伟,郭巨先. 基于广泛靶向代谢组学的芋头代谢物和抗氧化酶活性的差异分析. 中国农学通报. 2025(06): 118-125 .  百度学术
百度学术
2. 邓煜,马正政,李正潇,侯佳. 基于代谢组学分析LED光质对山丹组培苗的生长代谢调控. 江苏农业科学. 2024(11): 150-159 .  百度学术
百度学术
3. 崔萌,段宝忠,程蕾,张满常,和福美,周萍. 基于近红外光谱结合化学计量学方法的山里红产地溯源分析. 中草药. 2024(14): 4897-4906 .  百度学术
百度学术
4. 申树林,李洪勋,黄兰,张昆鹏,朱勇,张龙,陈德慧,尹能文,曲存民,彭华伟,林叶春. 有机肥对烟叶次生代谢物影响分析. 安徽农业科学. 2024(20): 141-144+154 .  百度学术
百度学术
5. 贾延莎,张雪佳,谭宁华. 中药材中化学成分时空特异性的研究进展. 中草药. 2024(24): 8580-8588 .  百度学术
百度学术
6. 张凤,于翠,董朝霞,朱志贤,胡兴明,张成. 桑树代谢组学研究进展. 蚕业科学. 2024(06): 567-576 .  百度学术
百度学术
7. 武美卿,廖易,陆顺教,殷涵泰,余文刚,李崇晖. 基于广泛靶向代谢组学技术的不同花色秋石斛中花青素差异分析. 热带作物学报. 2023(11): 2167-2178 .  百度学术
百度学术
其他类型引用(8)
-
其他相关附件
-
DOCX格式
1 王梦迪 附表 1 点击下载(27KB)
-



 下载:
下载: