Research progress of UbiA membrane-bound aromatic prenyltransferases in plants
-
摘要:
UbiA膜结合型芳香族异戊烯基转移酶(Prenyltransferases,PT)可催化异戊烯基单元转移到芳香族母核上形成C-C(或C-O)键,在植物中参与合成重要的代谢产物,如泛醌、质体醌、叶绿素、生育酚等。植物中多种具有异戊烯基的芳香族次生代谢物也是该类酶作用的产物。异戊烯基的引入增加了天然产物结构多样性和生物活性。本文介绍了植物中UbiA家族的基本类型,归纳了57个已鉴定功能的与次生代谢物(类黄酮、香豆素、二苯乙烯等)合成相关的UbiA PTs底物选择性、催化特点及其与初生代谢相关PTs的系统发育关系,并对异戊烯基转移酶基因的挖掘策略,以及利用微生物代谢工程定向合成活性异戊烯基化合物的应用前景进行了展望。
Abstract:UbiA membrane-bound aromatic prenyltransferases (UbiA PTs) catalyze the transfer of prenyl moieties to aromatic acceptor molecules to form C-C or C-O bonds, and participate in the biosynthesis of important plant chemicals, including ubiquinone, plastoquinone, chlorophyll, and tocopherol. A variety of aromatic secondary metabolites with prenyl groups in plants are also products of this class of enzyme. The introduction of prenyl groups increases the structural diversity and biological activity of natural products. In this paper, we introduce the basic types of UbiA families in plants, summarize the substrate selectivity and catalytic characteristics of 57 UbiA PTs related to biosynthesis of secondary metabolites (flavonoids, coumarins, stilbenes), and discuss their phylogenetic relationship with primary metabolism-related PTs. We also discuss the exploration strategies of prenyltransferase genes and the application prospects of targeted synthesis of active prenylated compounds by microbial metabolic engineering.
-
Keywords:
- Prenyltransferases /
- Primary metabolism /
- Secondary metabolism /
- Biosynthesis
-
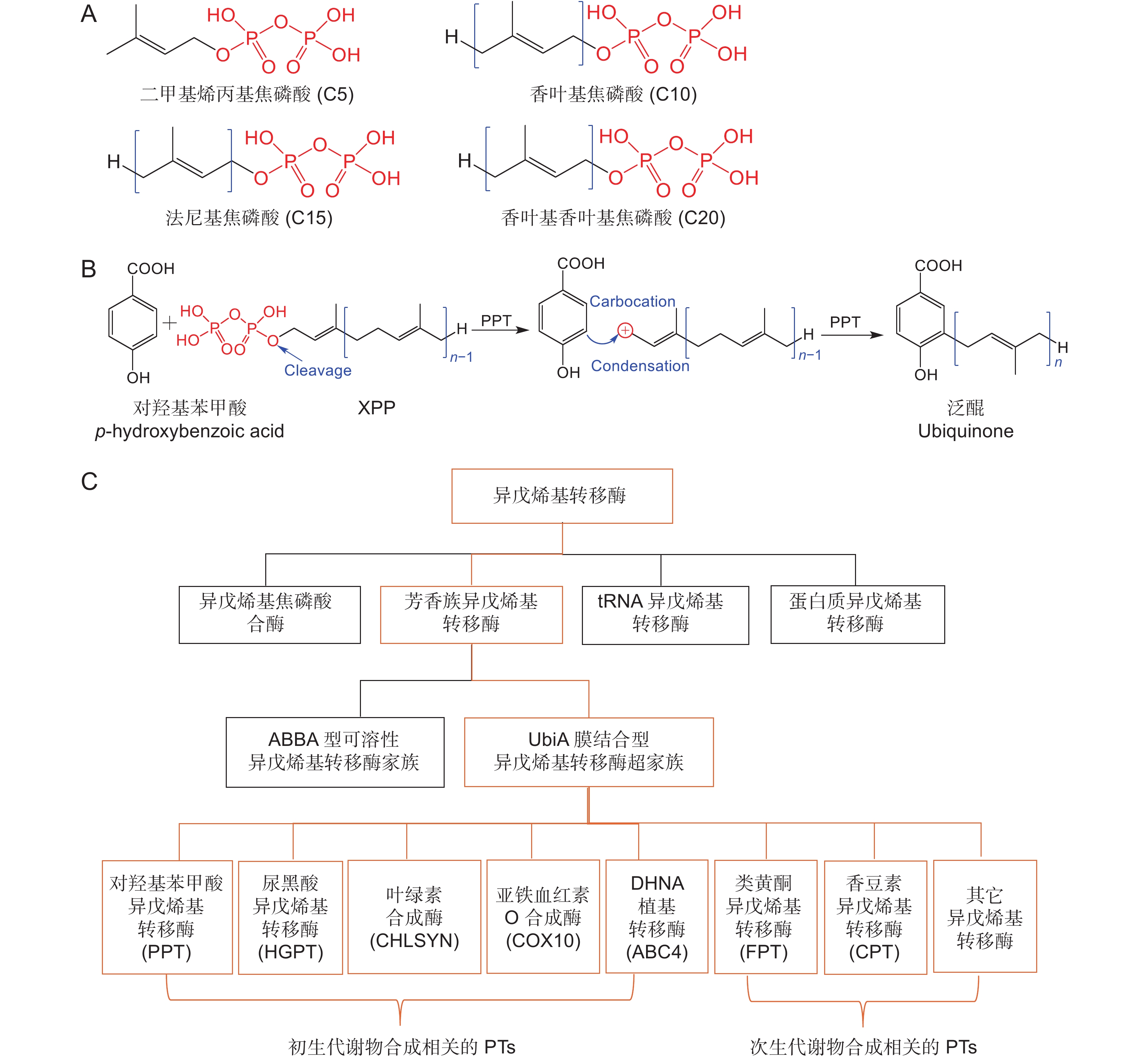
异戊烯基转移酶(Prenyltransferases,PTs)是生物体内负责催化异戊烯基化反应的一大类酶,其催化反应需要异戊烯基供体和受体。供体通常是异戊二烯焦磷酸(XPP,X代表不同长度的异戊烯基链),如二甲基烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP,C5)、香叶基焦磷酸(Geranyl diphosphate,GPP,C10)、法尼基焦磷酸(Farnesyl diphosphate,FPP,C15)和香叶基香叶基焦磷酸(Geranylgeranyl diphosphate,GGPP,C20)等[1](图1:A)。供体XPP上的二磷酸基团裂解产生异戊烯基末端的反应性碳正离子中间体,这种碳正离子与受体反应,发生类似于Friedel-Crafts芳香亲电取代机制的异戊烯基化[2](图1:B)。
![]() 图 1 UbiA异戊烯基转移酶的分类、一般催化机制和供体的结构式A:异戊二烯焦磷酸结构式;B:UbiA异戊烯基转移酶的一般催化机制;C:异戊烯基转移酶的分类。Figure 1. Classification and general catalytic mechanism of UbiA prenyltransferases and structural formula of isoprenyl diphosphatesA: Structural formula of isoprenyl diphosphates; B: General catalytic mechanism of UbiA superfamily prenyltransferases; C: Classification of prenyltransferases.
图 1 UbiA异戊烯基转移酶的分类、一般催化机制和供体的结构式A:异戊二烯焦磷酸结构式;B:UbiA异戊烯基转移酶的一般催化机制;C:异戊烯基转移酶的分类。Figure 1. Classification and general catalytic mechanism of UbiA prenyltransferases and structural formula of isoprenyl diphosphatesA: Structural formula of isoprenyl diphosphates; B: General catalytic mechanism of UbiA superfamily prenyltransferases; C: Classification of prenyltransferases.根据受体的不同,通常将异戊烯基转移酶分为以下4类:(1)以异戊二烯焦磷酸(Isopentenyl pyrophosphate,IPP)为受体的异戊烯基焦磷酸合酶(Prenyl diphosphate synthases),参与单萜(Monoterpenoids)、倍半萜(Sesquiterpenes)、二萜(Diterpenes)和类胡萝卜素(Carotenoids)等化合物的生物合成;(2)以芳香族化合物为受体的芳香族异戊烯基转移酶(Aromatic prenyltransferases),催化芳香族化合物与异戊烯基形成C-C(或C-O)键,生成具有生物学功能的化合物;(3)以多肽为受体的蛋白质异戊烯基转移酶(Protein prenyltransferases),它们在真核生物蛋白质翻译后修饰中起着重要的作用;(4)以核苷酸为受体的tRNA异戊烯基转移酶(tRNA prenyltransferases),参与tRNA的生物合成与修饰[1, 3](图1:C)。
芳香族异戊烯基转移酶广泛存在于植物、动物、真菌和细菌中,根据蛋白序列同源性及空间构象的不同,可将其分为两大类:UbiA膜结合型芳香族异戊烯基转移酶和ABBA型可溶性芳香族异戊烯基转移酶,后者主要来自于细菌和真菌[4](图1:C)。1972年,Young等[5]从大肠杆菌中分离鉴定第一个UbiA的基因,推测其功能为催化对羟基苯甲酸(p-hydroxybenzoic acid,PHB)与异戊烯基生成3-辛异戊烯基-4-羟基苯甲酸。此后,在植物和人类中发现了一系列具有与UbiA类似的功能,均为膜结合型蛋白,至少包含一个富含天冬氨酸的基序(如NQxxDxxxD),用于结合异戊二烯焦磷酸,它们的活性完全依赖于Mg2 + 或类似的二价阳离子[6],因此把具有这些特点的酶组成的家族称为UbiA异戊烯基转移酶超家族(UbiA superfamily)。目前已报道的植物来源的芳香族异戊烯基转移酶基因都属于UbiA超家族。
异戊烯基化修饰带来了植物代谢物的多样性,芳香环上的异戊烯基化的位置不同,异戊烯基链的长度不同,以及异戊烯基基团的进一步修饰,如环化和羟基化,导致产生大量结构类型各异的异戊烯基化合物[7]。这些代谢产物在许多植物的生长发育和抗病中发挥着不可或缺的作用[8, 9]。异戊烯基化修饰可以增加这些化合物的亲脂性,使化合物分子与生物膜的亲和力增强,从而可增加其生物利用度、改善药物代谢和药物动力学特性[10]。植物中的芳香族异戊烯基转移酶为膜结合型蛋白,基因克隆和外源表达具有一定的难度,且一般具有严格的底物特异性和空间位点专一性(一般只能催化一种类型的底物,且邻位有OH的位点更容易异戊烯基化)[11, 12],因此研究进展比较缓慢。根据底物的不同,植物芳香族异戊烯基转移酶可分为初生代谢相关的异戊烯基转移酶(Primary metabolite-related prenyltransferases,PMPTs)和与次生代谢相关的异戊烯基转移酶(也称为多酚类异戊烯基转移酶,Polyphenolic prenyltransferase,PHPTs)两大类(图1:C)。
本文系统介绍了植物中两类UbiA PTs,包括PMPTs和PHPTs,重点归纳了已鉴定功能的57个催化次生代谢物(类黄酮、香豆素、二苯乙烯等)的PHPTs的底物选择性和催化特点,分析了它们与PMPTs的系统发育关系,并对异戊烯基转移酶基因的挖掘策略,以及利用微生物代谢工程定向合成活性异戊烯基化合物的应用前景进行了展望。
1. 初生代谢物合成相关的异戊烯基转移酶
1.1 对羟基苯甲酸异戊烯转移酶(PPT)
对羟基苯甲酸异戊烯基转移酶(p-hydroxybenzoate polyprenyltransferase,PPT)以对羟基苯甲酸(PHB)为底物,将不同长度的异戊烯基基团(通常是30~50个碳)转移到PHB上合成泛醌(Ubiquinone,UQ)(呼吸链中的电子载体)[3]。拟南芥(Arabidopsis thaliana (L.) Heynh.)中的AtPPT1和水稻(Oryza sativa L.)的OsPPT1a,均可接受多种供体,如AtPPT1供体可以是茄尼基焦磷酸(Solanesyl diphosphate,SDP,C45)和GPP(C10),而底物严格为PHB[13, 14](附图1:A
1 )。在紫草(Lithospermum erythrorhizon Sieb. et Zucc.)中发现有些成员(LePGT-1和LePGT-2)以PHB为底物,仅可以GPP(C10)为供体,最终合成紫草素(Shikonin)(附图1:A)[15, 16]。此外,在软紫草(Arnebia euchroma(Royle)Johnst.)中鉴定的AePGT、AePGT4和AePGT6具有类似的功能[17]。
1.2 尿黑酸异戊烯基转移酶(HGPT)
尿黑酸异戊烯转移酶(Homogentisate prenyltransferase,HGPT)以尿黑酸(Homogentisate acid,HGA)为底物,称为尿黑酸异戊烯转移酶家族(HGPT family),根据异戊烯基供体的不同分为3种类型:尿黑酸植基转移酶(Homogentisate phytyltransferase,HPT,VTE2-1),供体为植基焦磷酸(Phytyl diphosphate,PDP,C20),合成生育酚(Tocopherol)的前体物质[18]。尿黑酸香叶基香叶基转移酶(Homogentisate geranylgeranyl transferase,HGGT),供体为GGPP(C20),合成生育三烯酚(Tocotrienol)的前体物质[19]。尿黑酸茄尼基转移酶(Homogentisate solanesyltransferase,HST,VTE2-2),供体为SDP(C45),合成质体醌(Plastoquinone)的前体[20](附图1:B)。
生育酚和生育三烯酚统称为维生素E。动物和人体不能合成维生素E,只能通过植物性食物摄入。因此鉴定农作物中参与维生素E生物合成的基因进行转基因改造提高维生素E含量也是目前代谢工程研究的热点[21]。
1.3 叶绿素合成酶(CHLSYN / ATG4)
叶绿素是高等植物进行光合作用的主要色素,叶绿素合成酶(Chlorophyll synthases,CHLSYN,ATG4)可以催化脱植基叶绿素(Chlorophyllide)与PDP(C20)反应直接生成叶绿素(Chlorophyll)(附图1:C),也可以通过间接的方式,先催化脱植基叶绿素与GGPP(C20)反应生成香叶基香叶基叶绿素(Chlorophyllgg),再在香叶基香叶基焦磷酸还原酶的作用下生成叶绿素[22]。
1.4 亚铁血红素O合成酶(COX10)
亚铁血红素A(Heme A)属于细胞色素a。亚铁血红素O合成酶(Heme O synthase,HOS,COX10)催化FPP(C15)与亚铁血红素B(Heme B,血红素IX,Protoheme IX)反应,生成亚铁血红素O(Heme O),随后再生成亚铁血红素A(附图1:D)[23]。
1.5 DHNA植基转移酶(ABC4)
维生素K1(Vitamin K1)又称叶绿醌(Phylloquinone),主要存在于陆生植物和藻类中。DHNA植基转移酶(1,4-Dihydroxy-2-napthoic acid phytyltransferase,Aberrant chloroplast development 4,ABC4)催化PDP(C20)与1,4-二羟基-2-萘甲酸(1,4-Dihydroxy-2-napthoic acid,DHNA)反应,生成Demethylphylloquinone,进一步在甲基转移酶(MT)的作用下生成叶绿醌(附图1:E)[24]。
2. 次生代谢物合成相关的异戊烯基转移酶
2.1 类黄酮异戊烯基转移酶(FPT)
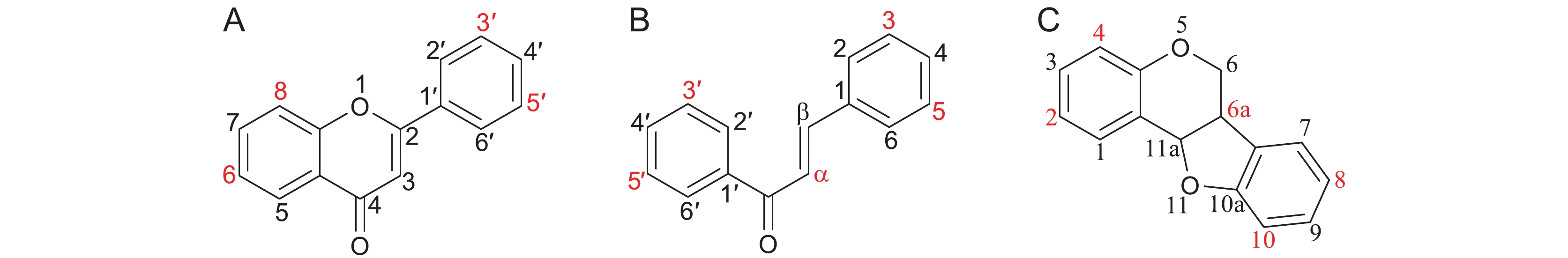
异戊烯基类黄酮是一类重要的植物次生代谢产物,其特点是在不同结构的黄酮类化合物母核的C-6、C-8、C-3′或C-5′位置上存在异戊烯基侧链,少数在C-7、C-2′位(紫檀烷类和查耳酮的取代位置相似,但是C编号不同)(图2)。该类化合物主要分布在豆科、桑科、大麻科、小檗科、菊科、芸香科和伞形科等植物中。异戊烯基类黄酮具有抗炎、抗菌、抗骨质疏松、抗肿瘤和雌激素样作用等活性,且异戊烯基侧链的不同结合位点、数量及结构类型决定了其生物活性的多样性[25, 26]。
类黄酮异戊烯基转移酶(Flavonoid prenyltransferase,FPT)是最早发现的植物PHPHs。植物中已鉴定出1000多种异戊烯基类黄酮[27-41],但迄今为止从植物中鉴定出的类黄酮异戊烯基转移酶只有23个,大部分具有严格的底物和供体特异性,催化活性依赖二价阳离子(表1)。在豆科中,以苦参(Sophora flavescens Alt.)和大豆(Glycine max (L.) Merr.)中发现的基因居多。2008年,从苦参中克隆得到了第一个植物类黄酮异戊烯基转移酶基因SfN8DT-1,该基因编码的蛋白催化DMAPP与柚皮素(Naringenin)结合,生成8-异戊烯基柚皮素(8-Prenylnaringenin)(附图2:A
2 )。此外,该酶可催化甘草素(Liquiritigenin)和橙皮素(Hesperetin)发生异戊烯基化反应,但表现出对二氢黄酮和DMAPP严格的底物和供体特异性[7]。Chen等[28]从苦参悬浮细胞培养液中鉴定出SfFPT,可催化多种结构类型的类黄酮底物(二氢黄酮、二氢查尔酮、二氢黄酮醇和黄酮),但对(2S)-二氢黄酮具有严格的立体异构特异性。表 1 植物类黄酮异戊烯基转移酶的催化特性Table 1. Catalytic properties of flavonoid prenyltransferases in plants物种名称
Species name蛋白名称
Protein name底物类型
Substrate type底物名称
Substrate name异戊烯基供体
Prenyl donor异戊烯基取代位点
Prenyl substitution site二价阳离子
Divalent cation参考文献
References苦参
Sophora flavescens Alt.SfN8DT-1 二氢黄酮 Liquiritigenin>Naringenin>
HesperetinDMAPP A环C-8位 Mg2 + [7] SfiLDT 查尔酮 Isoliquiritigenin DMAPP 未知 Mg2 + [33] SfG6DT 异黄酮 Genistein>Biochanina DMAPP、GPP1、FPP1 A环C-6位 Mg2 + >Ni2 + >
Mn2 + >Ca2 +[33] SfFPT 二氢查尔酮 Phloretin DMAPP、GPP2 A环C-3'位 Mg2 + >Ba2 + >Ca2 + >Fe2 + >Co2 + >Cu2 + >Zn2 + >Mn2 + [28] 二氢黄酮 Eriodictyol>Naringenin>
Pinocembrin>Liquiritigenin>
Hesperetin>Isosakuranetin>
Steppogenin>Tsugafolin>
SakuranetinA环C-8位 黄酮 Chrysin A环C-8位 二氢黄酮醇 Taxifolin A环C-8位 大豆
Glycine max (L.) Merr.GmG4DT 紫檀烷 Glycinol>Maackiain DMAPP A环C-4位 Mg2 + >Mn2 + >Co2 + [30] GmG2DT 紫檀烷 Glycinol DMAPP A环C-2位 Mg2 + >Mn2 + [29] GmPT01 紫檀烷 Glycinol DMAPP A环C-2位 Mg2 + [31] GmIDT1 异黄酮 Daidzein>Genistein DMAPP B环 Mg2 + >Mn2 + [29] GmIDT2 异黄酮 Daidzein≈Genistein DMAPP A环 Mg2 + >Mn2 + [29] GmIDT3 异黄酮 Daidzein、Genistein DMAPP 未知 Mg2 + [31] 白羽扇豆
Lupinus albus L.LaPT1 异黄酮 2-Hydroxygenistein>
GenisteinDMAPP B环C-3'位 Mg2 + >Mn2 + >Ni2 + >Co2 + >Zn2 + >Ca2 + [34] LaPT2 黄酮醇 Kaempferol>Kaempferide>Quercetin>Galangin>
Fesitin>MorinDMAPP A环C-8位 Mg2 + [12] 二氢黄酮 Naringenin DMAPP 未知 甘草
Glycyrrhiza uralensis Fisch.GuA6DT 黄酮 Apigenin>Chrysin>
Diosmtin>Luteolin>
Norartocarpetin>
ChrysoeroilDMAPP、GPP1 A环C-6位 Mg2 + >Mn2 + >Zn2 + >Fe2 + >Co2 + >Ca2 + >Ba2 + [11] GuILDT 查尔酮 2',4'-Dihydroxychalcone>
Isoliquiritigenin>
2,4,2',4'-Tetrahydro-xychalcone>
NaringeninchalconeDMAPP A环C-3'位 Mg2 + >Co2 + >Ni2 + >Fe2 + >Ba2 + >Mn2 + >Ca2 + [35] 百脉根
Lotus japonicus L.LjG6DT 异黄酮 Genistein DMAPP A环C-6位 Mg2 + >Co2 + >Mn2 + >Ca2 + >Zn2 + >Fe2 + [36] 补骨脂
Psoralea corylifolia (L.) Medik.PcM4DT 紫檀烷 Maackiain>3-Hydroxy-9-methoxypterocarpan DMAPP A环C-4位 Mg2 + >Mn2 + >Co2 + >Fe2 + >Ba2 + >Sr2 + >Ca2 + >Sn2 + >Ni2 + >Zn2 + [37] 桑
Morus alba L.MaIDT 查尔酮 Isoliquiritigenin>
2',4'-Dihydroxychalcone>
2,4,2',4'-Tetrahydroxychalcone>
ButeinDMAPP、GPP1 A环C-3'位 Mg2 + >Ba2 + >Ca2 + >Mn2 + >Fe2 + >Ni2 + [32] 异黄酮 Genistein>2'-Hydroxygenistein A环C-6位 黄酮 Apigenin A环C-6位 柘树
Cudrania tricuspidata (Carr.) Bur.CtIDT 查尔酮 Isoliquiritigenin>
2,4,2',4'-Tetrahydroxychalcone>
2',4'-Dihydroxychalcone>
ButeinDMAPP、GPP1 A环C-3'位 Mg2 + >Mn2 + >Ca2 + >Fe2 + >Ba2 + [32] 异黄酮 2'-Hydroxygenistein>
GenisteinA环C-6位 大麻
Cannabis sativa L.CsPT3 黄酮 Chrysoeriol>Apigenin DMAPP、GPP A环C-6位 Mg2 + [38] CsPT8 黄酮 Apigenin DMAPP 未知 Mg2 + [38] 啤酒花
Humulus lupulus L.HlPT-1 查尔酮 Naringenin chalcone DMAPP A环C-3'位 Mg2 + [39] 柔毛淫羊藿
Epimedium pubescens Maxim.EpPT8 黄酮醇 Kaempferol> Quercetin DMAPP A环C-8位 Mg2 + [40] 黄酮 Apigenin 箭叶淫羊藿
Epimedium sagittatum (Sieb. et Zucc.) Maxim.EsPT2 黄酮醇 Kaempferol>Kaempferide DMAPP A环C-8位 Mg2 + [41] 二氢黄酮 Naringenin 注:“>”用于表示对底物的催化活性顺序;1 研究只证明提供了该供体与最适底物发生异戊烯基化反应;2 GPP作为供体时,SfFPT仅催化pinocembrin,isosakuranetin和naringenin发生异戊烯基化反应。 Notes: “>” indicates order of catalytic activity to the substrate; 1 Prenylation of the donor with an optimal substrate is demonstrated; 2 SfFPT only catalyzed prenylation of pinocembrin, isosakuranetin, and naringenin when GPP was used as the prenyl donor. 大豆中的异黄酮类有一半以上具有异戊烯基取代,被认为是诱导型的植物防御素(Phytoalexins),如大豆抗毒素(Glyceollins)。GmG4DT和GmG2DT分别催化DMAPP与(−)-glycinol的C-2位和C-4位发生异戊烯基化反应,GmG4DT催化生成Glyceolin Ⅰ和Glyceollin Ⅵ的前体化合物4-dimethylallylglycinol,GmG2DT催化生成Glyceollin Ⅱ、Glyceollin Ⅲ和Glyceollin Ⅳ的前体化合物2-Dimethylallylglycino[29-31]。
桑(Morus alba L.)中的MaIDT和柘树(Cudrania tricuspidata (Carr.) Bur.)中的CtIDT是首次鉴定出来的非豆科FPTs,二者均可催化4种查尔酮的C-3′和两种异黄酮(Genistein和2′-Hydroxygenistein)的C-6位发生异戊烯基取代。而且发现MaIDT更偏向于查尔酮的异戊烯基化,而CtIDT更偏向于异黄酮的异戊烯基化[32]。
目前从植物中克隆并鉴定出的FPTs,大部分只能催化一种类型的类黄酮发生异戊烯基化反应,虽然SfFPT、MaIDT、CtIDT、LaPT2、EpPT8和EsPT2可催化两种及以上类型的类黄酮底物,但都对其中一种类黄酮结构催化活性强。大部分FPTs只可接受DMAPP为异戊烯基供体,少数可以接受GPP或FPP作为供体,但对DMAPP的催化效率最高。FPTs对不同结构的黄酮类化合物母核催化位点具有特异性,一种FPT只能催化底物的一个位点。
2.2 香豆素异戊烯基转移酶(CPT)
香豆素(Coumarin)广泛分布于植物中,在豆科、伞形科、桑科和芸香科尤为普遍[42]。根据其结构,可分为简单香豆素、呋喃香豆素、吡喃香豆素、双香豆素等。其中呋喃香豆素和吡喃香豆素为简单香豆素母核上C-6或C-8位的异戊烯基与7位酚羟基(7-OH)环合成呋喃或吡喃环,吡喃香豆素保留二甲基取代,呋喃香豆素后续又脱掉3个C。呋喃香豆素较为常见,具有抗肿瘤、抗氧化以及抗炎镇痛等多种药理活性[43]。
催化香豆素异戊烯基化反应的酶(Coumarins prenyltransferase,CPT)中最常见的是伞形酮异戊烯基转移酶(Umbelliferone dimethylallyltransferase,UDT),如伞形科欧芹(Petroselinum crispum (Mill.) Hill)中的PcPT,催化DMAPP转移到伞形酮的C-6和C-8位分别生成脱甲基软木花椒素(Demethylsuberosin,DMS)和欧芹酚(Osthenol),可进一步生成线型香豆素和角型香豆素[44](附图2:B);芸香科的柠檬(Citrus limon Burm. (L.) Burm. F.)中鉴定出的ClPT1只接受GPP为异戊烯基供体,催化伞形酮的C-8位 [45]。桑科的无花果(Ficus carica L.)中发现的FcPT1只接受DMAPP为异戊烯基供体,催化伞形酮的C-6位[46](表2)。
表 2 植物中香豆素异戊烯基转移酶的催化特性Table 2. Catalytic properties of coumarin prenyltransferases in plants物种名称
Species
name蛋白名称
Protein name底物名称
Substrate name异戊烯基
供体
Prenyl donor异戊烯基取代位点
Prenyl substitution
site二价阳离子
Divalent cation参考文献
References欧芹Petroselinum crispum (Mill.) Hill PcPT Umbelliferone DMAPP C-6位>C-8位 Mg2 + [44] 欧防风Pastinaca sativa L. PsPT1 Umbelliferone DMAPP C-6位>C-8位 Mg2 + [42] PsPT2 Umbelliferone DMAPP C-8位>C-6位 Mg2 + [42] 柠檬Citrus limon (L.) Burm. F. ClPT1 Umbelliferone>Esculetin>5,7-hydroxycoumarin
>5-Methoxy-7-hydroxycoumarinGPP C-8位 Mg2 + [45] 无花果Ficus carica L. FcPT1 Umbelliferone DMAPP C-6位 Mg2 + [46] 5-Methoxy-7-hydroxycoumarin DMAPP 未知 Mg2 + 葡萄柚Citrus paradisi Macf. CpPT1 5,7-Dihydroxycoumarin, 8-Hydroxybergapten 5-Hydroxy-7-methoxycoumarin, Bergaptol, GPP 5-OH或8-OH Mg2 + >Ni2 + >Co2 + >Mn2 + >Zn2 + >Ca2 + [47] CpPT3 Umbelliferone GPP C-8位 Mg2 + [47] 小苦橙Citrus micrantha Wester CmiPT1a / b Bergaptol和Xanthotoxol GPP 5-OH或8-OH Mg2 + [47] 明日叶Angelica keiskei (Miquel) Koidz. AkPT1 Bergaptol和Xanthotoxol DMAPP 5-OH或8-OH Mg2 + >Mn2 + >Ca2 + [47] 大豆Glycine max (L.) Merr. GmC4DT Coumestrol DMAPP C-4位 Mg2 + >Mn2 + [29] 九里香Murraya exotica L. MePT1 Umbelliferone GPP C-8位、C-6位和7-OH Mg2 + [48] 植物中还存在大量的O-异戊烯基化合物,直到2021年才从芸香科的葡萄柚(Citrus paradisi Macf.)中鉴定出第一个O-异戊烯基转移酶CpPT1,该酶可以催化GPP转移到香豆素的5-OH或8-OH上,形成O-异戊烯基香豆素(附图2:C)。从小苦橙(Citrus micrantha Wester)中得到两个与CpPT1相似度为98%的基因:CmiPT1a和CmiPT1b,可以催化GPP与Bergaptol和Xanthotoxol反应。此外,还从伞形科的明日叶(Angelica keiskei (Miquel) Koidz.)中鉴定出一个O-异戊烯基转移酶AkPT1,该酶可以催化DMAPP与Bergaptol和Xanthotoxol反应[47]。
Li等[48]在芸香科植物九里香(Murraya exotica L.)中得到两个新的PTs:MePT1催化GPP转移到伞形酮的骨架上,同时生成3种化合物:8/6-C-geranylumbelliferone和少量的7-O-geranylumbelliferone;MePT2催化DMAPP转移到喹诺酮类生物碱N-methylquinolone的C-3位生成C-异戊烯基化合物。这是首次报道植物PT同时催化产生C-和O-异戊烯基化合物,并且利用喹诺酮类生物碱作为异戊烯基受体。
呋喃香豆素和吡喃香豆素在植物中分布广泛,已经在部分植物发现UDT催化伞形酮的异戊烯基化反应是角型和线型呋喃香豆素形成的第一步。香豆素O-异戊烯基转移酶基因的发现,为更多的O-异戊烯基转移酶的鉴定工作奠定基础。
2.3 其它次生代谢物合成相关的异戊烯基转移酶
大麻科中的啤酒花(Humulus lupulus L.)雌花序是生产啤酒的基本原料,间苯三酚衍生物(包括α-苦味酸(律草酮Humulone)、β-苦味酸(蛇麻酮Lupulone)和黄腐酚(Xanthohumol,XN))为啤酒风味物质。Tsurumaru等[39]从啤酒花鉴定出的HlPT-1,可以催化DMAPP与Phlorisovalerophenone(PIVP)、Phlorisobutyrophenone(PIBP)和 Phlormethylbutanophenone(PMBP)反应。HlPT-1催化一个异戊烯基基团转移到PIVP上,这是苦味酸生物合成的第步异戊烯基化反应。HlPT-1还可催化DMAPP与柚皮素查尔酮(Naringenin chalcone)反应,生成Desmethylxanthohumol,可进一步合成黄腐酚。Li等[49]从啤酒花栽培品“Nugget”中克隆得到两个芳香族异戊烯基转移酶基因,其中一个基因与HlPT-1的一致性为98.5%,命名为HlPT1-like(HlPT1L),另一个基因命名为HlPT2。在包含上游基因的优化的酵母系统中,HlPT1L和HlPT2共表达可高效地催化苦味酸合成途径的异戊烯基化反应,并揭示出在β-苦味酸生物合成中,HlPT1L催化第1步异戊烯基化反应,而HlPT2负责第2和第3步异戊烯基化反应。研究表明,HlPT1L与HlPT2能够相互作用,形成异源二聚体或多聚体,这是首次在植物中发现了芳香族异戊烯基转移酶形成复合物,催化多步连续的异戊烯基化反应。
氧杂蒽酮(Xanthone)在植物中具有抗病原微生物和防御食草动物的作用。Fiesel等[50]从冬绿金丝桃(Hypericum calycinum L.)中鉴定出的氧杂蒽酮异戊烯基转移酶HcPT,催化DMAPP与1,3,6,7-Tetrahydroxyxanthone(1367THX)反应生成1,3,6,7-Tetrahydroxy-8-prenylxanthone(8PX)。Nagia等[51]从冬绿金丝桃和元宝草(H. sampsonii Hance)中鉴定出4个氧杂蒽酮异戊烯基转移酶:HcPT8px、HcPTpat、HsPT8px和HsPTpat,HcPT8px和HsPT8px主要可以催化DMAPP与1367THX反应生成8PX,HsPT8px进一步可以催化DMAPP与8PX反应生成少量的Patulone,而HcPTpat和HsPTpat可催化两个DMAPP直接与1367THX反应生成Patulone,也可催化8PX生成Patulone(附图2:D)。
二苯乙烯类化合物(Stilbenoids)是植物抗毒素中最常见的一种,也具有心脏保护、抗炎以及神经保护等广泛的活性[52]。Yang等[53]从豆科植物落花生(Arachis hypogaea L.)中发现了AhR4DT-1和AhR3'DT-1 / 2 / 3 / 4,AhR4DT-1可催化DMAPP与白藜芦醇(Resveratrol)、白皮杉醇(Piceatannol)和赤松素(Pinosylvin)的C-4位反应(附图2:E),还可以催化氧化白藜芦醇(Oxyresveratrol),但催化位点不确定。AhR3′DT-1催化白藜芦醇C-3′位异戊烯基化,以及白皮杉醇和氧化白藜芦醇(催化位点不确定),但不能催化赤松素的异戊烯基化。Zhong等[54]从桑中鉴定得到MaOGT主要催化GPP转移到氧化白藜芦醇的C-4位,对白藜芦醇也有微弱的催化活性。此外,MaOGT还可以接受DMAPP、FPP、IPP和GGPP作为异戊烯基供体,催化氧化白藜芦醇生成少量的产物。
Munakata等[55]从茵陈蒿(Artemisia capillaris Thunb.)里发现一个参与苯丙烷生物合成的异戊烯基转移酶AcPT1,该酶可催化DMAPP与对香豆酸(p-Coumaric acid)反应,生成两种产物Drupanin和Artepillin C。此外,实验证明该酶可接受Drupanin作为底物,生成Artepillin C(附图2:F),说明AcPT1逐步转移两个异戊烯基(DMAPP)到对香豆酸羟基的邻位,Drupanin是一种中间产物。
Saeki等[56]从兴安杜鹃(Rhododendron dauricum L.)发现的RdPT1,特异识别Orsellinic acid(2,4-Dihydroxy-6-methylbenzoic acid)作为底物,而对异戊烯基供体的特异性较低,可以高效的催化FPP与底物反应生成Grifolic acid,还接受GPP和GGPP以中等效率合成Grifolic acid类似物。Luo等[57]从大麻(Cannabis sativa L.)中发现的CsPT4可以催化Olivetolic acid(2,4-Dihydroxy-6-pentylbenzoic acid)与GPP反应生成大麻酚酸Cannabigerolic acid(CBGA)。
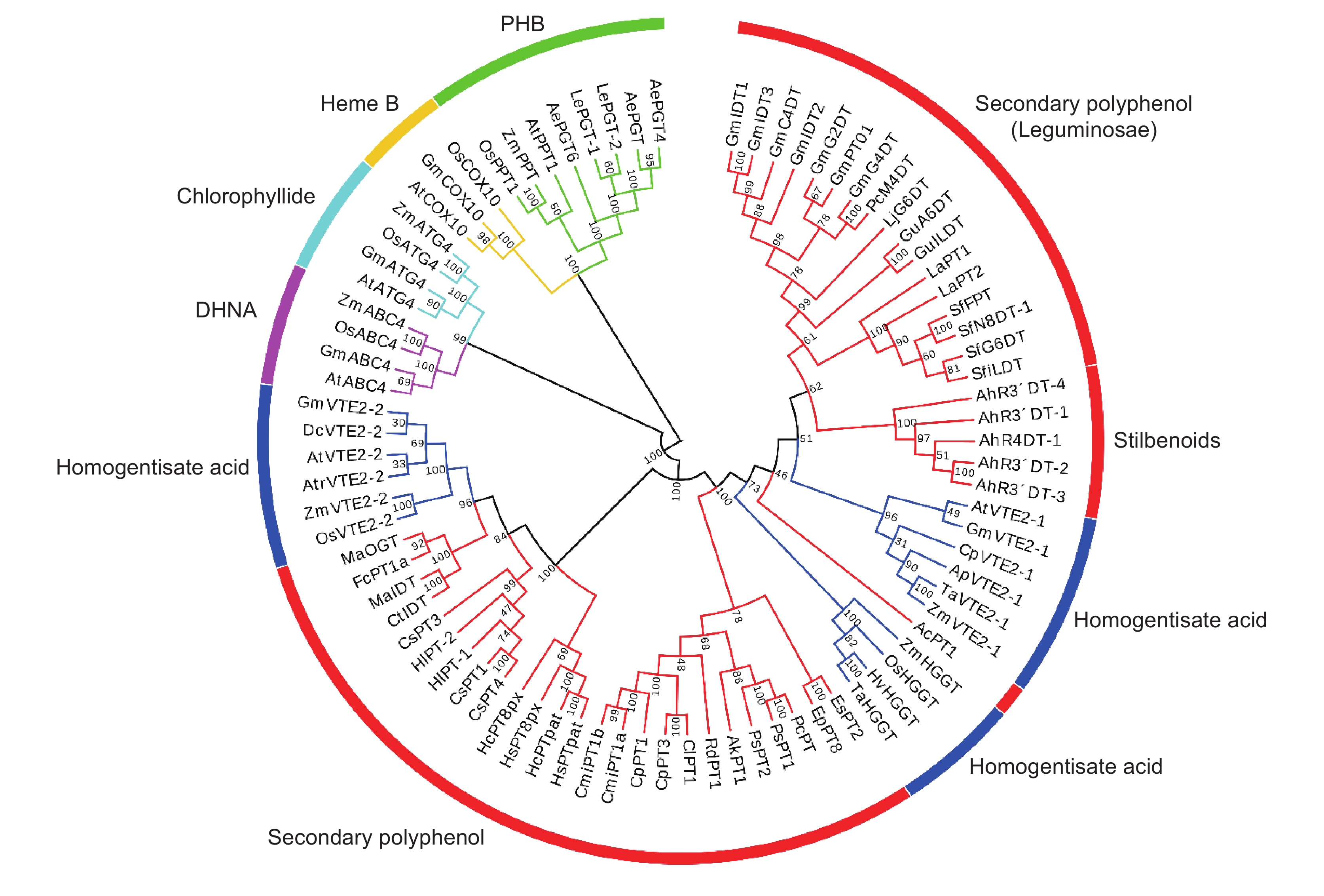
3. 植物次生与初生代谢物合成PTs的系统关系分析
根据目前已鉴定的植物中UbiA膜结合型芳香族异戊烯基转移酶构建了系统发育树(图3)。系统进化分析结果表明,参与植物初生代谢物生物合成的异戊烯基转移酶(PMPTs)可以根据底物类型(对羟基苯甲酸、脱植基叶绿素、亚铁血红素B、1,4-二羟基-2-萘甲酸和尿黑酸)分为5个大组,其中以尿黑酸为底物的HGPT家族又可分为3个亚组,分别参与生育三烯酚、生育酚和质体醌的生物合成。不同植物类群的PMPTs根据其功能(催化底物类型)分别聚在一起。
其中有两个组(分别以对羟基苯甲酸和尿黑酸为底物)发生了产生次生代谢物基因的扩张。第1组,以对羟基苯甲酸为底物的PPTs组,发现5个参与植物次生代谢物紫草素合成的酶(LePGT-1、LePGT-2、AePGT、AePGT4和AePGT6),因此推测其从参与泛醌生物合成的PPTs进化而来。第2组:以尿黑酸为底物的HGPT组,产生了多个类型的PHPTs。这些PHPT并没有按照次生代谢物的底物类型聚在一起,如所有已发现的FPTs,分散在4个不同的小分支中(豆科、小檗科、桑科和大麻科),表现出不同的植物科属独立发生,同科的PHPT聚为一支,每个分支中可能包括多个类型的多酚化合物。如桑科中的香豆素异戊烯基转移酶(FcPT1)和类黄酮异戊烯基转移酶(MaIDT和CtIDT)聚在一起,在分类上与桑科近缘的大麻科中的类黄酮异戊烯基转移酶(CsPT3和CsPT8)和间苯三酚异戊烯基转移酶(HlPT1L和HlPT2)聚在一起,而这两支与质体醌合成相关的VTE2-1亲缘关系较近,因此推测是从质体醌合成相关基因进化而来。豆科的类黄酮异戊烯基转移酶是迄今发现最多的一类,和从豆科中发现的二苯乙烯类异戊烯基转移酶聚为一支,芸香科和伞形科也是同一植物科组成了独立的枝系,包括C-PTs和O-PTs。小檗科的类黄酮异戊烯基转移酶聚为一支,这几个分支与生育酚和生育三烯酚合成相关的PT亲缘关系较近,推测各自独立起源于这一簇。
与异戊烯基连接的多酚类化合物,从结构类型可以分为类黄酮、香豆素、间苯三酚和二苯乙烯类等,以及未来可能发现的其他酚类成分等,除了紫草素,大多从尿黑酸异戊烯基转移酶家族进化而来,同一科的多酚异戊烯基转移酶可能有一致的起源,进而演化出不同的底物选择性。
4. 展望
本文总结了87个植物UbiA膜结合型芳香族异戊烯基转移酶的底物类型和催化特点,包括30个PMPTs和57个PHPTs。PMPTs有非常严格的底物选择性,PHPTs也表现出对底物类型的偏好性,一种PT一般只能催化一种类型的底物,少数可以催化多种类型底物,但对某一种类型的底物催化活性相对较高;PHPTs还表现出对底物催化位点的专一性,邻位有酚羟基的位点更容易发生C-异戊烯基化,O-异戊烯基转移酶报道较少,但也表现出对催化位点的选择性。就异戊烯基供体而言,PMPTs一般可接受C10~C45的中长链异戊烯基,而PHPTs大部分只能接受DMAPP(C5)作为供体,少数可同时接受GPP(C10)作为供体,还有一些只接受GPP作为供体,目前只发现桑中的MaOGT可以接受DMAPP、GPP、FPP(C15)、IPP、GGPP(C20)作为异戊烯基供体,兴安杜鹃中发现的RdPT1可以接受GPP、FPP和GGPP作为供体。相比于植物体内丰富多样的异戊烯基化合物而言,目前报道发现的异戊烯基转移酶基因仍然很少。
许多植物的异戊烯基芳香族化合物在抗炎、抗菌、抗肿瘤、抗氧化等方面具有显著的药理活性。芳香族化合物的异戊烯基化,显著增加了其药理活性和生物利用度。然而,该类化合物在植物中分布有限,且含量较低,通过化学方法合成异戊烯基化合物具有许多局限性,例如修饰位置、数量和立体选择性等。而酵母细胞工厂在合成异戊烯基化合物方面具有潜力,酵母底盘可以提供异戊烯基供体,如DMAPP,通过将特定的异戊烯基转移酶基因转入酵母细胞,利用重组酶对特定的芳香族底物进行定向异戊烯基化[49, 58]。Levisson等[59]将苦参类黄酮异戊烯基转移酶SfFPT引入酿酒酵母菌株PATW066,实现了从头合成8-异戊烯基柚皮素。Wang等[41]报道了使用酿酒酵母菌株CEN.PK2-1C作为细胞工厂,通过修饰12个原生酵母基因,引入11个外源基因(包括淫羊藿类黄酮异戊烯基转移酶EsPT2),构建了能高效生产8-异戊烯基山奈酚的酵母菌株。进一步将GmOMT2引入该酵母菌株的线粒体中,或将该酵母菌与表达GmOMT2的大肠杆菌共培养,产生了具有重要药用价值的淫羊藿素。Luo等[57]在酿酒酵母设计了内源的MVA途径,合成大量的GPP,将橄榄酸(Olivetol acid, OA)合成途径相关的酶以及香叶基转移酶(CsPT4)引入酿酒酵母,构建了大麻酚酸(Cannabigerolic acid,CBGA)、Δ9四氢大麻酚酸(Δ9-Tetrahydrocannabinolic acid,THCA)和大麻二酚酸(Cannabidiolic acid,CBDA)等大麻酚衍生物的全生物合成。然而,PTs参与合成异戊烯基芳香族化合物具有许多挑战:酵母内源的MVA途径定位在内质网或细胞质,而质体定位的PHPTs在没有质体细胞器的酵母中定位是未知的,在化合物合成过程中,酶发挥作用时,对底物和供体的利用率低,这导致异戊烯基化合物的产率低,限制了它们在代谢工程中的应用。
高通量多组学技术的发展,加速了植物功能基因的鉴定,而从目前已报道的PHPTs挖掘策略来看,仍然主要使用传统方法:早期的表达序列标签法(Expressed sequence tag,EST)和同源克隆,这两种方法经常会漏选或筛选到冗余序列,且不能直接获得全长。最近有少量PHPTs基因的发掘是基于基因组或全长转录组的同源搜索,例如通过拟南芥AtVTE2-1序列搜索大豆基因组获得的候选基因,包括GmG2DT、GmC4DT和GmIDT1等[29];通过甘草(Glycyrrhiza uralensis Fisch.)中的GuA6DT序列搜索大麻转录组获得候选基因,如CsPT3[38]。随着生物信息学技术和植物多组学技术的发展,通过基因组学和转录组学联合分析,用基因保守结构域筛选基因家族,并进行系统发育、表达模式、保守基序分析等,可以更全面地筛选候选基因并进行克隆。通过转录组学与代谢组学联合分析,发现不同处理下异戊烯基化合物的含量差异,挖掘这类化合物生物合成的候选基因。更多芳香族异戊烯基转移酶被克隆并鉴定,有助于我们更好地了解该类酶的进化关系及催化机制,解析化合物的生物合成途径,进一步为生物代谢工程和优良品种的培育奠定基础。
1 1)如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。2 1)如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 UbiA异戊烯基转移酶的分类、一般催化机制和供体的结构式
A:异戊二烯焦磷酸结构式;B:UbiA异戊烯基转移酶的一般催化机制;C:异戊烯基转移酶的分类。
Figure 1. Classification and general catalytic mechanism of UbiA prenyltransferases and structural formula of isoprenyl diphosphates
A: Structural formula of isoprenyl diphosphates; B: General catalytic mechanism of UbiA superfamily prenyltransferases; C: Classification of prenyltransferases.
表 1 植物类黄酮异戊烯基转移酶的催化特性
Table 1 Catalytic properties of flavonoid prenyltransferases in plants
物种名称
Species name蛋白名称
Protein name底物类型
Substrate type底物名称
Substrate name异戊烯基供体
Prenyl donor异戊烯基取代位点
Prenyl substitution site二价阳离子
Divalent cation参考文献
References苦参
Sophora flavescens Alt.SfN8DT-1 二氢黄酮 Liquiritigenin>Naringenin>
HesperetinDMAPP A环C-8位 Mg2 + [7] SfiLDT 查尔酮 Isoliquiritigenin DMAPP 未知 Mg2 + [33] SfG6DT 异黄酮 Genistein>Biochanina DMAPP、GPP1、FPP1 A环C-6位 Mg2 + >Ni2 + >
Mn2 + >Ca2 +[33] SfFPT 二氢查尔酮 Phloretin DMAPP、GPP2 A环C-3'位 Mg2 + >Ba2 + >Ca2 + >Fe2 + >Co2 + >Cu2 + >Zn2 + >Mn2 + [28] 二氢黄酮 Eriodictyol>Naringenin>
Pinocembrin>Liquiritigenin>
Hesperetin>Isosakuranetin>
Steppogenin>Tsugafolin>
SakuranetinA环C-8位 黄酮 Chrysin A环C-8位 二氢黄酮醇 Taxifolin A环C-8位 大豆
Glycine max (L.) Merr.GmG4DT 紫檀烷 Glycinol>Maackiain DMAPP A环C-4位 Mg2 + >Mn2 + >Co2 + [30] GmG2DT 紫檀烷 Glycinol DMAPP A环C-2位 Mg2 + >Mn2 + [29] GmPT01 紫檀烷 Glycinol DMAPP A环C-2位 Mg2 + [31] GmIDT1 异黄酮 Daidzein>Genistein DMAPP B环 Mg2 + >Mn2 + [29] GmIDT2 异黄酮 Daidzein≈Genistein DMAPP A环 Mg2 + >Mn2 + [29] GmIDT3 异黄酮 Daidzein、Genistein DMAPP 未知 Mg2 + [31] 白羽扇豆
Lupinus albus L.LaPT1 异黄酮 2-Hydroxygenistein>
GenisteinDMAPP B环C-3'位 Mg2 + >Mn2 + >Ni2 + >Co2 + >Zn2 + >Ca2 + [34] LaPT2 黄酮醇 Kaempferol>Kaempferide>Quercetin>Galangin>
Fesitin>MorinDMAPP A环C-8位 Mg2 + [12] 二氢黄酮 Naringenin DMAPP 未知 甘草
Glycyrrhiza uralensis Fisch.GuA6DT 黄酮 Apigenin>Chrysin>
Diosmtin>Luteolin>
Norartocarpetin>
ChrysoeroilDMAPP、GPP1 A环C-6位 Mg2 + >Mn2 + >Zn2 + >Fe2 + >Co2 + >Ca2 + >Ba2 + [11] GuILDT 查尔酮 2',4'-Dihydroxychalcone>
Isoliquiritigenin>
2,4,2',4'-Tetrahydro-xychalcone>
NaringeninchalconeDMAPP A环C-3'位 Mg2 + >Co2 + >Ni2 + >Fe2 + >Ba2 + >Mn2 + >Ca2 + [35] 百脉根
Lotus japonicus L.LjG6DT 异黄酮 Genistein DMAPP A环C-6位 Mg2 + >Co2 + >Mn2 + >Ca2 + >Zn2 + >Fe2 + [36] 补骨脂
Psoralea corylifolia (L.) Medik.PcM4DT 紫檀烷 Maackiain>3-Hydroxy-9-methoxypterocarpan DMAPP A环C-4位 Mg2 + >Mn2 + >Co2 + >Fe2 + >Ba2 + >Sr2 + >Ca2 + >Sn2 + >Ni2 + >Zn2 + [37] 桑
Morus alba L.MaIDT 查尔酮 Isoliquiritigenin>
2',4'-Dihydroxychalcone>
2,4,2',4'-Tetrahydroxychalcone>
ButeinDMAPP、GPP1 A环C-3'位 Mg2 + >Ba2 + >Ca2 + >Mn2 + >Fe2 + >Ni2 + [32] 异黄酮 Genistein>2'-Hydroxygenistein A环C-6位 黄酮 Apigenin A环C-6位 柘树
Cudrania tricuspidata (Carr.) Bur.CtIDT 查尔酮 Isoliquiritigenin>
2,4,2',4'-Tetrahydroxychalcone>
2',4'-Dihydroxychalcone>
ButeinDMAPP、GPP1 A环C-3'位 Mg2 + >Mn2 + >Ca2 + >Fe2 + >Ba2 + [32] 异黄酮 2'-Hydroxygenistein>
GenisteinA环C-6位 大麻
Cannabis sativa L.CsPT3 黄酮 Chrysoeriol>Apigenin DMAPP、GPP A环C-6位 Mg2 + [38] CsPT8 黄酮 Apigenin DMAPP 未知 Mg2 + [38] 啤酒花
Humulus lupulus L.HlPT-1 查尔酮 Naringenin chalcone DMAPP A环C-3'位 Mg2 + [39] 柔毛淫羊藿
Epimedium pubescens Maxim.EpPT8 黄酮醇 Kaempferol> Quercetin DMAPP A环C-8位 Mg2 + [40] 黄酮 Apigenin 箭叶淫羊藿
Epimedium sagittatum (Sieb. et Zucc.) Maxim.EsPT2 黄酮醇 Kaempferol>Kaempferide DMAPP A环C-8位 Mg2 + [41] 二氢黄酮 Naringenin 注:“>”用于表示对底物的催化活性顺序;1 研究只证明提供了该供体与最适底物发生异戊烯基化反应;2 GPP作为供体时,SfFPT仅催化pinocembrin,isosakuranetin和naringenin发生异戊烯基化反应。 Notes: “>” indicates order of catalytic activity to the substrate; 1 Prenylation of the donor with an optimal substrate is demonstrated; 2 SfFPT only catalyzed prenylation of pinocembrin, isosakuranetin, and naringenin when GPP was used as the prenyl donor. 表 2 植物中香豆素异戊烯基转移酶的催化特性
Table 2 Catalytic properties of coumarin prenyltransferases in plants
物种名称
Species
name蛋白名称
Protein name底物名称
Substrate name异戊烯基
供体
Prenyl donor异戊烯基取代位点
Prenyl substitution
site二价阳离子
Divalent cation参考文献
References欧芹Petroselinum crispum (Mill.) Hill PcPT Umbelliferone DMAPP C-6位>C-8位 Mg2 + [44] 欧防风Pastinaca sativa L. PsPT1 Umbelliferone DMAPP C-6位>C-8位 Mg2 + [42] PsPT2 Umbelliferone DMAPP C-8位>C-6位 Mg2 + [42] 柠檬Citrus limon (L.) Burm. F. ClPT1 Umbelliferone>Esculetin>5,7-hydroxycoumarin
>5-Methoxy-7-hydroxycoumarinGPP C-8位 Mg2 + [45] 无花果Ficus carica L. FcPT1 Umbelliferone DMAPP C-6位 Mg2 + [46] 5-Methoxy-7-hydroxycoumarin DMAPP 未知 Mg2 + 葡萄柚Citrus paradisi Macf. CpPT1 5,7-Dihydroxycoumarin, 8-Hydroxybergapten 5-Hydroxy-7-methoxycoumarin, Bergaptol, GPP 5-OH或8-OH Mg2 + >Ni2 + >Co2 + >Mn2 + >Zn2 + >Ca2 + [47] CpPT3 Umbelliferone GPP C-8位 Mg2 + [47] 小苦橙Citrus micrantha Wester CmiPT1a / b Bergaptol和Xanthotoxol GPP 5-OH或8-OH Mg2 + [47] 明日叶Angelica keiskei (Miquel) Koidz. AkPT1 Bergaptol和Xanthotoxol DMAPP 5-OH或8-OH Mg2 + >Mn2 + >Ca2 + [47] 大豆Glycine max (L.) Merr. GmC4DT Coumestrol DMAPP C-4位 Mg2 + >Mn2 + [29] 九里香Murraya exotica L. MePT1 Umbelliferone GPP C-8位、C-6位和7-OH Mg2 + [48] -
[1] Winkelblech J,Fan AL,Li SM. Prenyltransferases as key enzymes in primary and secondary metabolism[J]. Appl Microbiol Biotechnol,2015,99 (18):7379−7397. doi: 10.1007/s00253-015-6811-y
[2] Yang YH,Ke N,Liu SX,Li WK. Structural and biochemical analysis of intramembrane prenyltransferases in the UbiA superfamiIy[J]. Methods Enzymol,2017,584:309−347.
[3] Li WK. Bringing bioactive compounds into membranes:the UbiA superfamily of intramembrane aromatic prenyltransferases[J]. Trends Biochem Sci,2016,41 (4):356−370. doi: 10.1016/j.tibs.2016.01.007
[4] Bonitz T,Alva V,Saleh O,Lupas AN,Heide L. Evolutionary relationships of microbial aromatic prenyltransferases[J]. PLoS One,2011,6 (11):e27336. doi: 10.1371/journal.pone.0027336
[5] Young IG,Leppik RA,Hamilton JA,Gibson F. Biochemical and genetic studies on ubiquinone biosynthesis in Escherichia coli K-12:4-hydroxybenzoate octaprenyltransferase[J]. J Bacteriol,1972,110 (1):18−25. doi: 10.1128/jb.110.1.18-25.1972
[6] Wang J,Chu SS,Zhu Y,Cheng H,Yu DY. Positive selection drives neofunctionalization of the UbiA prenyltransferase gene family[J]. Plant Mol Biol,2015,87 (4-5):383−394. doi: 10.1007/s11103-015-0285-2
[7] Sasaki K,Mito K,Ohara K,Yamamoto H,Yazaki K. Cloning and characterization of naringenin 8-prenyltransferase,a flavonoid-specific prenyltransferase of Sophora flavescens[J]. Plant Physiol,2008,146 (3):1075−1084. doi: 10.1104/pp.107.110544
[8] Bo ST, Chang SK, Zhu H, Jiang YM, Yang B. Naturally occurring prenylated stilbenoids: food sources, biosynthesis, applications and health benefits[J]. Crit Rev Food Sci Nutr, 2022. Doi: 10.1080/10408398.2022.2056131.
[9] De Bruijn WJC,Levisson M,Beekwilder J,van Berkel WJH,Vincken JP. Plant aromatic prenyltransferases:tools for microbial cell factories[J]. Trends Biotechnol,2020,38 (8):917−934. doi: 10.1016/j.tibtech.2020.02.006
[10] Marin M,Manez S. Recent trends in the pharmacological activity of isoprenyl phenolics[J]. Curr Med Chem,2013,20 (2):272−279. doi: 10.2174/092986713804806676
[11] Li JH,Chen RD,Wang RS,Liu X,Xie D,et al. GuA6DT,a regiospecific prenyltransferase from Glycyrrhiza uralensis,catalyzes the 6-prenylation of flavones[J]. ChemBioChem,2014,15 (11):1673−1681. doi: 10.1002/cbic.201402160
[12] Liu JY,Xia YY,Jiang WB,Shen GA,Pang YZ. LaPT2 gene encodes a flavonoid prenyltransferase in white lupin[J]. Front Plant Sci,2021,12:673337. doi: 10.3389/fpls.2021.673337
[13] Okada K,Ohara K,Yazaki K,Nozaki K,Uchida N,et al. The AtPPT1 gene encoding 4-hydroxybenzoate polyprenyl diphosphate transferase in ubiquinone biosynthesis is required for embryo development in Arabidopsis thaliana[J]. Plant Mol Biol,2004,55 (4):567−577. doi: 10.1007/s11103-004-1298-4
[14] Ohara K,Yamamoto K,Hamamoto M,Sasaki K,Yazaki K. Functional characterization of OsPPT1,which encodes p-hydroxybenzoate polyprenyltransferase involved in ubiquinone biosynthesis in Oryza sativa[J]. Plant Cell Physiol,2006,47 (5):581−590. doi: 10.1093/pcp/pcj025
[15] Yazaki K,Kunihisa M,Fujisaki T,Sato F. Geranyl diphosphate:4-hydroxybenzoate geranyltransferase from Lithospermum erythrorhizon:cloning and characterization of a key enzyme in Shikonin biosynthesis[J]. J Biol Chem,2002,277 (8):6240−6246. doi: 10.1074/jbc.M106387200
[16] Ohara K,Muroya A,Fukushima N,Yazaki K. Functional characterization of LePGT1,a membrane-bound prenyltransferase involved in the geranylation of p-hydroxybenzoic acid[J]. Biochem J,2009,421 (2):231−241. doi: 10.1042/BJ20081968
[17] Wang S,Wang RS,Liu T,Zhan ZL,Kang LP,et al. Production of 3-geranyl-4-hydroxybenzoate acid in yeast,an important intermediate of Shikonin biosynthesis pathway[J]. FEMS Yeast Res,2017,17 (7):fox065.
[18] Venkatesh TV,Karunanandaa B,Free DL,Rottnek JM,Baszis SR,Valentin HE. Identification and characterization of an Arabidopsis homogentisate phytyltransferase paralog[J]. Planta,2006,223 (6):1134−1144. doi: 10.1007/s00425-005-0180-1
[19] Sadre R,Gruber J,Frentzen M. Characterization of homogentisate prenyltransferases involved in plastoquinone-9 and tocochromanol biosynthesis[J]. FEBS Lett,2006,580 (22):5357−5362. doi: 10.1016/j.febslet.2006.09.002
[20] Tian L,DellaPenna D,Dixon RA. The pds2 mutation is a lesion in the Arabidopsis homogentisate solanesyltransferase gene involved in plastoquinone biosynthesis[J]. Planta,2007,226 (4):1067−1073. doi: 10.1007/s00425-007-0564-5
[21] 姚兴兰,王磊,张兰. 植物维生素E生物强化研究进展[J]. 生物技术进展,2020,10(5):479−486. doi: 10.19586/j.2095-2341.2020.0046 Yao XL,Wang L,Zhang L. Progress of vitamin E biofortification in plants[J]. Current Biotechnology,2020,10 (5):479−486. doi: 10.19586/j.2095-2341.2020.0046
[22] Eckhardt U,Grimm B,Hörtensteiner S. Recent advances in chlorophyll biosynthesis and breakdown in higher plants[J]. Plant Mol Biol,2004,56 (1):1−14. doi: 10.1007/s11103-004-2331-3
[23] Hederstedt L. Heme A biosynthesis[J]. Biochim Biophys Acta,2012,1817 (6):920−927. doi: 10.1016/j.bbabio.2012.03.025
[24] Basset GJ,Latimer S,Fatihi A,Soubeyrand E,Block A. Phylloquinone (vitamin K1):occurrence,biosynthesis and functions[J]. Mini-Rev Med Chem,2017,17 (12):1028−1038.
[25] Ming LG,Lv X,Ma XN,Ge BF,Zhen P,et al. The prenyl group contributes to activities of phytoestrogen 8-prenynaringenin in enhancing bone formation and inhibiting bone resorption in vitro[J]. Endocrinology,2013,154 (3):1202−1214. doi: 10.1210/en.2012-2086
[26] Shi SC,Li JC,Zhao XM,Liu QB,Song SJ. A comprehensive review:biological activity,modification and synthetic methodologies of prenylated flavonoids[J]. Phytochemistry,2021,191:112895. doi: 10.1016/j.phytochem.2021.112895
[27] Yang XM,Jiang YM,Yang JL,He JR,Sun J,et al. Prenylated flavonoids,promising nutraceuticals with impressive biological activities[J]. Trends Food Sci Technol,2015,44 (1):93−104. doi: 10.1016/j.jpgs.2015.03.007
[28] Chen RD,Liu X,Zou JH,Yin YZ,Ou B,et al. Regio- and stereospecific prenylation of flavonoids by Sophora flavescens prenyltransferase[J]. Adv Synth Catal,2013,355 (9):1817−1828. doi: 10.1002/adsc.201300196
[29] Yoneyama K,Akashi T,Aoki T. Molecular characterization of soybean pterocarpan 2-dimethylallyltransferase in glyceollin biosynthesis:local gene and whole-genome duplications of prenyltransferase genes led to the structural diversity of soybean prenylated isoflavonoids[J]. Plant Cell Physiol,2016,57 (12):2497−2509. doi: 10.1093/pcp/pcw178
[30] Akashi T,Sasaki K,Aoki T,Ayabe S,Yazaki K. Molecular cloning and characterization of a cDNA for pterocarpan 4-dimethylallyltransferase catalyzing the key prenylation step in the biosynthesis of glyceollin,a soybean phytoalexin[J]. Plant Physiol,2009,149 (2):683−693. doi: 10.1104/pp.108.123679
[31] Sukumaran A,McDowell T,Chen L,Renaud J,Dhaubhadel S. Isoflavonoid-specific prenyltransferase gene family in soybean:GmPT01,a pterocarpan 2-dimethylallyltransferase involved in glyceollin biosynthesis[J]. Plant J,2018,96 (5):966−981. doi: 10.1111/tpj.14083
[32] Wang RS,Chen RD,Li JH,Liu X,Xie KB,et al. Molecular characterization and phylogenetic analysis of two novel regio-specific flavonoid prenyltransferases from Morus alba and Cudrania tricuspidata[J]. J Biol Chem,2014,289 (52):35815−35825. doi: 10.1074/jbc.M114.608265
[33] Sasaki K,Tsurumaru Y,Yamamoto H,Yazaki K. Molecular characterization of a membrane-bound prenyltransferase specific for isoflavone from Sophora flavescens[J]. J Biol Chem,2011,286 (27):24125−24134. doi: 10.1074/jbc.M111.244426
[34] Shen GA,Huhman D,Lei ZT,Snyder J,Sumner LW,Dixon RA. Characterization of an isoflavonoid-specific prenyltransferase from Lupinus albus[J]. Plant Physiol,2012,159 (1):70−80. doi: 10.1104/pp.112.195271
[35] Li JH,Chen RD,Wang RS,Liu X,Xie KB,et al. Biocatalytic access to diverse prenylflavonoids by combining a regiospecific C-prenyltransferase and a stereospecific chalcone isomerase[J]. Acta Pharm Sin B,2018,8 (4):678−686. doi: 10.1016/j.apsb.2018.01.009
[36] Liu JY,Jiang WB,Xia YY,Wang XM,Shen GA,Pang YZ. Genistein-specific G6DT gene for the inducible production of wighteone in Lotus japonicus[J]. Plant Cell Physiol,2018,59 (1):128−141. doi: 10.1093/pcp/pcx167
[37] He JB,Dong ZY,Hu ZM,Kuang Y,Fan JR,et al. Regio-specific prenylation of pterocarpans by a membrane-bound prenyltransferase from Psoralea corylifolia[J]. Org Biomol Chem,2018,16 (36):6760−6766. doi: 10.1039/C8OB01724G
[38] Rea KA,Casaretto JA,Al-Abdul-Wahid MS,Sukumaran A,Geddes-Mcalister J,et al. Biosynthesis of cannflavins A and B from Cannabis sativa L.[J]. Phytochemistry,2019,164:162−171. doi: 10.1016/j.phytochem.2019.05.009
[39] Tsurumaru Y,Sasaki K,Miyawaki T,Uto Y,Momma T,et al. HlPT-1,a membrane-bound prenyltransferase responsible for the biosynthesis of bitter acids in hops[J]. Biochem Biophys Res Commun,2012,417 (1):393−398. doi: 10.1016/j.bbrc.2011.11.125
[40] Shen G,Luo Y,Yao Y,Meng G,Zhang Y,et al. The discovery of a key prenyltransferase gene assisted by a chromosome-level Epimedium pubescens genome[J]. Front Plant Sci,2022,13:1034943.
[41] Wang PP,Li CJ,Li XD,Huang WJ,Wang Y,et al. Complete biosynthesis of the potential medicine icaritin by engineered Saccharomyces cerevisiae and Escherichia coli[J]. Sci Bull,2021,66 (18):1906−1916. doi: 10.1016/j.scib.2021.03.002
[42] Munakata R,Olry A,Karamat F,Courdavault V,Sugiyama A,et al. Molecular evolution of parsnip (Pastinaca sativa) membrane-bound prenyltransferases for linear and/or angular furanocoumarin biosynthesis[J]. New Phytol,2016,211 (1):332−344. doi: 10.1111/nph.13899
[43] Venugopala KN,Rashmi V,Odhav B. Review on natural coumarin lead compounds for their pharmacological activity[J]. Biomed Res Int,2013,2013:963248.
[44] Karamat F,Olry A,Munakata R,Koeduka T,Sugiyama A,et al. A coumarin-specific prenyltransferase catalyzes the crucial biosynthetic reaction for furanocoumarin formation in parsley[J]. Plant J,2014,77 (4):627−638. doi: 10.1111/tpj.12409
[45] Munakata R,Inoue T,Koeduka T,Karamat F,Olry A,et al. Molecular cloning and characterization of a geranyl diphosphate-specific aromatic prenyltransferase from lemon[J]. Plant Physiol,2014,166 (1):80−90. doi: 10.1104/pp.114.246892
[46] Munakata R,Kitajima S,Nuttens A,Tatsumi K,Takemura T,et al. Convergent evolution of the UbiA prenyltransferase family underlies the independent acquisition of furanocoumarins in plants[J]. New Phytol,2020,225 (5):2166−2182. doi: 10.1111/nph.16277
[47] Munakata R,Olry A,Takemura T,Tatsumi K,Ichino T,et al. Parallel evolution of UbiA superfamily proteins into aromatic O-prenyltransferases in plants[J]. Proc Natl Acad Sci USA,2021,118 (17):e2022294118. doi: 10.1073/pnas.2022294118
[48] Li N,Liu X,Zhang ML,Zhang ZK,Zhang BB,et al. Characterization of a coumarin C-/O-prenyltransferase and a quinolone C-prenyltransferase from Murraya exotica[J]. Org Biomol Chem,2022,20 (28):5535−5542. doi: 10.1039/D2OB01054B
[49] Li HX,Ban ZN,Qin H,Ma LY,King AJ,Wang GD. A heteromeric membrane-bound prenyltransferase complex from hop catalyzes three sequential aromatic prenylations in the bitter acid pathway[J]. Plant Physiol,2015,167 (3):650−659. doi: 10.1104/pp.114.253682
[50] Fiesel T,Gaid M,Müller A,Bartels J,El-Awaad I,et al. Molecular cloning and characterization of a xanthone prenyltransferase from Hypericum calycinum cell cultures[J]. Molecules,2015,20 (9):15616−15630. doi: 10.3390/molecules200915616
[51] Nagia M,Gaid M,Biedermann E,Fiesel T,El-Awaad I,et al. Sequential regiospecific gem-diprenylation of tetrahydroxyxanthone by prenyltransferases from Hypericum sp.[J]. New Phytol,2019,222 (1):318−334. doi: 10.1111/nph.15611
[52] Akinwumi BC,Bordun KAM,Anderson HD. Biological activities of stilbenoids[J]. Int J Mol Sci,2018,19 (3):792. doi: 10.3390/ijms19030792
[53] Yang TH,Fang LL,Sanders S,Jayanthi S,Rajan G,et al. Stilbenoid prenyltransferases define key steps in the diversification of peanut phytoalexins[J]. J Biol Chem,2018,293 (1):28−46. doi: 10.1074/jbc.RA117.000564
[54] Zhong ZH,Zhu W,Liu SZ,Guan QJ,Chen X,et al. Molecular characterization of a geranyl diphosphate-specific prenyltransferase catalyzing stilbenoid prenylation from Morus alba[J]. Plant Cell Physiol,2018,59 (11):2214−2227.
[55] Munakata R,Takemura T,Tatsumi K,Moriyoshi E,Yanagihara K,et al. Isolation of Artemisia capillaris membrane-bound di-prenyltransferase for phenylpropanoids and redesign of artepillin C in yeast[J]. Commun Biol,2019,2:384. doi: 10.1038/s42003-019-0630-0
[56] Saeki H,Hara R,Takahashi H,Iijima M,Munakata R,et al. An aromatic farnesyltransferase functions in biosynthesis of the anti-HIV meroterpenoid daurichromenic acid[J]. Plant Physiol,2018,178 (2):535−551. doi: 10.1104/pp.18.00655
[57] Luo XZ,Reiter MA,D’Espaux L,Wong J,Denby CM,et al. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast[J]. Nature,2019,567 (7746):123−126. doi: 10.1038/s41586-019-0978-9
[58] Marsafari M,Samizadeh H,Rabiei B,Mehrabi A,Koffas M,Xu P. Biotechnological production of flavonoids:an update on plant metabolic engineering,microbial Host selection,and genetically encoded biosensors[J]. Biotechnol J,2020,15 (8):1900432. doi: 10.1002/biot.201900432
[59] Levisson M,Araya-Cloutier C,de Bruijn WJC,van Der Heide M,Salvador López JM,et al. Toward developing a yeast cell factory for the production of prenylated flavonoids[J]. J Agric Food Chem,2019,67 (49):13478−13486. doi: 10.1021/acs.jafc.9b01367
-
期刊类型引用(0)
其他类型引用(2)
-
其他相关附件
-
DOCX格式
落艳娇附图1-2 点击下载(980KB)
-



 下载:
下载: